相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、逆水煤气变换体系中存在以下两个反应:
反应I:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。
下列说法错误的是
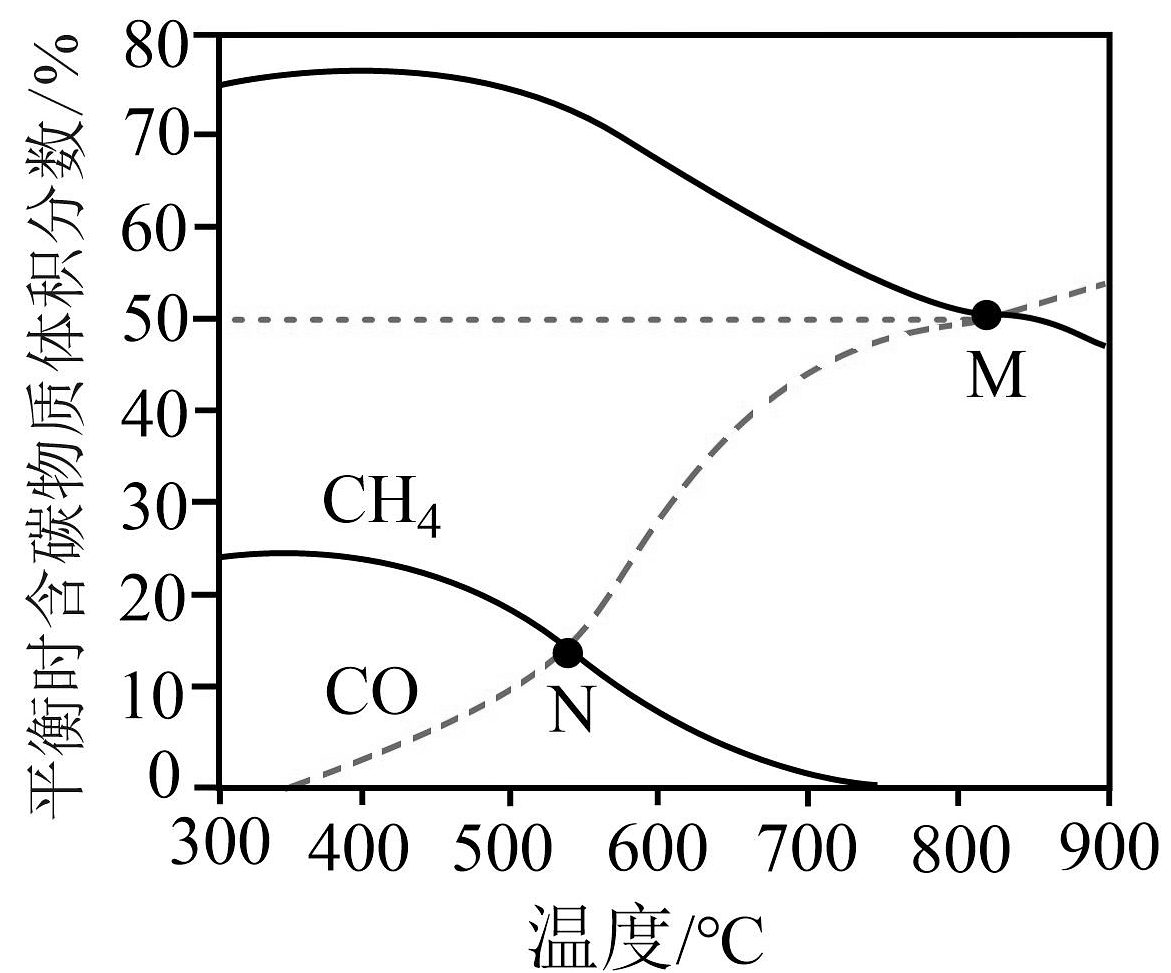 A、 B、M点反应I的平衡常数 C、N点的压强是的3倍 D、500℃后,温度升高,反应I的改变程度大于反应Ⅱ,导致转化率明显增大
A、 B、M点反应I的平衡常数 C、N点的压强是的3倍 D、500℃后,温度升高,反应I的改变程度大于反应Ⅱ,导致转化率明显增大 -
2、室温下,通过下列实验探究的性质。已知 ,
实验1:将气体通入水中,测得溶液。
实验2:将气体通入溶液中,当溶液时停止通气。
实验3:将气体通入酸性溶液中,当溶液恰好褪色时停止通气。
下列说法错误的是
A、实验1所得溶液中: B、实验2所得溶液中: C、实验2所得溶液经蒸干、灼烧不能得到纯净的固体 D、实验3所得溶液中: -
3、下列实验方案能达到探究目的的是
选项
探究方案
探究目的
A
用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察火焰的颜色
溶液中是否含
B
用溶液分别中和等体积的溶液和溶液,比较消耗溶液体积的多少
比较、酸性的强弱
C
将溶于盐酸,然后向其中滴入酸性溶液,观察溶液颜色的变化
中是否含有
D
向溶液中先滴加几滴溶液,无明显现象,再滴加适量稀盐酸,观察是否有沉淀产生
是否具有氧化性
A、A B、B C、C D、D -
4、一种浓差电池的放电原理是利用电解质溶液的浓度不同而产生电流。某浓差电池装置示意图如图所示,该电池使用前将开关K先与a连接一段时间后再与b连接。下列说法正确的是
 A、交换膜应当选择阳离子交换膜 B、K与b连接时,电极A的质量相比于K与a相连时,质量会减轻 C、K与b连接时,电极B上发生的反应为 D、电极K与b连接时,电极A发生还原反应
A、交换膜应当选择阳离子交换膜 B、K与b连接时,电极A的质量相比于K与a相连时,质量会减轻 C、K与b连接时,电极B上发生的反应为 D、电极K与b连接时,电极A发生还原反应 -
5、化学常用图像直观地描述化学反应的进程或结果。下列有关的图像描述正确的是
 A、图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明时刻溶液的温度最高 B、图乙表示平衡时体积分数随起始变化的曲线,则的转化率: C、图丙是室温下用溶液分别滴定同浓度同体积的三种滴定曲线,可推知的酸性最强 D、图丁为一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应前后气体体积一定不变
A、图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明时刻溶液的温度最高 B、图乙表示平衡时体积分数随起始变化的曲线,则的转化率: C、图丙是室温下用溶液分别滴定同浓度同体积的三种滴定曲线,可推知的酸性最强 D、图丁为一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应前后气体体积一定不变 -
6、在一定条件下,苯基丙炔()可与发生催化加成,反应如下:

反应过程中该炔烃及反应产物的占比随时间的变化如上图(已知:反应I、Ⅱ为放热反应),下列说法正确的是
A、反应I是吸热反应 B、反应活化能:反应Ⅱ<反应I C、在给定的条件下,即使增加浓度也不能改变平衡时产物Ⅱ和产物I的比例 D、选择相对较短的反应时间,及时分离可获得高产率的产物Ⅱ -
7、下列说法正确的是A、室温下,的醋酸和的溶液等体积混合后溶液显酸性 B、采用电化学方法可以防止钢铁腐蚀,如可以将钢铁与电源正极相连以达到防腐目的 C、做酸碱中和滴定实验时,眼睛既要观察锥形瓶中溶液的颜色变化,又要关注滴定管中溶液的下降快慢 D、一定条件下,将和置于密闭容器中充分反应生成放热 , 其热化学方程式为
-
8、向绝热恒容密闭容器中通入和 , 在一定条件下使达到平衡,正反应速率随时间变化的示意图如图所示,下列叙述错误的是
 A、c点反应没有达到平衡 B、正反应的活化能大于逆反应的活化能 C、体系压强不再变化,说明反应达到平衡状态 D、浓度:b点>c点
A、c点反应没有达到平衡 B、正反应的活化能大于逆反应的活化能 C、体系压强不再变化,说明反应达到平衡状态 D、浓度:b点>c点 -
9、下列方程式书写正确的是A、溶液显碱性的原因: B、胶体的制备:(胶体) C、体现的燃烧热: D、电解(熔融)制备的阳极反应:
-
10、下列关于可逆反应和化学平衡的说法,正确的是A、催化剂可以改变某确定温度下某反应的平衡常数 B、温度是唯一可以影响平衡常数的环境因素 C、工业合成氨选择较高的温度是为了增大反应的平衡常数 D、增大反应物浓度一定能增大反应速率
-
11、下列说法正确的是A、测定盐酸与氢氧化钠反应的焓变,保温效果不好会使所测偏大 B、太阳能电池是一种将化学能转化为电能的装置 C、常温下,能够自发进行,则该反应的 D、通过用试纸检测出溶液的 , 就可以判断是否发生了水解
-
12、某研究小组按下列路线合成镇痛药盐酸瑞芬太尼:

已知:
 。请回答:(1)、下列说法不正确的是_______。A、化合物A可发生加成、取代、氧化反应 B、化合物C具有两性 C、化合物D中含有两个手性碳原子 D、盐酸瑞芬太尼的化学式为(2)、化合物F含氧官能团的名称是。(3)、写出化合物G的结构简式。(4)、写出D→E的化学方程式。(5)、设计以、为原料合成G的路线(用流程图表示,无机试剂任选)。(6)、写出化合物A同时符合下列条件的同分异构体的结构简式。
。请回答:(1)、下列说法不正确的是_______。A、化合物A可发生加成、取代、氧化反应 B、化合物C具有两性 C、化合物D中含有两个手性碳原子 D、盐酸瑞芬太尼的化学式为(2)、化合物F含氧官能团的名称是。(3)、写出化合物G的结构简式。(4)、写出D→E的化学方程式。(5)、设计以、为原料合成G的路线(用流程图表示,无机试剂任选)。(6)、写出化合物A同时符合下列条件的同分异构体的结构简式。①分子中含有
 , 且环上不直接连氢。不含碳碳三键及其它环;
, 且环上不直接连氢。不含碳碳三键及其它环;②表明:分子中共有4种化学环境的氢原子(不考虑顺反异构)。
-
13、和合成甲醇是资源化利用的重要方法,总反应为: 。(1)、有利于提高甲醇平衡产率的条件有
A.低温低压 B.高温低压 C.低温高压 D.高温高压 E.催化剂
(2)、制备甲醇的反应一般认为通过如下步骤来实现:Ⅰ.
Ⅱ.
在体积为2L的密闭容器中按物质的量之比为充入和发生反应Ⅱ,测得平衡混合物中的体积分数在不同压强下随温度的变化如图1所示。

①下列说法正确的是。
A.图像中
B.A、B、C、D的平衡常数大小关系
C.反应速率(状态A)(状态B)
D.在C点时,的转化率为75%
②C点对应的平衡常数(对于气相反应,用组分B的平衡压强代替物质的量浓度也可以表示平衡常数,记作 , 如 , 为平衡压强,为平衡系统中B的物质的量分数)。
(3)、一定反应条件下,各物质以碳元素计的物质的量分数与时间的关系如图2所示,请解释对应的曲线出现极大值的原因。 (4)、若起始时加入合适的催化剂加快反应Ⅰ的速率,请在图3中画出此条件下CO以碳元素计的物质的量分数随时间变化的图像。
(4)、若起始时加入合适的催化剂加快反应Ⅰ的速率,请在图3中画出此条件下CO以碳元素计的物质的量分数随时间变化的图像。 (5)、和合成甲烷也是资源化利用的重要方法。一定条件下催化剂可使“甲烷化”从而变废为宝,其反应机理如图4所示,下列说法不正确的是_______。
(5)、和合成甲烷也是资源化利用的重要方法。一定条件下催化剂可使“甲烷化”从而变废为宝,其反应机理如图4所示,下列说法不正确的是_______。 A、该反应的化学方程式为 B、通过的结合,在催化剂表面生成碳酸盐类物质 C、反应过程中碳元素的化合价为价的中间体是 D、该反应过程中有中间体生成
A、该反应的化学方程式为 B、通过的结合,在催化剂表面生成碳酸盐类物质 C、反应过程中碳元素的化合价为价的中间体是 D、该反应过程中有中间体生成 -
14、化合物X由三种元素组成,某学习小组按如下流程进行实验:

其中,溶液C含有一种摩尔质量为的含氧弱酸,其物质的量为。
(1)、X的组成元素是 , X的化学式是。(2)、写出溶液A与足量稀硫酸反应的化学方程式。(3)、写出生成紫黑色固体D的离子方程式。(4)、请设计实验检验溶液C中的一种阴离子。 -
15、常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知 , (酸根离子)(酸根离子)。下列说法不正确的是
 A、曲线Ⅱ为沉淀溶解曲线 B、加入适量的氯化钙固体,可使溶液由c点变到a点 C、b点对应的硫酸钙溶液不饱和 D、向碳酸钙饱和溶液中通入气体,溶液中不变
A、曲线Ⅱ为沉淀溶解曲线 B、加入适量的氯化钙固体,可使溶液由c点变到a点 C、b点对应的硫酸钙溶液不饱和 D、向碳酸钙饱和溶液中通入气体,溶液中不变 -
16、甲烷与氯气在光照条件下发生取代反应的部分机理与能量变化如下:
链引发: ,
链增长:部分反应进程与势能变化关系如图(所有物质状态为气态)……
链终止: ,
下列说法不正确的是
 A、的键能为 B、链增长中反应速率较快的一步的热化学方程式为: C、链增长过程中可能产生 , , D、链终止反应的过程中,还可能会生成少量的乙烷
A、的键能为 B、链增长中反应速率较快的一步的热化学方程式为: C、链增长过程中可能产生 , , D、链终止反应的过程中,还可能会生成少量的乙烷 -
17、胆矾的结构示意图如图。下列有关胆矾的说法正确的是
 A、氧原子参与形成配位键和氢键两种化学键 B、上述结构中所有氧原子都采取杂化 C、配位后形成的空间结构是正八面体 D、胆矾中的水在不同温度下可能会分步失去
A、氧原子参与形成配位键和氢键两种化学键 B、上述结构中所有氧原子都采取杂化 C、配位后形成的空间结构是正八面体 D、胆矾中的水在不同温度下可能会分步失去 -
18、化合物X结构如图,下列说法不正确的是
 A、1mol该物质与足量溴水反应,最多可消耗 B、所有C原子可能共平面 C、分子中含4种含氧官能团 D、在酸性条件下水解的产物均可使酸性溶液褪色
A、1mol该物质与足量溴水反应,最多可消耗 B、所有C原子可能共平面 C、分子中含4种含氧官能团 D、在酸性条件下水解的产物均可使酸性溶液褪色 -
19、下列说法不正确的是A、葡萄糖是最简单的醛糖 B、蛋白质的一级结构对蛋白质的性质和功能起着决定性作用 C、核酸是一种生物大分子 D、高压法聚乙烯支链较多,密度和软化温度较低
-
20、下列反应的离子方程式不正确的是A、次氯酸钠溶液中通入过量的二氧化碳: B、氢氧化铝溶于氢氧化钠溶液: C、过氧化钠与水反应: D、氯化银中滴加浓氨水: