相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、一种杀菌剂的结构式如图所示,元素X、Y、Z、W、T、Q原子序数依次增大且在前四周期均有分布,Y、Z、W在同一周期,和在同一主族,的价层电子排布式为 , 下列说法正确的是
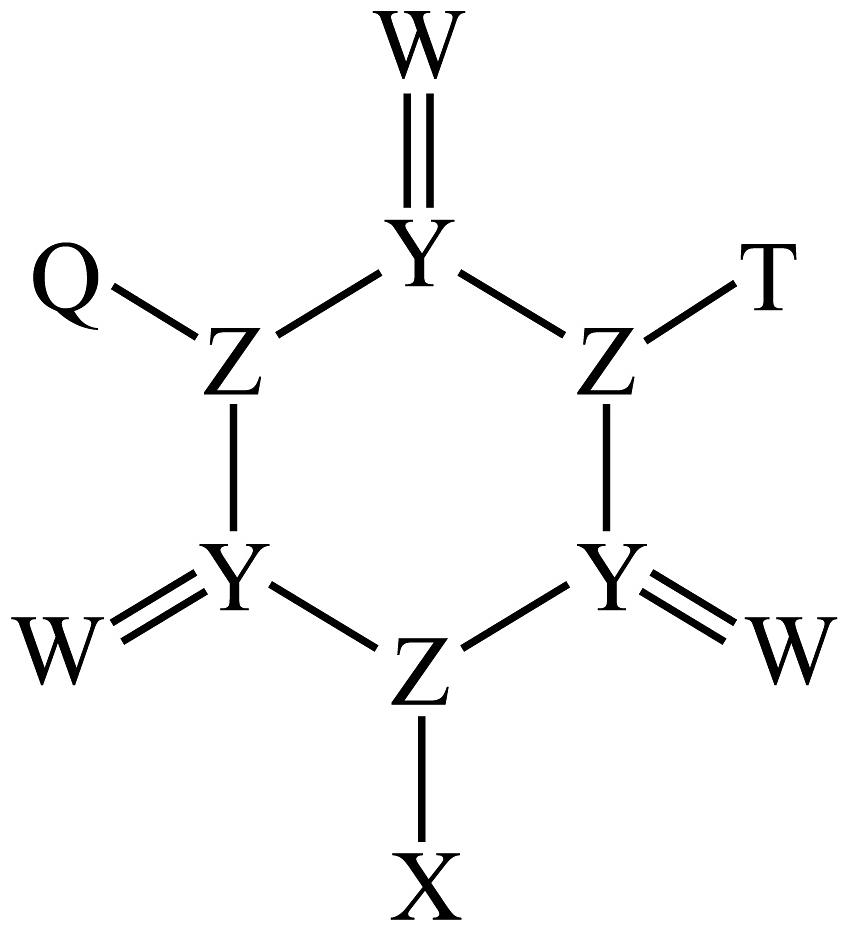 A、的空间结构为平面三角形 B、元素的电负性大小: C、元素的第一电离能: D、最高价氧化物的水化物的酸性:
A、的空间结构为平面三角形 B、元素的电负性大小: C、元素的第一电离能: D、最高价氧化物的水化物的酸性: -
2、下列陈述I、II均正确且存在因果关系的是
选项
陈述I
陈述II
A
酸性:
吸电子效应:
B
金属钠具有强还原性
钠可置换出溶液中的铁单质
C
次氯酸具有漂白性
漂白液在空气中久置易变质
D
往氯乙烷中加入浓溶液后共热,冷却后加入少量溶液,有白色沉淀生成
可证明氯乙烷中含有氯原子
A、A B、B C、C D、D -
3、某实验小组利用下图装置探究浓硫酸与葡萄糖反应生成的气体成分。下列说法正确的是
 A、本实验只体现浓硫酸的脱水性 B、装置b中出现的白色沉淀,可能是BaCO3或BaSO3 C、装置d中出现浑浊,证明产生的气体中含有CO2 D、装置e中可以盛放NaOH溶液
A、本实验只体现浓硫酸的脱水性 B、装置b中出现的白色沉淀,可能是BaCO3或BaSO3 C、装置d中出现浑浊,证明产生的气体中含有CO2 D、装置e中可以盛放NaOH溶液 -
4、为阿伏加德罗常数的值,下列说法正确的是A、分别与足量氯气和硫完全反应时转移的电子数均为 B、中含有的阴、阳离子数共 C、醋酸铵溶液呈中性,则的醋酸铵溶液中数为 D、中键数为
-
5、《哪吒2之魔童闹海》中太乙真人使用藕粉为哪吒和敖丙重塑肉身。尼克酸是藕的主要成分之一,其结构如图所示
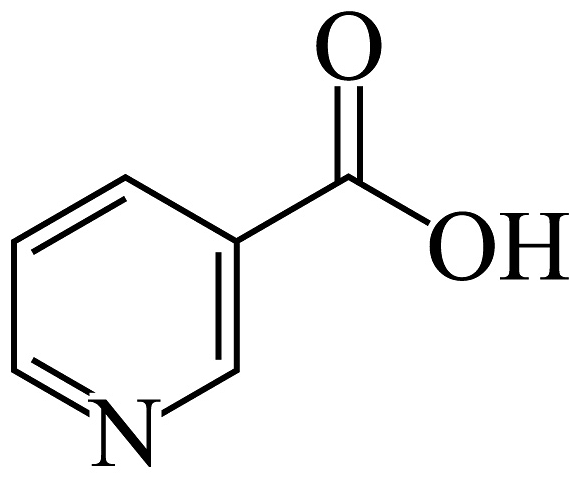 (
( 与苯环相似)。下列说法错误的是 A、尼克酸分子中有两个手性碳原子 B、尼克酸的分子式为 C、尼克酸的所有原子可能共平面 D、尼克酸能发生取代、加成和氧化反应
与苯环相似)。下列说法错误的是 A、尼克酸分子中有两个手性碳原子 B、尼克酸的分子式为 C、尼克酸的所有原子可能共平面 D、尼克酸能发生取代、加成和氧化反应 -
6、1727年,英国的化学家哈尔斯用氯化铵与石灰的混合物合成了氨气。以下实验难以达到预期目的的是


A.制备
B.干燥


C.尾气处理
D.喷泉实验
A、A B、B C、C D、D -
7、从海带中提取碘的过程如下,其中操作为
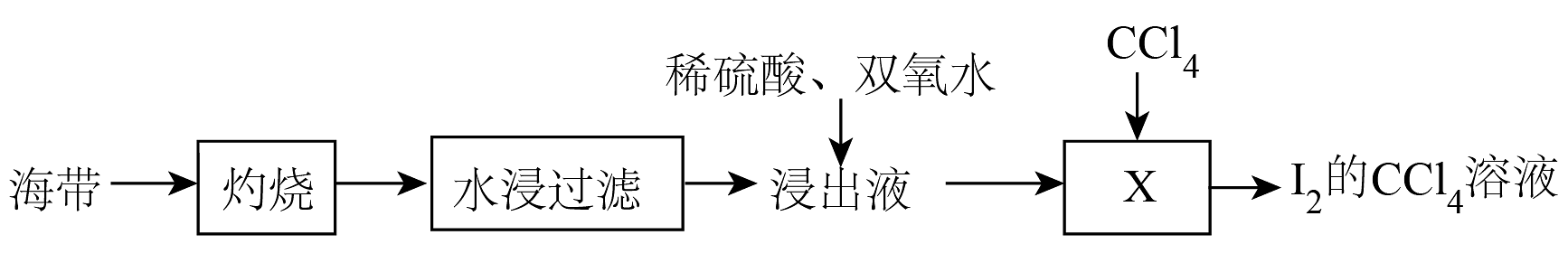 A、过滤 B、蒸馏 C、结晶 D、萃取
A、过滤 B、蒸馏 C、结晶 D、萃取 -
8、“华龙一号”标志着中国进入核电技术先进国家行列。下列说法正确的是A、蒸汽发生器中水吸收热量变成蒸汽:共价键被破坏 B、碳化硼用作核反应堆的控制棒:碳化硼含极性共价键 C、用低浓缩铀()制成燃料棒:的中子数为92 D、汽轮机高速运转使发电机发电:该过程机械能转化为化学能
-
9、中国是农业大国,粮食安全是国家安全的重要部分。下列说法不正确的是A、水稻种子中含有淀粉,淀粉属于高分子 B、收割机的割刀为铁合金,该合金比纯铁硬度大 C、“秸秆炭化,草灰还田”,草木灰可以用作钾肥 D、CuSO4可制备杀菌剂波尔多液,因为SO能使蛋白质变性
-
10、蛇是十二生肖之一,下列有关蛇的历史文物中,主要材质为金属材料的是


A.商周石蛇
B.春秋蛇纹铜提链罐

C.唐彩绘生肖蛇陶俑
D.清青玉十二辰-蛇
A、A B、B C、C D、D -
11、罗沙司他可用于治疗由慢性肾病引发的贫血,一种合成路线如下。

已知:
i.

ii.表示某易离去的基团
iii.

 (1)、A含有的官能团为。(2)、的化学方程式为。(3)、的反应类型为。(4)、G的结构简式为。(5)、K经多步可得到N,写出L与M的结构简式L:;M:。
(1)、A含有的官能团为。(2)、的化学方程式为。(3)、的反应类型为。(4)、G的结构简式为。(5)、K经多步可得到N,写出L与M的结构简式L:;M:。 (6)、试剂b的分子式为。的转化过程中,还会发生多个副反应。写出其中一个副反应产物的结构简式:(核磁共振氢谱有2组峰,且面积比为)。
(6)、试剂b的分子式为。的转化过程中,还会发生多个副反应。写出其中一个副反应产物的结构简式:(核磁共振氢谱有2组峰,且面积比为)。 -
12、我国科学家在中国空间站首次实现了铟硒半导体的微重力培养,铟(In)和硒(Se)的单质是制备铟硒半导体的重要原料。(1)、主族元素In原子序数为49,其位于元素周期表的区。(2)、粗硒中主要含碲(Te)单质等杂质。硒与碲同主族,可用气态氢化物热解法制备少量的高纯硒,流程如下图。

结合元素周期律解释该法能分离硒和碲的原因:。
(3)、氧化挥发法是制备高纯硒的另一种方法。粗硒经高温氧化后产生蒸气,冷凝后溶于水形成溶液,除杂后向溶液中通入可获得高纯硒。①已知分子中含两个羟基,中Se的杂化方式为。
②向溶液中通入时,发生反应的化学方程式为。
(4)、一种铟硒半导体晶体的晶胞如图,晶胞底面边长为a pm,高为c pm。
①该晶体的化学式为。
②阿伏加德罗常数为 , 该晶体的密度为。(已知:)
-
13、为研究浓硝酸与Cu的反应,进行如图所示实验。下列说法不正确的是
 A、滴入浓硝酸后,无需加热即可反应 B、反应开始后,试管中产生红棕色气体,说明浓硝酸具有氧化性 C、反应消耗0.05mol Cu时,转移电子数约为 D、若将铜片换成铝片,无明显现象,说明还原性:Al<Cu
A、滴入浓硝酸后,无需加热即可反应 B、反应开始后,试管中产生红棕色气体,说明浓硝酸具有氧化性 C、反应消耗0.05mol Cu时,转移电子数约为 D、若将铜片换成铝片,无明显现象,说明还原性:Al<Cu -
14、 含呋喃骨架的芳香化合物在环境化学和材料化学领域具有重要价值。一种含呋喃骨架的芳香化合物合成路线如下:

回答下列问题:
(1)、A→B的化学方程式为。(2)、C→D实现了由到的转化(填官能团名称)。(3)、G→H的反应类型为。(4)、E的同分异构体中,含苯环(不含其他环)且不同化学环境氢原子个数比为的同分异构体的数目有种。(5)、M→N的三键加成反应中,若参与成键的苯环及苯环的反应位置不变,则生成的与N互为同分异构体的副产物结构简式为。(6)、参考上述路线,设计如下转化。X和Y的结构简式分别为和。
-
15、 乙二醇是一种重要化工原料,以合成气为原料合成乙二醇具有重要意义。
Ⅰ.直接合成法: , 不同温度下平衡常数如下表所示。
温度
298K
355K
400K
平衡常数
10
(1)、该反应的0(填“>”或“<”)。(2)、已知的燃烧热分别为 , 则上述合成反应的(用a、b和c表示)。(3)、实验表明,在500K时,即使压强(34MPa)很高乙二醇产率(7%)也很低,可能的原因是(答出1条即可)。Ⅱ.间接合成法:用合成气和制备的DMO合成乙二醇,发生如下3个均放热的连续反应,其中MG生成乙二醇的反应为可逆反应。
 (4)、在2MPa、催化、固定流速条件下,发生上述反应,初始氢酯比 , 出口处检测到DMO的实际转化率及MG、乙二醇、乙醇的选择性随温度的变化曲线如图所示[某物质的选择性]。
(4)、在2MPa、催化、固定流速条件下,发生上述反应,初始氢酯比 , 出口处检测到DMO的实际转化率及MG、乙二醇、乙醇的选择性随温度的变化曲线如图所示[某物质的选择性]。
①已知曲线Ⅱ表示乙二醇的选择性,则曲线(填图中标号,下同)表示DMO的转化率,曲线表示MG的选择性。
②有利于提高A点DMO转化率的措施有(填标号)。
A.降低温度 B.增大压强
C.减小初始氢酯比 D.延长原料与催化剂的接触时间
③483K时,出口处的值为(精确至0.01)。
④A点反应的浓度商(用物质的量分数代替浓度计算,精确至0.001)。
-
16、 某实验小组采用如下方案实现了对甲基苯甲酸的绿色制备。
反应:

步骤:
Ⅰ.向反应管中加入0.12g对甲基苯甲醛和1.0mL丙酮,光照,连续监测反应进程。
Ⅱ.5h时,监测结果显示反应基本结束,蒸去溶剂丙酮,加入过量稀NaOH溶液,充分反应后,用乙酸乙酯洗涤,弃去有机层。
Ⅲ.用稀盐酸调节水层后,再用乙酸乙酯萃取。
Ⅳ.用饱和食盐水洗涤有机层,无水干燥,过滤,蒸去溶剂,得目标产物。
回答下列问题:
(1)、相比作氧化剂,该制备反应的优点为、(答出2条即可)。(2)、根据反应液的核磁共振氢谱(已去除溶剂H的吸收峰,谱图中无羧基H的吸收峰)监测反应进程如下图。已知峰面积比 , 。反应2h时,对甲基苯甲醛转化率约为%。 (3)、步骤Ⅱ中使用乙酸乙酯洗涤的目的是。(4)、步骤Ⅲ中反应的离子方程式为、。(5)、用同位素示踪法确定产物羧基O的来源。丙酮易挥发,为保证气氛,通前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的 , 操作顺序为:①→②→→→(填标号),重复后四步操作数次。
(3)、步骤Ⅱ中使用乙酸乙酯洗涤的目的是。(4)、步骤Ⅲ中反应的离子方程式为、。(5)、用同位素示踪法确定产物羧基O的来源。丙酮易挥发,为保证气氛,通前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的 , 操作顺序为:①→②→→→(填标号),重复后四步操作数次。
同位素示踪结果如下表所示,则目标产物中羧基O来源于醛基和。
反应条件
质谱检测目标产物相对分子质量
太阳光, , 室温, , 5h
138
太阳光,空气,室温, , 5h
136
-
17、 某工厂采用如下工艺回收废渣(含有ZnS、、FeS和CuCl)中的Zn、Pb元素。

已知:①“氧化浸出”时,不发生变化,ZnS转变为;
②;
③酒石酸(记作)结构简式为。
回答下列问题:
(1)、分子中手性碳原子数目为。(2)、“氧化浸出”时,过二硫酸根转变为(填离子符号)。(3)、“氧化浸出”时,浸出率随温度升高先增大后减小的原因为。(4)、“除铜”步骤中发生反应的离子方程式为。(5)、滤渣2中的金属元素为(填元素符号)。(6)、“浸铅”步骤,和反应生成PbA。PbA产率随体系pH升高先增大的原因为 , pH过高可能生成(填化学式)。(7)、290℃“真空热解”生成2种气态氧化物,该反应的化学方程式为。 -
18、 室温下,将置于溶液中,保持溶液体积和N元素总物质的量不变,pX-pH曲线如图,和的平衡常数分别为和:的水解常数。下列说法错误的是( )
 A、Ⅲ为的变化曲线 B、D点: C、 D、C点:
A、Ⅲ为的变化曲线 B、D点: C、 D、C点: -
19、 一定条件下,“”4种原料按固定流速不断注入连续流动反应器中,体系pH-t振荡图像及涉及反应如下。其中AB段发生反应①~④,①②为快速反应。下列说法错误的是( )

①
②
③
④
⑤
A、原料中不影响振幅和周期 B、反应④: C、反应①~④中,对的氧化起催化作用 D、利用pH响应变色材料,可将pH振荡可视化 -
20、 一种基于的储氯电池装置如图,放电过程中a、b极均增重。若将b极换成Ag/AgCl电极,b极仍增重。关于图中装置所示电池,下列说法错误的是( )
 A、放电时向b极迁移 B、该电池可用于海水脱盐 C、a极反应: D、若以Ag/AgCl电极代替a极,电池将失去储氯能力
A、放电时向b极迁移 B、该电池可用于海水脱盐 C、a极反应: D、若以Ag/AgCl电极代替a极,电池将失去储氯能力