相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、为达成2060年碳中和的远景目标,一种能够捕捉CO2的电化学装置如下图所示,下列说法错误的是
 A、Al电极为电池的负极 B、石墨电极反应为2CO2+2e-= C、每生成1mol草酸铝,外电路中转移3mol电子 D、在捕捉CO2过程中,不断向Al电极移动
A、Al电极为电池的负极 B、石墨电极反应为2CO2+2e-= C、每生成1mol草酸铝,外电路中转移3mol电子 D、在捕捉CO2过程中,不断向Al电极移动 -
2、根据实验目的设计方案并进行实验,观察相关现象,其中方案设计或结论不正确的是
选项
实验目的
方案设计
现象
结论
A
比较乙醇和苯酚中羟基的活泼性
取相同物质的量的乙醇和苯酚分别溶于2mL乙醚,各加入一小块金属钠
苯酚溶液与金属钠反应较剧烈
羟基活泼性:苯酚>乙醇
B
检验苯中是否含有少量苯酚
向溶液中加入适量浓溴水
没有观察到白色沉淀
苯中不含苯酚
C
检验乙醇是否发生消去反应
将乙醇和浓硫酸共热产生的气体依次通入足量KOH溶液、酸性KMnO4溶液
KMnO4溶液紫红色褪去
乙醇发生了
消去反应
D
探究SO2的漂白原理
将SO2分别通入品红的水溶液和品红的乙醇溶液
品红的水溶液褪色,醇溶液不褪色
SO2与水反应的产物具有漂白作用
A、A B、B C、C D、D -
3、羟甲香豆素(丙)是一种治疗胆结石的药物,合成路线如下图。下列说法错误的是
 A、甲分子式为C12H16O5 B、乙生成丙的反应类型是消去反应,反应条件是浓硫酸、加热 C、常温下1mol乙最多与2molNaOH的水溶液完全反应 D、甲和乙分子中均存在手性碳原子,丙分子不存在手性碳原子
A、甲分子式为C12H16O5 B、乙生成丙的反应类型是消去反应,反应条件是浓硫酸、加热 C、常温下1mol乙最多与2molNaOH的水溶液完全反应 D、甲和乙分子中均存在手性碳原子,丙分子不存在手性碳原子 -
4、中国科学家在淀粉人工合成方面取得了重大突破性进展,该研究在国际上首次实现了二氧化碳到淀粉的合成(图示为局部合成路线),下列有关说法正确的是
 A、1mol甲醛分子含有3mol σ键 B、反应(1)既是氧化还原反应,又是化合反应 C、过氧化氢是含有非极性键的非极性分子 D、DHA易溶于有机溶剂,难溶于水
A、1mol甲醛分子含有3mol σ键 B、反应(1)既是氧化还原反应,又是化合反应 C、过氧化氢是含有非极性键的非极性分子 D、DHA易溶于有机溶剂,难溶于水 -
5、下列过程对应的化学方程式或离子方程式书写正确的是A、苯乙烯合成聚苯乙烯:nC6H5CH=CH2
 B、三氯化铁溶液刻制覆铜电路板:
C、乙醇用铜作催化剂进行催化氧化:CH3CH2OH + 3O22CO2 + 3H2O
D、海水提溴将溴吹入吸收塔:
B、三氯化铁溶液刻制覆铜电路板:
C、乙醇用铜作催化剂进行催化氧化:CH3CH2OH + 3O22CO2 + 3H2O
D、海水提溴将溴吹入吸收塔:
-
6、在给定条件下,下列选项所示的物质间转化不能实现的是A、CH3CH2BrCH2=CH2CH3CH2OH B、MgCl2(aq)Mg(OH)2(s)MgO (s) C、S(s)SO3(g)H2SO4(aq) D、N2(g)NH3(g)NaHCO3(s)
-
7、只用括号内指定试剂不能鉴别的一组试剂是A、乙酸、乙醛、甲酸 (新制Cu(OH)2悬浊液) B、甲苯、1-己烯、乙酸 (溴水) C、苯酚钠溶液、NaHCO3溶液、乙醇钠 (盐酸) D、甲苯、乙醇、苯酚溶液 (酸性溶液)
-
8、温室气体在催化剂作用下可分解为和 , 也可作为氧化剂氧化苯制苯酚。下列说法不正确的是A、原子半径: B、第一电离能: C、在水中的溶解度:苯<苯酚 D、与的空间构型相同
-
9、物质的性质决定用途,下列两者关系对应不正确的是A、Na2CO3溶液呈碱性,可用作治疗胃酸过多的抗酸药物 B、铝合金质量轻、强度大,可用作制造飞机和宇宙飞船的材料 C、CuS、HgS极难溶,可用Na2S作沉淀剂除去废水中的Cu2+和Hg2+ D、碳化硅硬度大,可用作砂纸、砂轮的磨料
-
10、下列仪器可用于熔融NaCl晶体的是A、
 B、
B、 C、
C、 D、
D、
-
11、下列化学用语表示不正确的是A、的电子式:
 B、SO2的价层电子对互斥模型:
B、SO2的价层电子对互斥模型: C、的空间填充模型:
C、的空间填充模型: D、3,3-二甲基戊烷的键线式:
D、3,3-二甲基戊烷的键线式:
-
12、以下为一种以含铅废料(、、、、及炭黑)制备纳米PbO和的工艺流程。
已知:①炭黑是一种碳单质,化学性质比较稳定。
②、均为难溶于水的固体。
③易溶于水,电离方程式为。
 (1)、PbO具有碱性氧化物的性质,请写出过程I中PbO与稀硫酸反应的离子方程式。(2)、①过程I中,在催化下,Pb和反应生成的化学方程式是:。
(1)、PbO具有碱性氧化物的性质,请写出过程I中PbO与稀硫酸反应的离子方程式。(2)、①过程I中,在催化下,Pb和反应生成的化学方程式是:。②过程I中,催化过程可表示为:
i:
ii:…
写出ii的离子方程式:。
(3)、过程I过滤除去的物质是。(4)、①写出过程II主要反应的离子方程式。②结合复分解型离子反应的反应规律,说明可能具有怎样的性质。
(5)、过程II过滤除去的物质是。(6)、过程III所得滤液中检出 , 请简述过程III通入的作用。(7)、①生成纳米的离子方程式是。②生成纳米PbO的化学方程式是。
-
13、某同学设计了如图所示装置(夹持装置已省略)进行乙醇的催化氧化实验。先按图示安装好实验装置,关闭活塞a、b,在铜丝的中间部分加热片刻,然后通过控制活塞a和b,有节奏(间歇性)地通入气体。已知:乙醛可被氧化为乙酸,乙醛的沸点为乙酸的沸点为
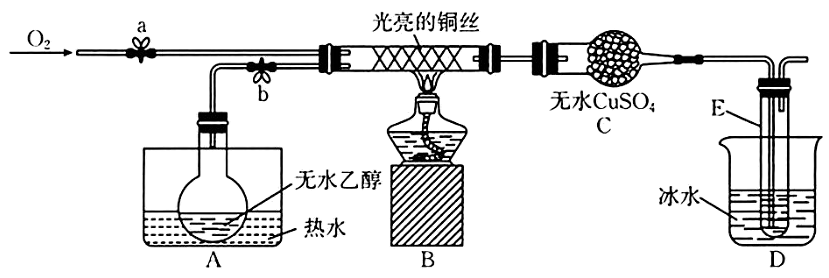
回答下列问题:
(1)、实验室常用快速制备氧气,写出的结构式:。(2)、从硬质玻璃管中可观察到受热的铜丝交替出现变黑、变红的现象,请写出实验过程中乙醇催化氧化的化学方程式:。实验开始后,实验小组将酒精灯去掉之后,依然能观察到铜丝交替出现变黑、变红的现象,试解释其原因:。(3)、实验中A和D均用到了水浴作用。A的作用是 , D的作用是。(4)、C中的实验现象是。(5)、经检测,实验小组发现E中收集到的液体除含有乙醛(易溶于水)外还含有杂质。要除去乙醛中的 , 可采取的方法为。(6)、该小组通过以上实验探究做出了如下猜想,你认为正确的是(填标号)。a.表面被氧化为黑色的铜丝在酒精灯焰心处灼烧,可闻到刺激性气味
b.乙醇催化氧化生成乙醛时,乙醇分子中只有O—H键发生断裂
c.利用金属钠能检验试管E中有没有未反应的乙醇
-
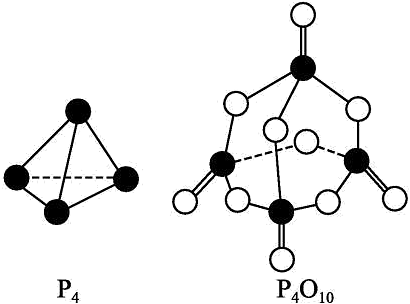
14、回答下列问题(1)、在25℃、101kPa下,1g甲醇()燃烧生成和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)、 ; , (填“>”、“<”或“=”),原因是(3)、已知拆开1molH-H键、1molN-H键、键分别需要的能量是436kJ、391kJ、946kJ,则与反应生成的热化学方程式为(4)、白磷与氧可发生如下反应:已知断裂下列化学键需要吸收的能量分别为如下:
化学键
P-P
P-O
P=O
O-O
O=O
键能(kJ/mol)
a
b
c
d
e
根据图示的分子结构和有关数据估算该反应的(用代数式表示)
 (5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。
(5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。已知:①
②
写出肼和反应的热化学方程式
(6)、将0.3mol的气态高能燃料乙硼烷()在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 -
15、银锌纽扣电池是一种常见的化学电源,以Zn和Ag2O为电极,氢氧化钾溶液为电解质溶液,其电池反应为: , 装置示意图如下。
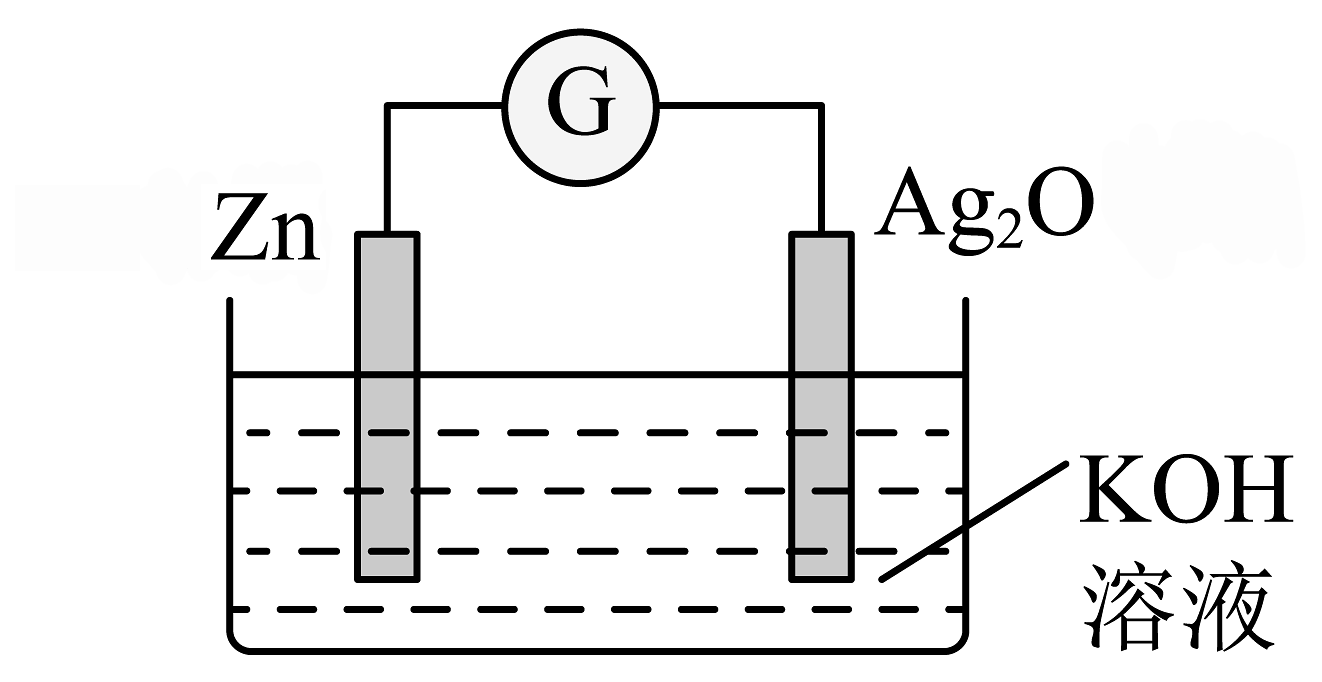
下列说法不正确的是
A、电池工作时化学能主要转化为电能 B、Zn电极是该电池的负极 C、Ag2O电极发生还原反应 D、电池工作时,电子从Zn经氢氧化钾溶液流向Ag2O -
16、与一定量浓硝酸反应,全部被消耗后,收集到标准状况下和的混合气体 , 则和的物质的量之比为A、 B、 C、 D、
-
17、短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的核内质子数为8,Y原子最外层只有1个电子,Z原子最外层电子数是其电子层数的2倍。下列叙述错误的是A、Z的非金属性比X的弱 B、X、Y可形成含有共价键的离子化合物 C、W的简单气态氢化物的热稳定性比Z的弱 D、原子半径的大小顺序:
-
18、在实验室中测定稀盐酸与氢氧化钠溶液反应的焓变,下列有关说法错误的是A、测定时使用温度计的次数为3次 B、测量终止温度时,应当记录混合溶液的最高温度 C、为了使酸碱充分反应,应当缓慢分次倒入溶液并搅拌 D、若用同浓度同体积的醋酸代替盐酸,测得的变大
-
19、下列说法正确的是A、和互为同素异形体 B、和互为同系物 C、H、D、T互为同位素 D、
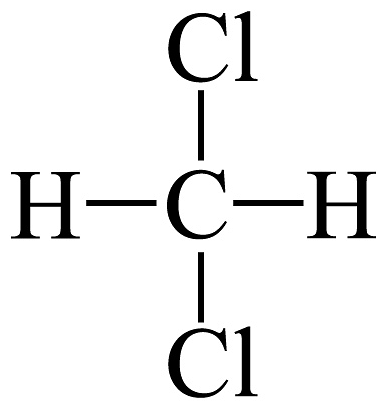 和
和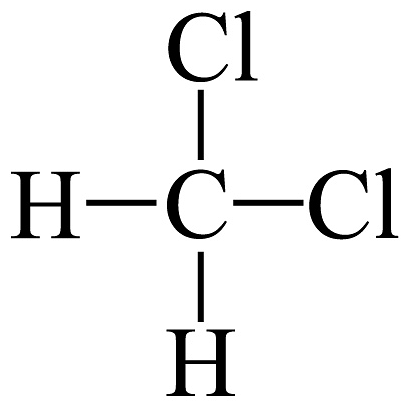 互为同分异构体
互为同分异构体
-
20、已知碳、一氧化碳、晶体硅的燃烧热分别是、、 , 则工业冶炼晶体硅的反应为 。则下列判断错误的是A、 B、 C、 D、