相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、2025年巴黎AI峰会上,DeepSeek创始人梁文峰通过量子全息投影技术远程参会。全息投影的实现依赖于材料科学与光学技术的结合。下列相关说法错误的是A、全息投影膜是一种薄而柔的聚酯膜(),该聚酯膜是通过缩聚反应形成的 B、全息投影技术常用卤化银作光敏材料,利用了光照时卤化银可分解产生Ag原子的特点 C、空气显示影像时通过电激发氧气发光,该过程属于化学变化 D、全息投影技术的光电器件所用材料氮化镓为新型无机非金属材料
-
2、某学习小组研究含氮化合物时做了如下探究。由于性质很不活泼,直到1909年德国化学家Habar经过反复实验研究后发现在 , 和锇为催化剂的条件下,合成氨具有了工业化生产的可能。(1)、已知的燃烧热分别为 , 写出合成氨的热化学反应方程式。(2)、锇催化的过程为:先吸附到锇表面,吸附后的分子才能发生反应生成 , 然后脱附得到产物,该过程符合Langmuir吸附等温式。定义为催化剂的表面覆盖率。随压强的变化如图所示。值越大,催化效果越好。
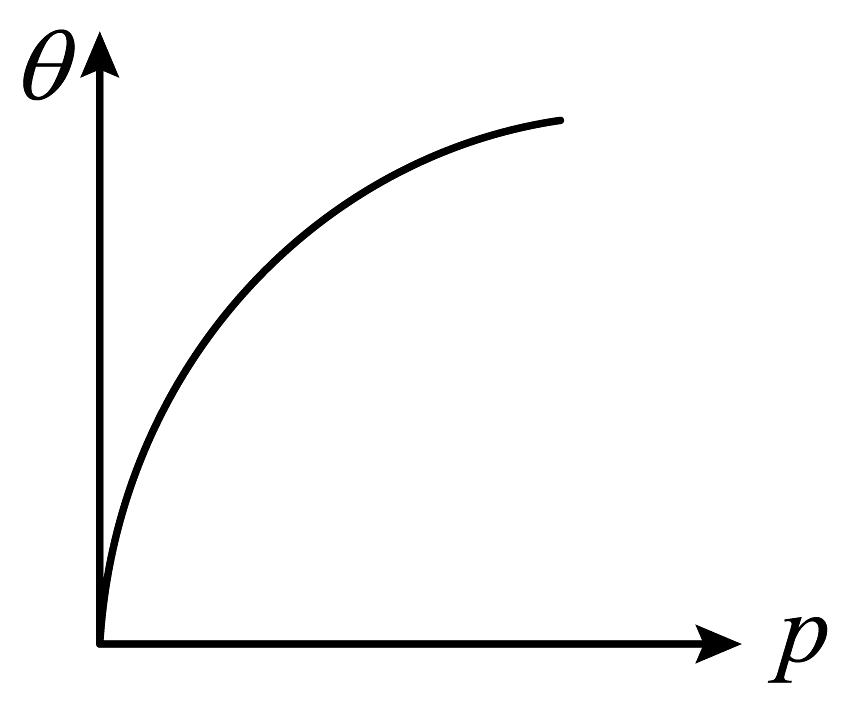
合成氨条件需要控制在的原因是。
(3)、在 , 体积为的恒容容器中,对于合成氨反应,初始投料为为为 , 则以下哪些条件可以判断反应达到平衡(填序号)。①的体积分数不变 ②的物质的量分数不变
③气体总压不变 ④的分压不变 ⑤体系密度不变
(4)、可以发生二聚 , 此反应可自发进行。动力学实验证明,上述混合气温度由升至 , 此过程几微秒即可达成化学平衡。则升温后的混合气体在室温下放置,气体颜色变化为。(5)、对于可逆反应:。现有总压下和的混合气体,其密度为同状态下密度的34.5倍,求反应的平衡常数。(6)、可以与许多金属发生氧化还原反应。在 , 体积为的恒容容器中加入一定量的和 , 发生如下三个反应:①
②
③
当体系各物质的物质的量不再改变时,此时已被消耗完,均有生成。现缩小容器体积,几种气体的摩尔分数x也将变化。则的摩尔分数随压强p的变化趋势为。(填“①”“②”或“③”)。
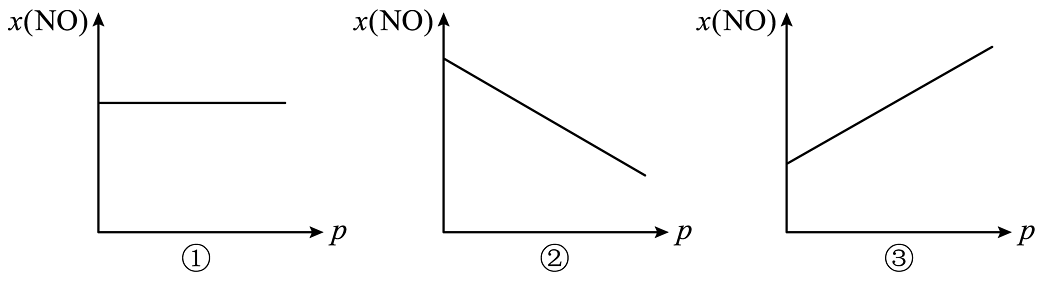 (7)、已知理想气体状态方程: , 当体积单位为L时,压强单位为。的可逆分解:。
(7)、已知理想气体状态方程: , 当体积单位为L时,压强单位为。的可逆分解:。在 , 体积为的恒容容器中,对于的可逆分解,。若上述体系初始分压 , 。则平衡时的压强为。(不考虑)
-
3、联苯双酯是治疗病毒性肝炎和药物性肝损伤引起转氨酶升高的常用药物。其一种合成路线如图所示。
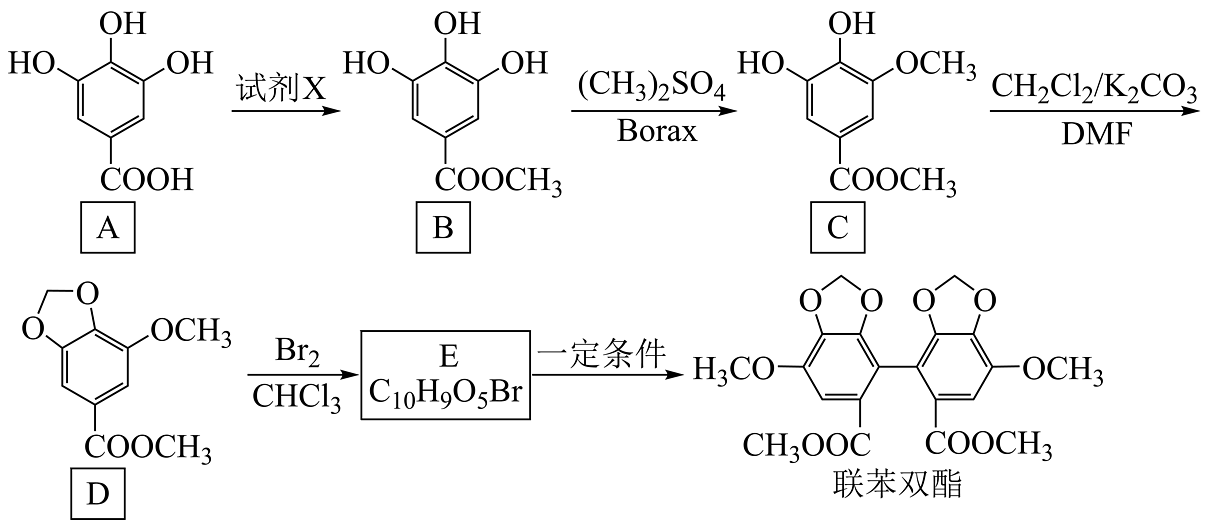
回答下列问题:
(1)、A的系统命名为;D的官能团名称为。(2)、试剂X为。(3)、写出B→C的化学方程式:。(4)、C→D的反应类型为;E的结构简式为。(5)、有机物F为D的同分异构体,符合下列条件的F的结构有种(不考虑立体异构)。ⅰ.遇氯化铁能发生显色反应,且除苯环外无其他环状结构
ⅱ.1molF最多与5molNaOH反应
ⅲ.结构中只有两种官能团且苯环上有三个取代基
(6)、设计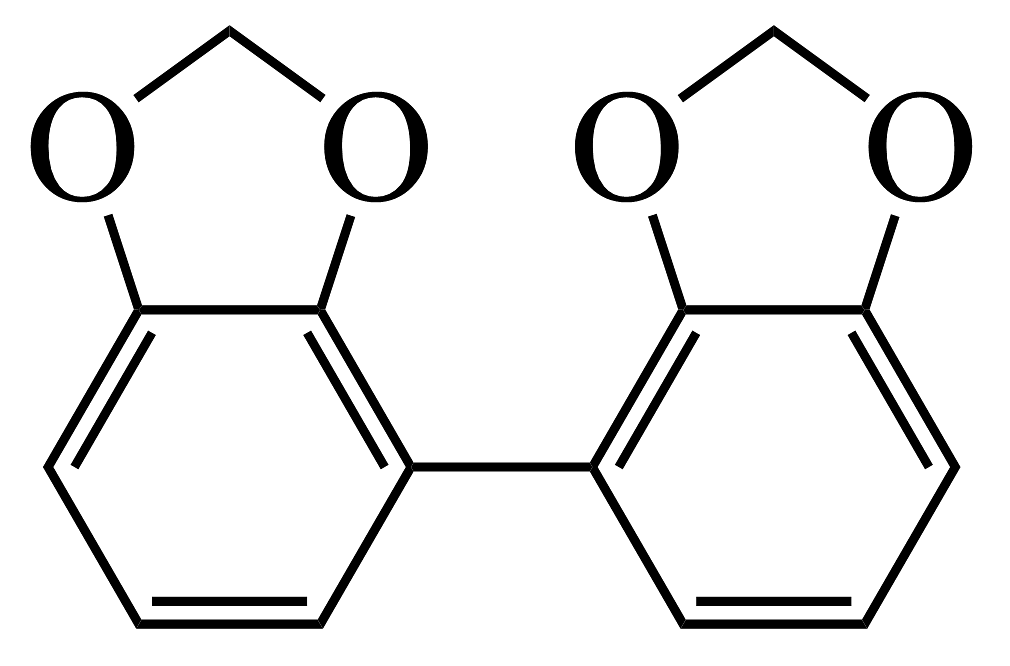 的合成路线如下。其中M和N的结构简式为和。
的合成路线如下。其中M和N的结构简式为和。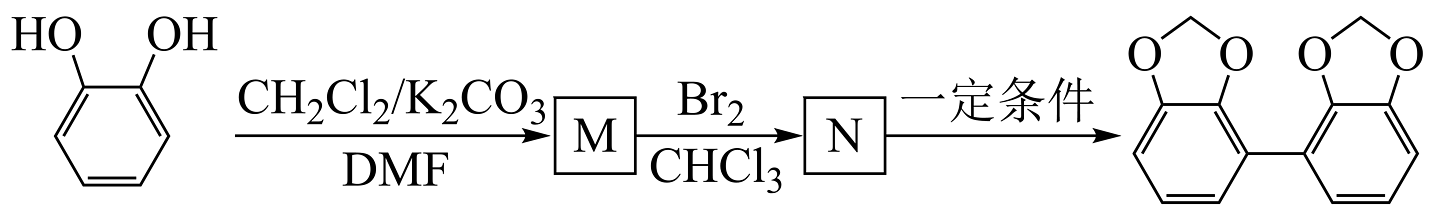
-
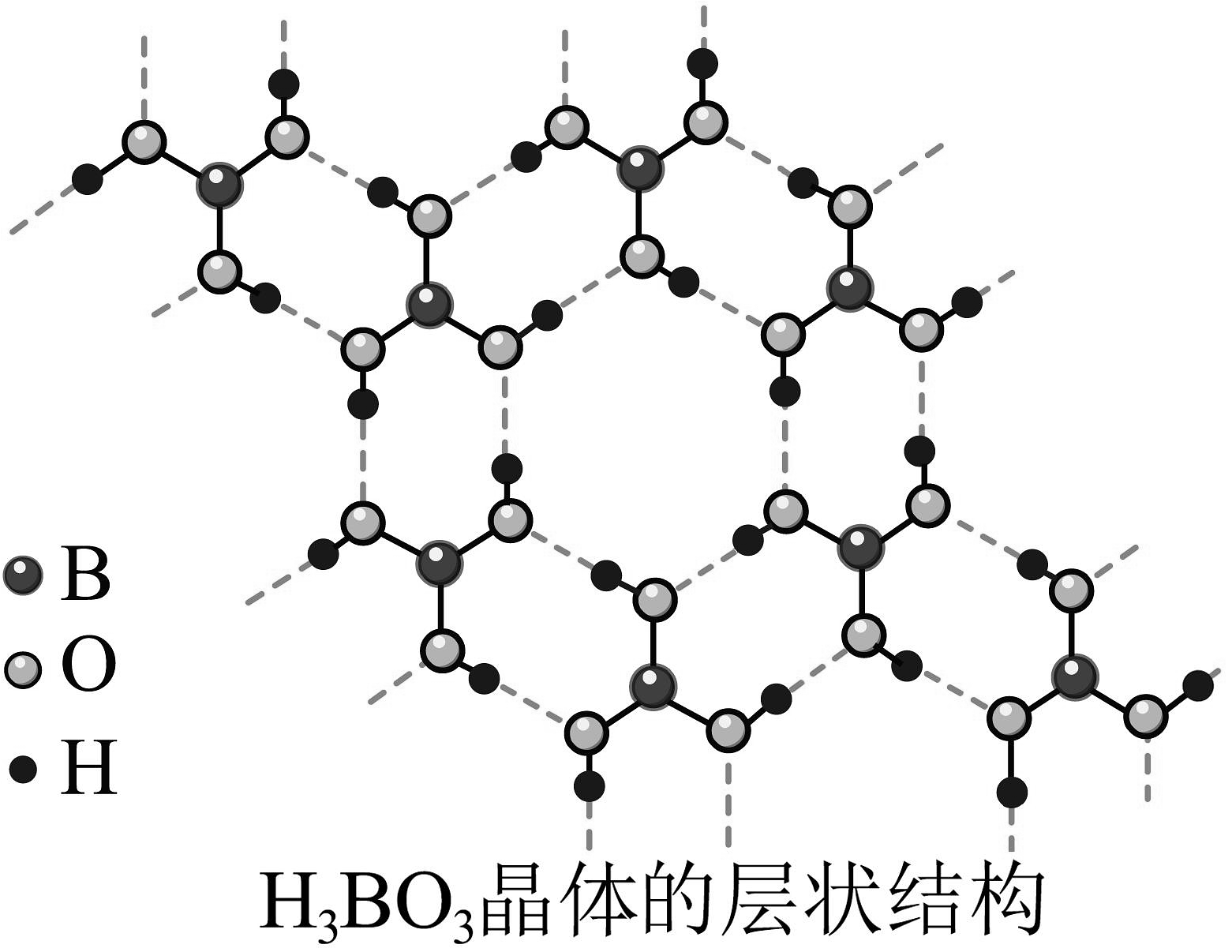
4、硼、氮及其化合物是用途广泛的化工原料。回答下列问题:(1)、硼氢化钠()是制造乙硼烷和其他高能燃料的原料,中阴离子的空间构型为;在元素周期表中,B位于区。(2)、硼酸()晶体的层状结构如图所示,晶体中含有氢键。
 (3)、某二价锰的配离子的结构如图所示:
(3)、某二价锰的配离子的结构如图所示: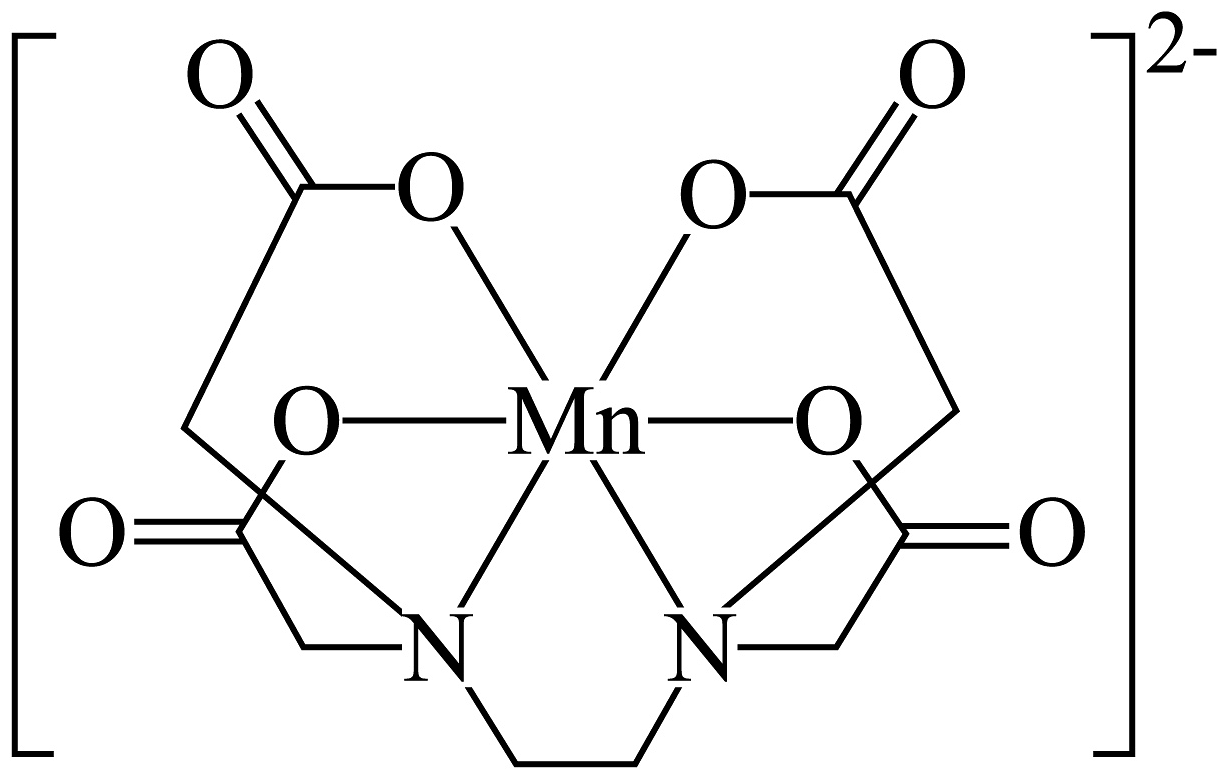
①该配离子酯基上C原子的一个杂化轨道与羰基O原子的2p轨道形成(填“”或“”)键。
②该配离子中的配位数是。
(4)、三甲胺(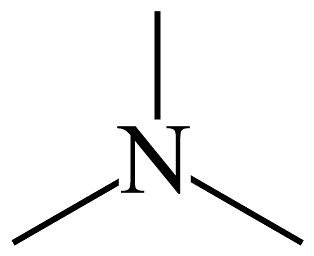 )的沸点异丙胺的沸点(填“大于”或“小于”),判断理由是。 (5)、一种铁氮化物在半导体电子器件中存在重要的应用价值,其晶胞结构如图1所示,晶胞参数为 , 可取代晶胞中的 , 取代不同位置的转化过程中能量变化不同(如图2)。
)的沸点异丙胺的沸点(填“大于”或“小于”),判断理由是。 (5)、一种铁氮化物在半导体电子器件中存在重要的应用价值,其晶胞结构如图1所示,晶胞参数为 , 可取代晶胞中的 , 取代不同位置的转化过程中能量变化不同(如图2)。
①基态的价层电子轨道表示式为。
②形成更稳定的替代型产物时,取代的是位置(填“I”或“Ⅱ”)的 , 取代该位置的后,得到新晶体的密度为(用含a、的代数式表示;为阿伏加德罗常数的值)。
-
5、乙炔是重要的化工基础原料,常用于合成有机工业产品M。合成路线如下:
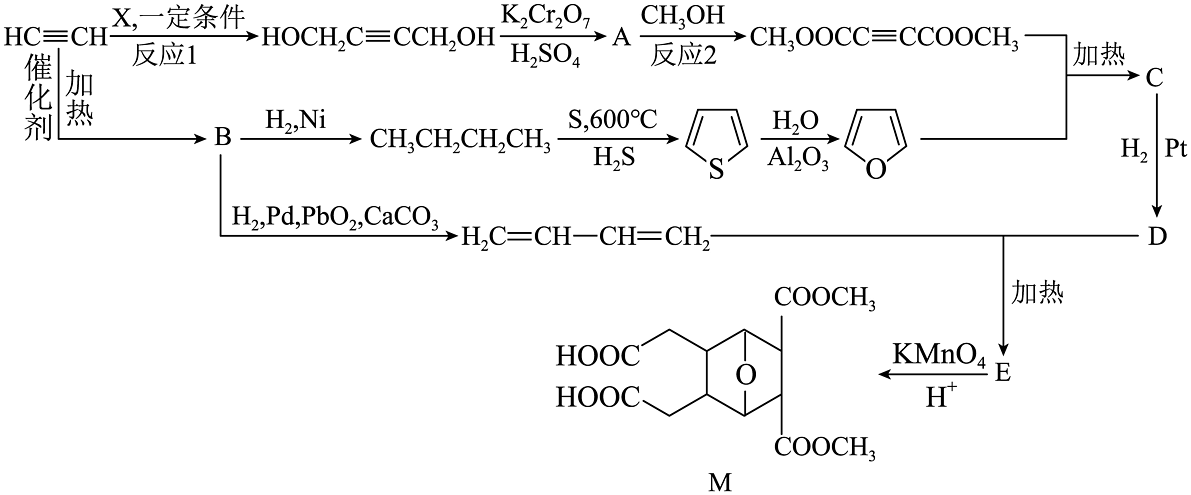 (1)、X的化学名称是:;反应1的反应类型是。(2)、反应2的化学方程式为。(3)、链烃B分子式为 , 分子中有3种化学环境的氢,其结构简式为。(4)、下列有关C、D、E的说法正确的是_________(填字母)。A、D中官能团为酯基、醚键、碳碳双键 B、、D都能与反应 C、E中有3个手性碳原子 D、E能发生加聚反应(5)、D的结构简式:;选择催化氢化时还有副产物F,F与D互为同分异构体,若F按合成路线继续反应,最终将得到M的同分异构体N。则N的结构简式是。(6)、为了提高酸性高锰酸钾的氧化效率,通常在的反应体系中加入冠醚,试写出加入冠醚的作用是。
(1)、X的化学名称是:;反应1的反应类型是。(2)、反应2的化学方程式为。(3)、链烃B分子式为 , 分子中有3种化学环境的氢,其结构简式为。(4)、下列有关C、D、E的说法正确的是_________(填字母)。A、D中官能团为酯基、醚键、碳碳双键 B、、D都能与反应 C、E中有3个手性碳原子 D、E能发生加聚反应(5)、D的结构简式:;选择催化氢化时还有副产物F,F与D互为同分异构体,若F按合成路线继续反应,最终将得到M的同分异构体N。则N的结构简式是。(6)、为了提高酸性高锰酸钾的氧化效率,通常在的反应体系中加入冠醚,试写出加入冠醚的作用是。 -
6、工业上以铬铁矿(含有少量和等杂质)为主要原料制备的工艺流程如下图。
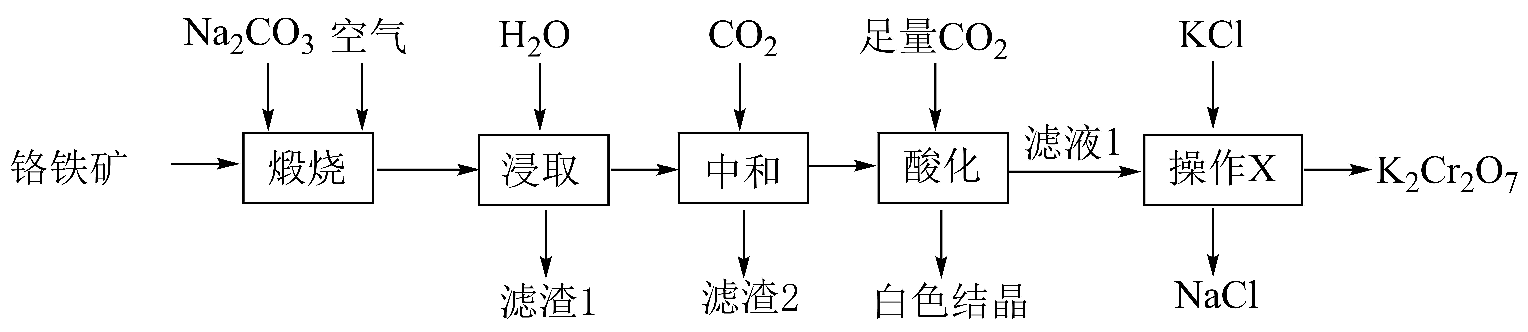
已知:①最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
②煅烧的目的是将转化为。
③室温下,
(1)、元素位于元素周期表第周期,第族。(2)、“煅烧”时参与反应的化学方程式为。(3)、“滤渣1”的主要成分为。(4)、“酸化”过程中发生反应的离子方程式为 , 加入硫酸也能达到“酸化”目的,选择的优点是。(5)、室温下“中和”:。控制 , 可保证恰好沉淀完全(溶液中浓度为)。(6)、分光光度法是一种基于物质对光的选择性吸收而建立的常见定性定量分析方法。用分光光度法测产品的纯度时(溶液的吸光度与其浓度成正比),测得的质量分数明显偏低,分析原因,发现配制待测液时少加了一种试剂,该试剂可以是__________(填字母)。A、硫酸 B、氢碘酸 C、硝酸钾 D、氢氧化钾 -
7、2021年BenjaminList和DaveMaCMillan因不对称有机催化获得诺贝尔化学奖。他们利用有机小分子代替传统的金属催化剂进行不对称合成,脯氨酸是最常见的有机小分子催化剂,下图利用脯氨酸催化Aldol反应的机理如下图所示:
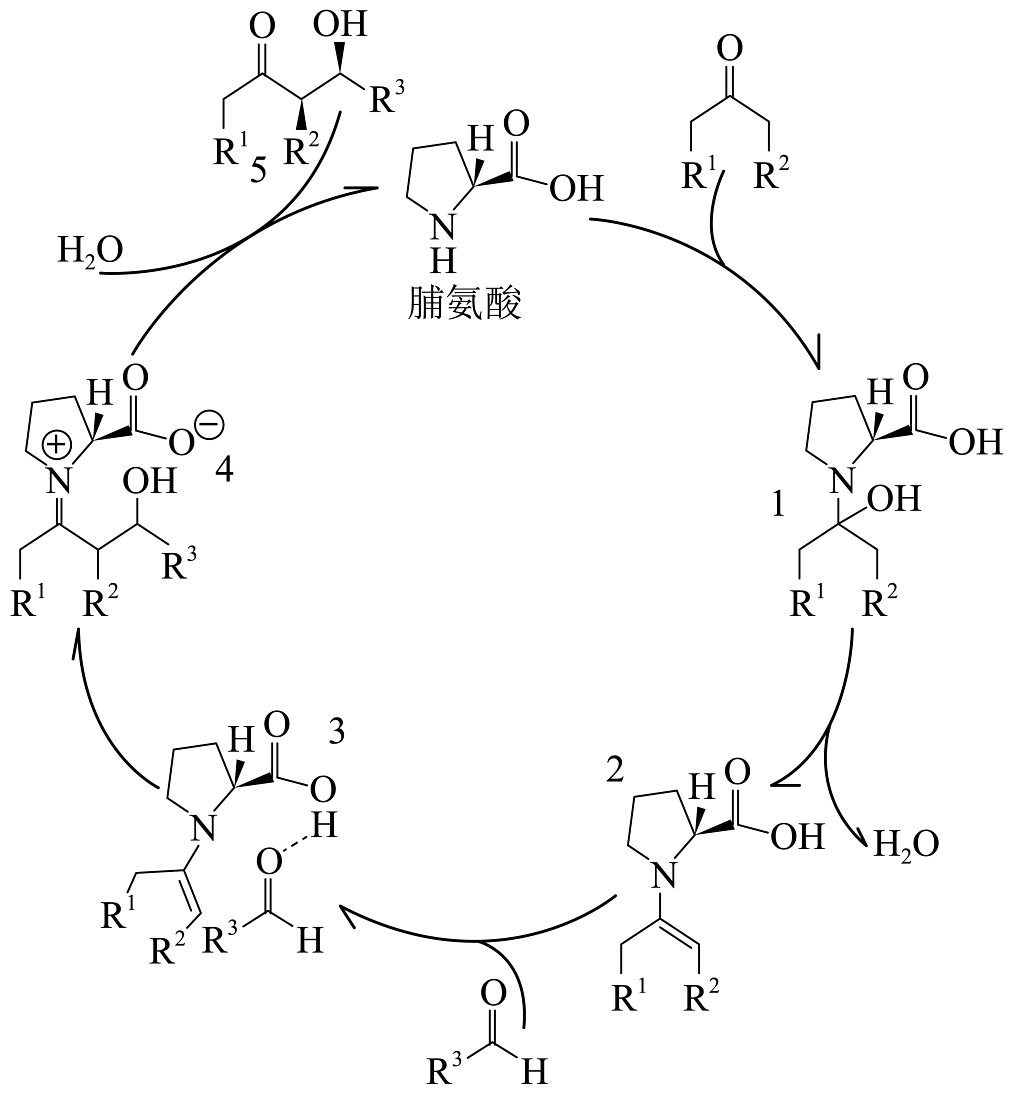
下列说法正确的是
A、Aldol反应方程式: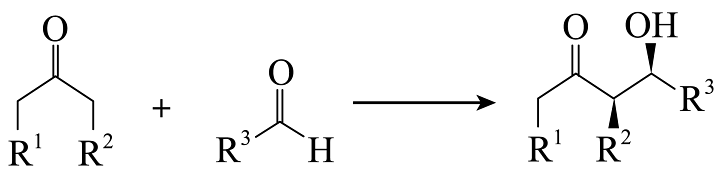 B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
-
8、多卤离子在水溶液中的分解反应及平衡常数值如下:
离子
分解反应
平衡常数值
K
下列说法错误的是
A、 B、上述分解反应均为氧化还原反应 C、共价键极性: D、可分解为和 -
9、我国科学家成功利用和人工合成了淀粉,使淀粉的生产方式从农业种植转为工业制造成为可能,其原理如下图所示。下列说法不正确的是
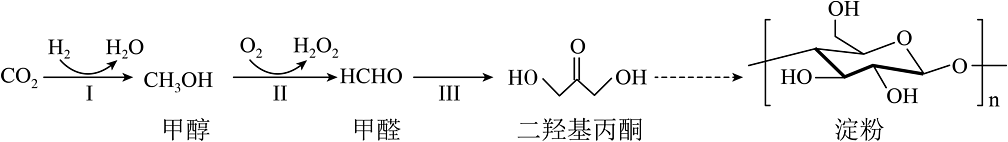 A、的电子式为
A、的电子式为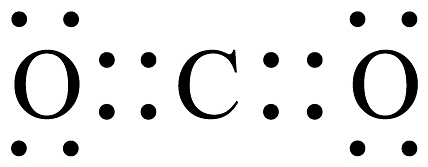 B、甲醇沸点高于甲醛,是因为甲醇分子间能形成氢键
C、甲醇分子和二羟基丙酮分子中碳原子的杂化类型均为
D、二羟基丙酮与乳酸(
B、甲醇沸点高于甲醛,是因为甲醇分子间能形成氢键
C、甲醇分子和二羟基丙酮分子中碳原子的杂化类型均为
D、二羟基丙酮与乳酸(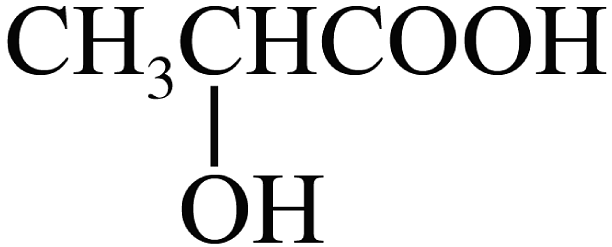 )互为同分异构体
)互为同分异构体
-
10、下列物质中,属于强酸的是A、HCl B、 C、 D、
-
11、某温度下,用标准溶液滴定溶液,测得溶液的相对电导率及随滴入标准溶液的体积的变化关系如图所示。已知。下列说法正确的是
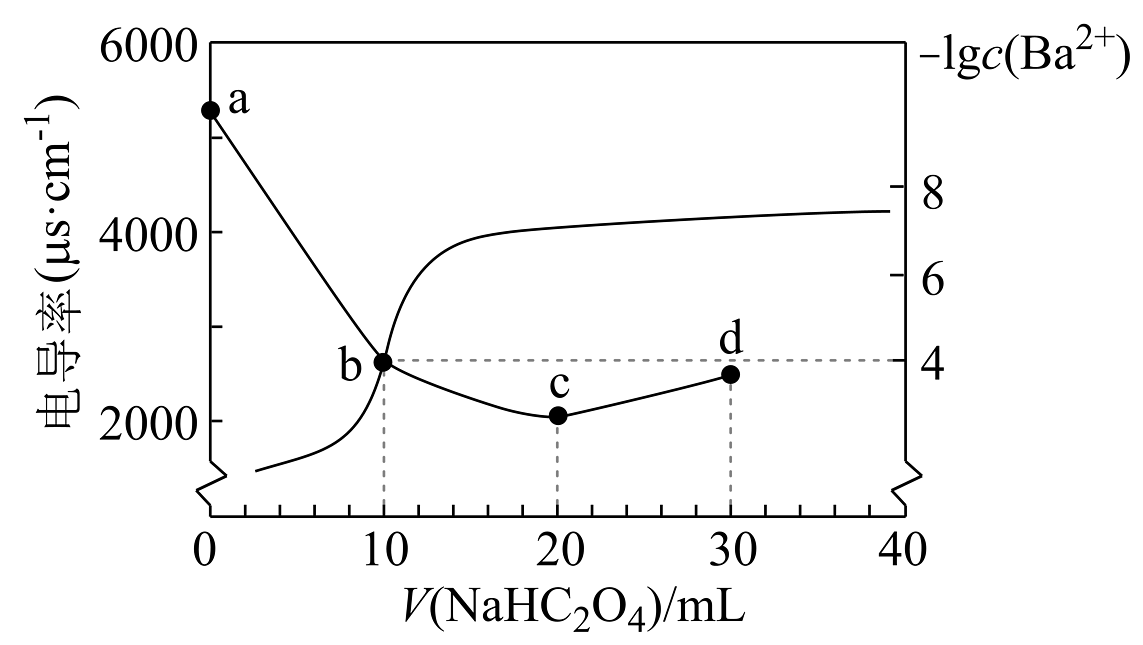 A、c点之后电导率持续上升说明,的导电能力强于 B、的过程中,溶液中逐渐增大 C、c点溶液中约为 D、d点溶液中:
A、c点之后电导率持续上升说明,的导电能力强于 B、的过程中,溶液中逐渐增大 C、c点溶液中约为 D、d点溶液中: -
12、某种含钒超导材料的晶胞结构及晶体结构俯视图如图,晶胞参数为。下列叙述错误的是
 A、基态V原子核外电子的空间运动状态有13种 B、晶体中与原子距离最近的原子有6个 C、该晶体的化学式为 D、若该含钒超导材料的摩尔质量为 , 则该晶体密度为
A、基态V原子核外电子的空间运动状态有13种 B、晶体中与原子距离最近的原子有6个 C、该晶体的化学式为 D、若该含钒超导材料的摩尔质量为 , 则该晶体密度为 -
13、科学家利用二芳基硅二醇
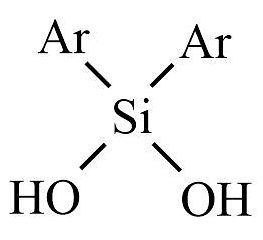 (表示芳基)实现了温和条件下的“碳中和”过程,用环氧丙烷(
(表示芳基)实现了温和条件下的“碳中和”过程,用环氧丙烷( )与催化环加成反应生成碳酸丙烯酯的反应机理如图。
)与催化环加成反应生成碳酸丙烯酯的反应机理如图。
下列说法不正确的是
A、该过程中涉及碳原子的杂化方式的改变 B、若用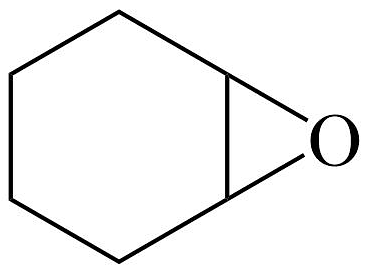 代替环氧丙烷,则过程中有
代替环氧丙烷,则过程中有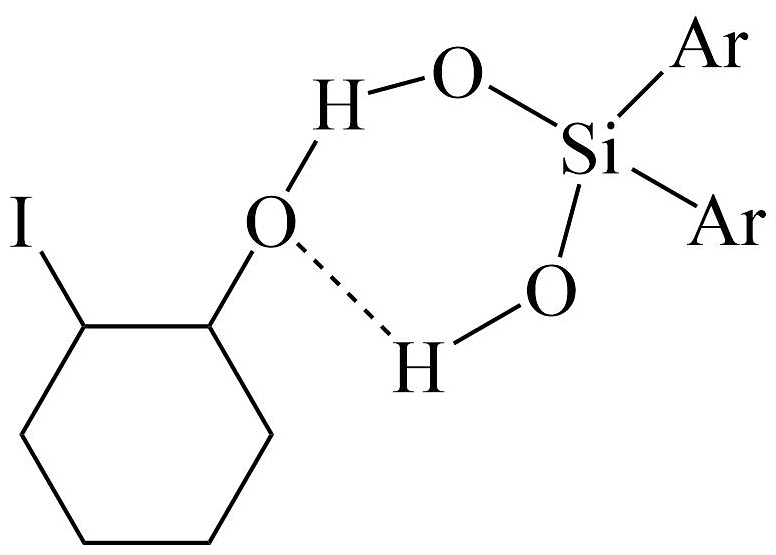 生成
C、考虑手性异构现象,环氧丙烷的一氯代物有6种
D、该过程的最终产物可与反应
生成
C、考虑手性异构现象,环氧丙烷的一氯代物有6种
D、该过程的最终产物可与反应
-
14、X、Y、Z、W为原子序数依次增大的短周期主族元素,其中Y、Z、W在第二周期且相邻:M的基态原子3d轨道上有2个未成对电子,且价层电子的空间运动状态有6种。由该五种元素形成的一种配合物的结构如图所示,其中Y、Z、W原子的最外层均达到8电子稳定结构。下列说法正确的是
 A、该配合物中存在的化学键有共价键、配位键、氢键 B、1mol该配合物中含有4mol配体,且M的化合价为+2 C、X、Y、Z三种元素可以形成盐 D、ZX3形成的晶体中配位数为12
A、该配合物中存在的化学键有共价键、配位键、氢键 B、1mol该配合物中含有4mol配体,且M的化合价为+2 C、X、Y、Z三种元素可以形成盐 D、ZX3形成的晶体中配位数为12 -
15、一种点击反应的原理为
 , 我国科学家利用点击反应原理研制出具有较高玻璃化转变温度的聚合物C.下列说法不正确的是
, 我国科学家利用点击反应原理研制出具有较高玻璃化转变温度的聚合物C.下列说法不正确的是 A、聚合物C是一种热塑性材料 B、单体B的结构简式为 C、由A与B合成C的反应属于加聚反应 D、C可发生水解反应得到A和B
A、聚合物C是一种热塑性材料 B、单体B的结构简式为 C、由A与B合成C的反应属于加聚反应 D、C可发生水解反应得到A和B -
16、下列实验装置或操作不能达到实验目的的是
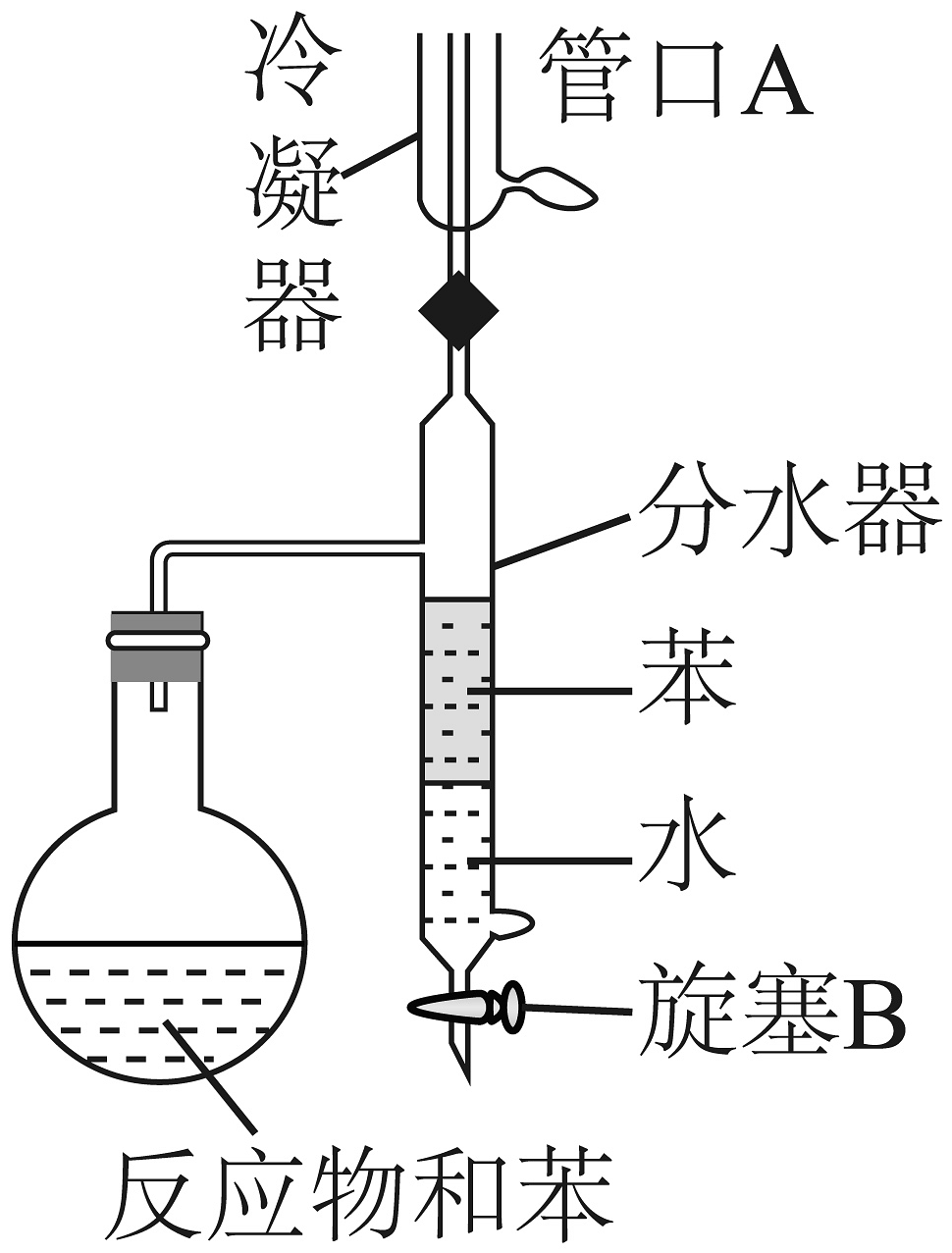
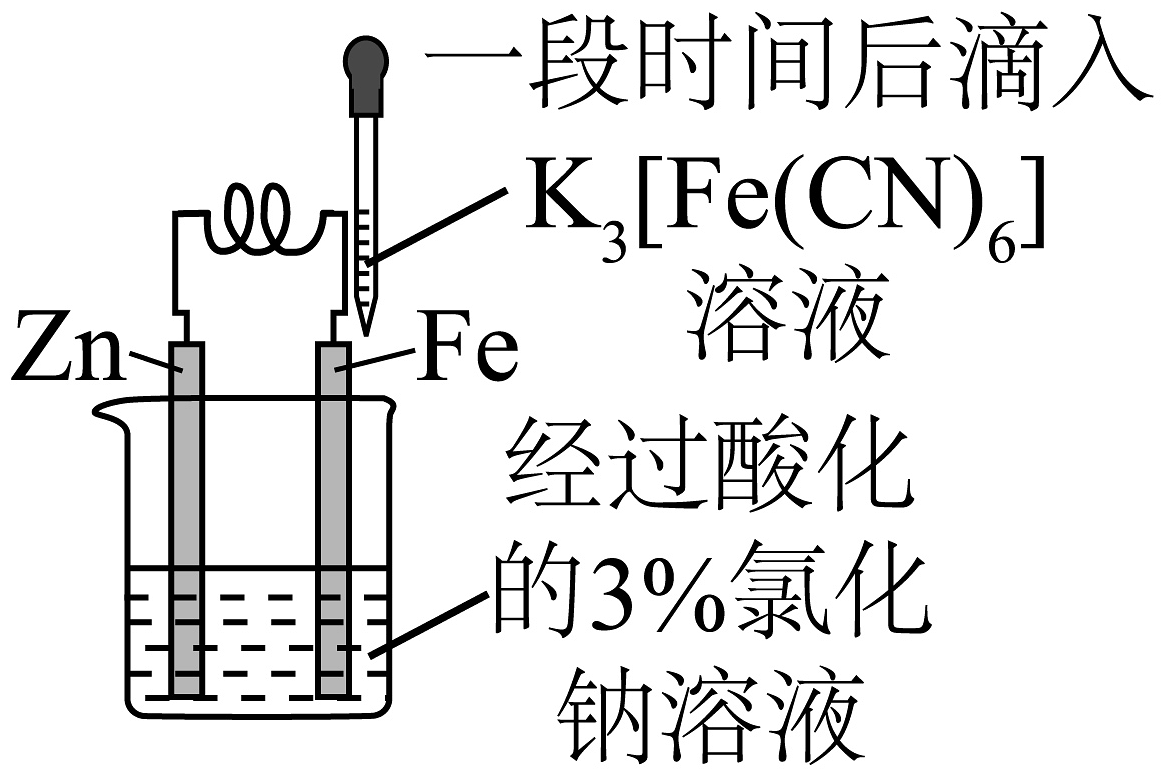
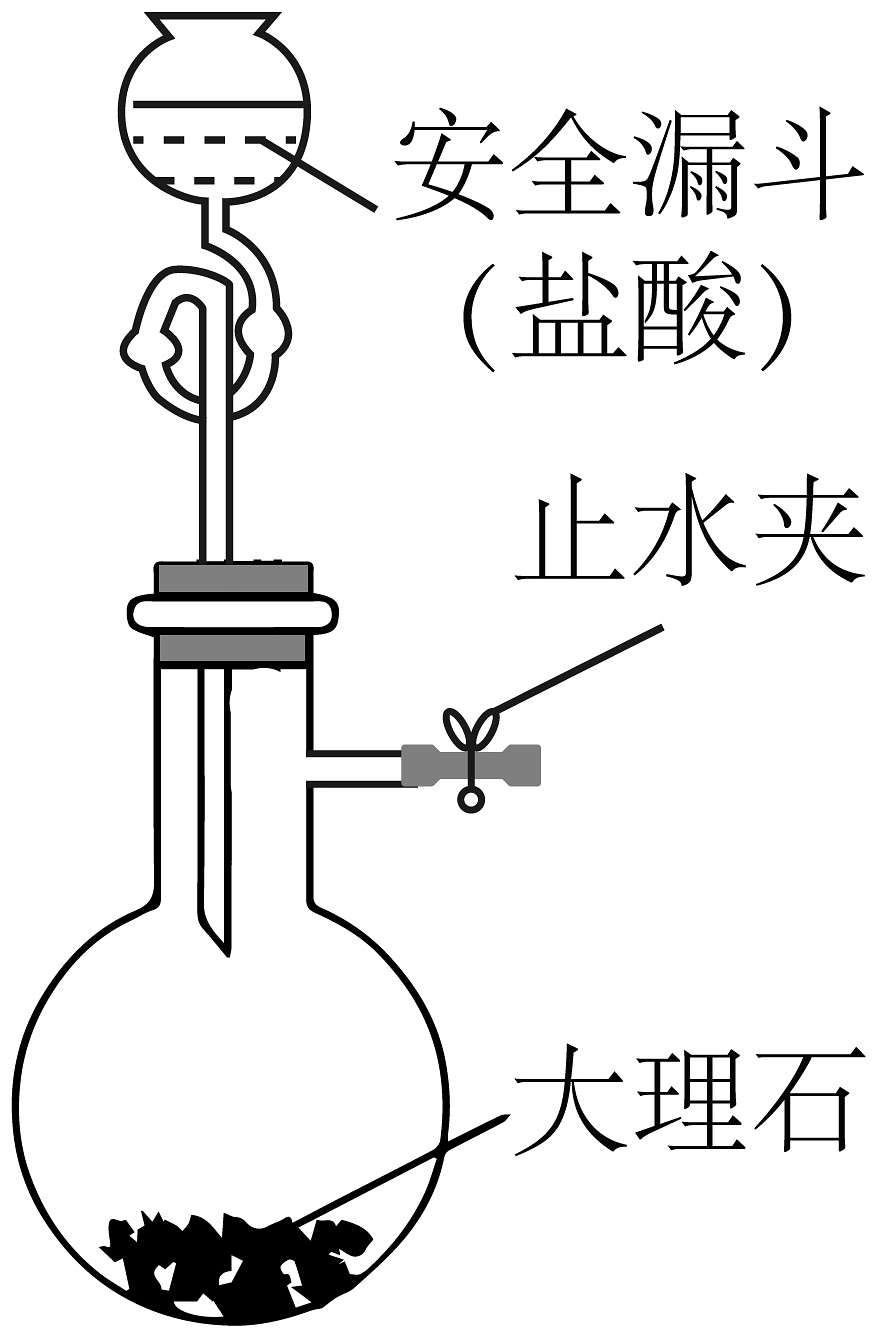
A.制备苯甲酸苯甲酯
B.验证金属锌保护铁
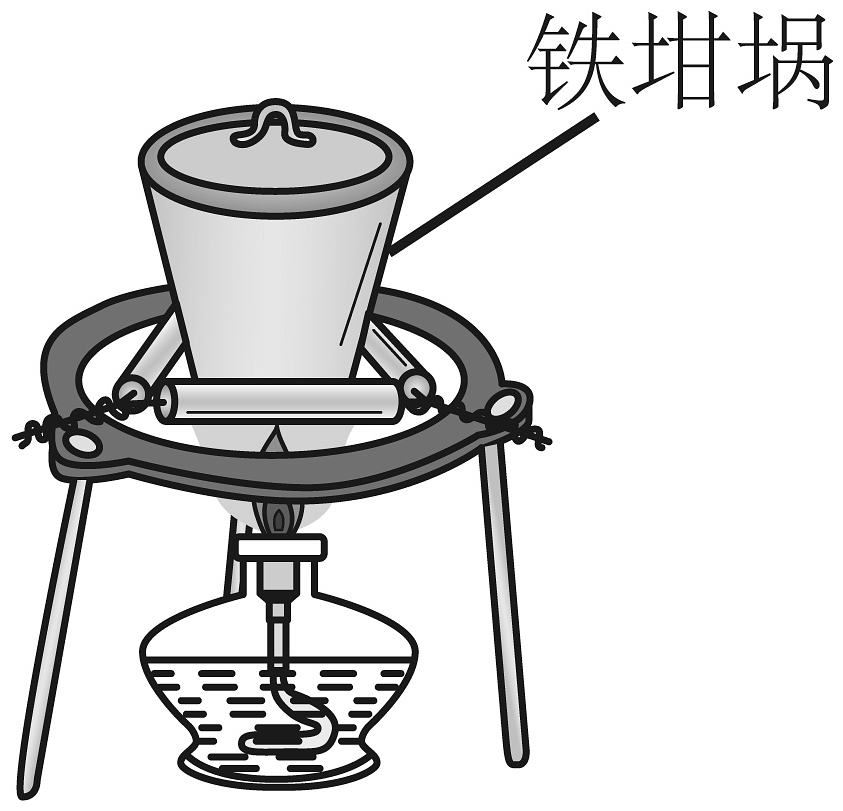
C.熔融纯碱
D.制取少量
A、A B、B C、C D、D -
17、为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,与均含有个质子 B、常温下,的溶液中,水电离出的数目为 C、丁烷充分裂解,生成物中乙烷的分子数为 D、中含有键数目最多为
-
18、下列化学用语正确的是A、的VSEPR模型:
 B、NaCl溶液的中水合钠离子:
B、NaCl溶液的中水合钠离子: C、中共价键的电子云图:
C、中共价键的电子云图: D、基态硒的简化电子排布式:
D、基态硒的简化电子排布式:
-
19、化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是A、做豆腐时用石膏作凝固剂:是因为电解质能使胶体聚沉 B、燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 C、新榨苹果汁提取液可使溶液变为浅绿色:苹果汁中含有还原性物质,将Fe3+还原为Fe2+ D、果汁中添加维生素C:维生素C作抗氧剂
-
20、化学与生产、生活和科技密切相关,下列说法错误的是A、碳纤维和玻璃纤维均属于有机高分子材料 B、味精是一种增味剂,主要以淀粉为原料通过发酵法生产 C、超高分子量聚乙烯可用于制作防弹服,属于通用高分子材料 D、烫发药水能使头发中的二硫键()发生断裂和重组,该过程涉及氧化还原反应