相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、锗是一种战略性金属,广泛应用于光学及电子工业领域。某锌浸渣中含有、、、、等,利用锌浸渣提取的实验流程如下图所示:
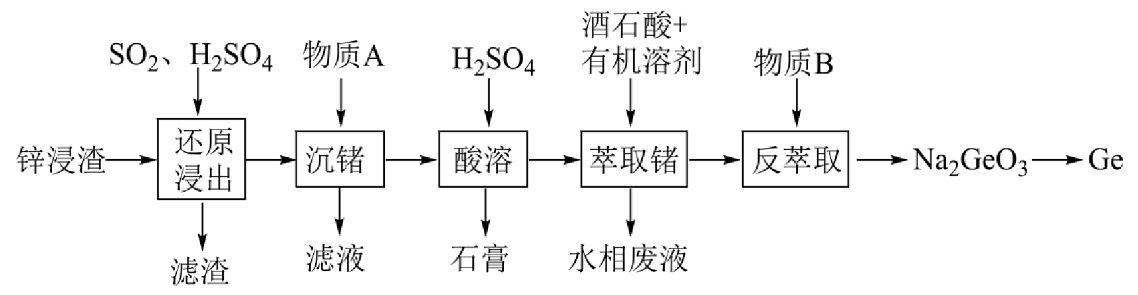
已知:①部分含锗微粒的存在形式与的关系为:
pH
pH<2
pH>12
Ge存在形式
②部分金属离子的沉淀:
开始沉淀
7.5
2.3
6.2
沉淀完全
9.0
3.2
8.0
回答下列问题:
(1)、“滤渣”的主要成分的化学式是。(2)、在“还原浸出”步骤中发生反应的离子方程式为。(3)、“沉锗”步骤中加入的物质A属于碱性氧化物,其化学式是。“沉锗”操作后,Ge以的形式存在,随着的升高,的沉淀率升高,“沉锗”操作理论上需控制范围为。(4)、“酸溶”后,溶液的为1.8,向溶液中加入酒石酸萃取剂,其原理为酒石酸与含锗微粒形成酒石酸络阴离子①若升高,锗的萃取率下降,原因是。
②“反萃取”中加入的物质B是(填标号)。
a.溶液 b.溶液 c.溶液
(5)、一种锗晶胞结构如下左图,与锗原子距离最近且相等的锗原子有个,锗原子A的原子坐标为 , 锗原子的原子坐标为;将该晶胞沿图中体对角线投影,下左图中锗原子B投影的位置是下右图的号位(填数字)。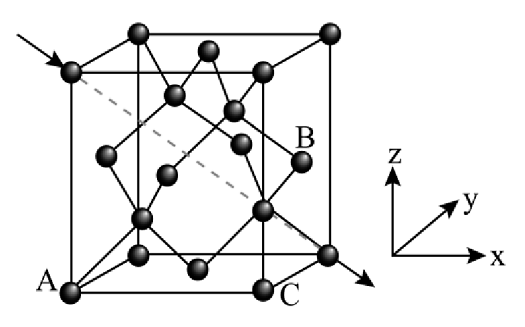

-
2、
性质活泼,可以和许多物质发生反应。
Ⅰ.实验室用和反应制备(黄绿色粉末,易与水反应产生)。
已知:(反应剧烈,温度高时会产生副产物)
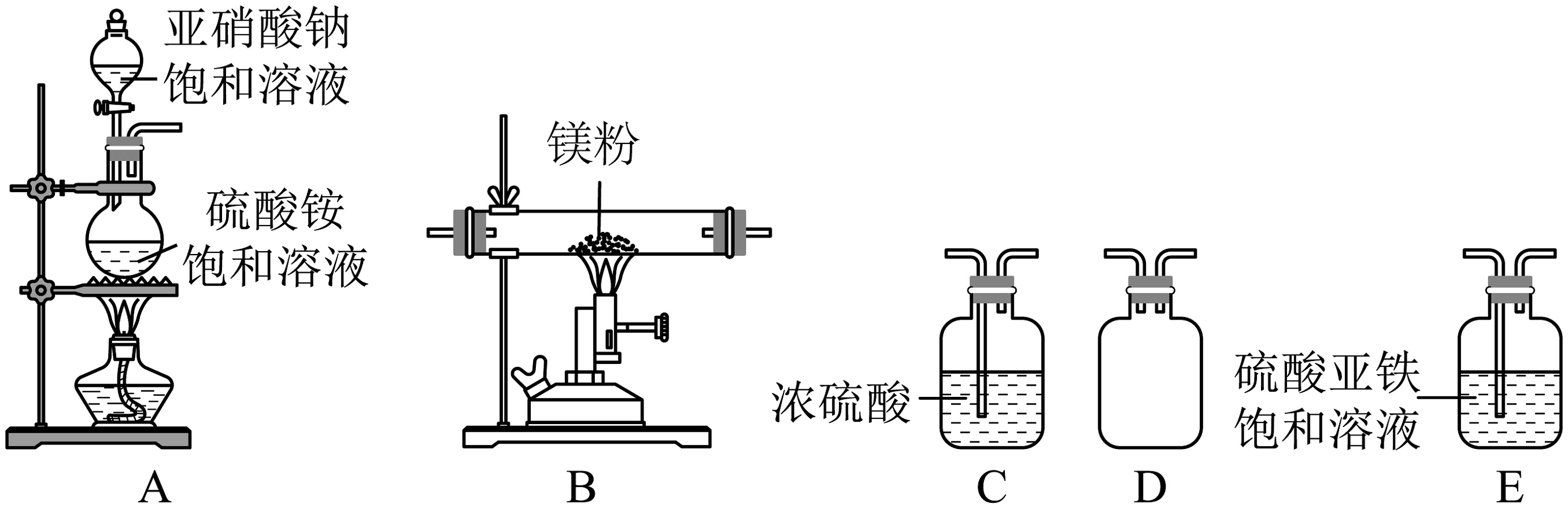
(1)上述装置正确的连接顺序是:。
A→___________→___________→___________→B→C(必要时可重复使用)
(2)装置A中装溶液的仪器名称为。饱和溶液的作用。
Ⅱ.常温下和水反应缓慢,反应时,条表面缓慢产生少量气泡,数分钟后反应停止,未收集到气体,镁条表面失去光泽。
查阅资料:与水反应时,表面覆盖了致密的导致反应缓慢;和可以加快Mg与水反应。
同学们为了验证和对与水反应的促进作用,用与水反应后的条与4种盐溶液进行对比实验,结果如下。
实验序号
a
b
c
d
盐溶液(均为)
NaCl
溶液起始
5.1
8.3
7.0
7.8
30min时产生气体体积/mL
1.5
0.7
<0.1
1.4
气体的主要成分
30min时镁条表面情况
大量固体附着(固体可溶于盐酸)
(3)根据的沉淀溶解平衡可解释和的作用。在水中存在的沉淀溶解平衡可用离子方程式表示为。
(4)经检验,a中还生成少量其他气体,可进一步证明促进与水反应,检验该气体的方法是。
(5)上表中能够说明对与水反应起促进作用的证据是。
(6)b、d所得固体中还检验出碱式碳酸镁[用表示],写出生成该固体的离子方程式。
(7)综合实验a-d可以得到的结论是:和都能与作用加快与水反应,;(补充两点)。
-
3、第二代钠离子电池是以嵌钠硬碳()和锰基高锰普鲁士白为电极的新型二次电池,充电时嵌入硬碳,放电时发生脱嵌,其工作原理如图所示。下列说法正确的是
 A、充电时,a接电源的负极 B、充电时,B极反应为 C、放电时,穿过离子交换膜向B极移动 D、放电时,每转移1mol电子,A极质量减少23g
A、充电时,a接电源的负极 B、充电时,B极反应为 C、放电时,穿过离子交换膜向B极移动 D、放电时,每转移1mol电子,A极质量减少23g -
4、丙烯与HBr发生加成反应,存在以下两种途径:

已知:1-溴丙烷的能量大于2-溴丙烷的能量。两个途径的反应过程,其图像如下:
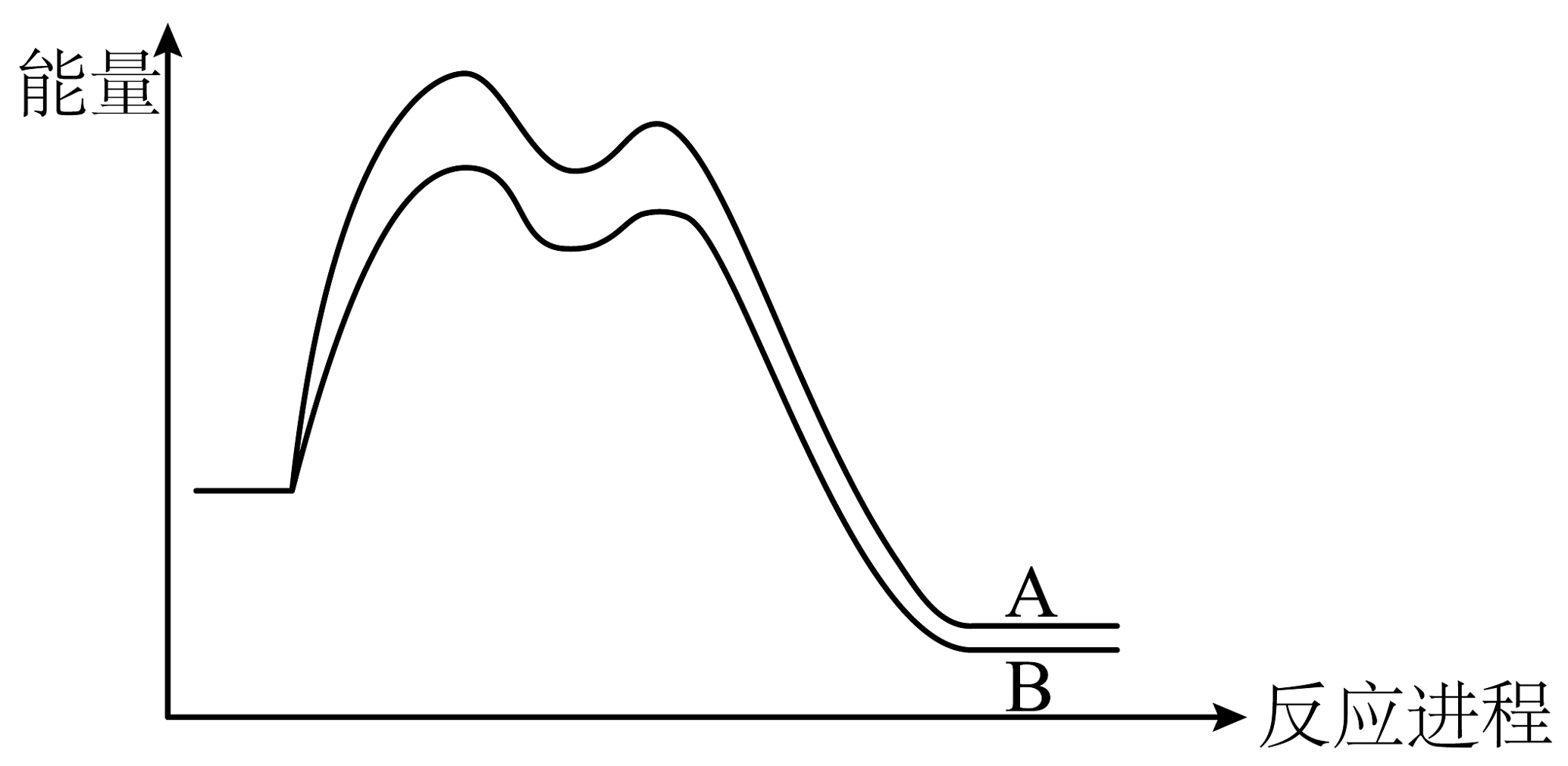
下列说法正确的是
A、相同条件下,生成2-溴丙烷的速率快 B、相同条件下,生成1-溴丙烷的产率高 C、生成两种溴代产物时,决速步均由第二步反应决定 D、
-
5、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
向蛋白质溶液中加入饱和溶液,有白色沉淀
蛋白质遇到盐溶液会发生变性
B
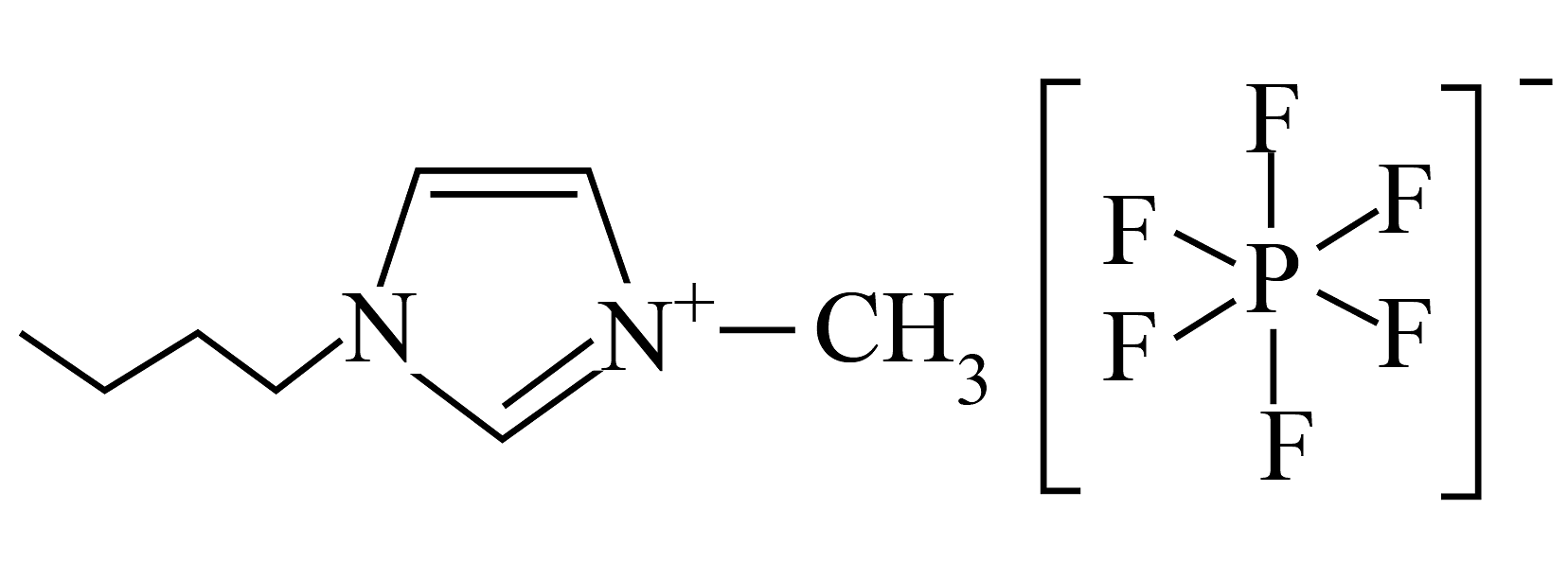 为离子化合物,常温下呈液态
为离子化合物,常温下呈液态阴、阳离子的体积大,离子键弱,熔点低
C
的沸点比的高
中的键能大于中的键能
D
工业上电解熔融冶炼铝
的熔点比低
A、A B、B C、C D、D -
6、原子序数依次增大的短周期主族元素、、、、组成的一种化合物结构如图所示,其中Z、E同族,基态Y原子的核外有3个未成对电子。下列说法正确的是
 A、第一电离能: B、含有离子键和非极性键 C、简单离子半径: D、的空间结构为平面三角形
A、第一电离能: B、含有离子键和非极性键 C、简单离子半径: D、的空间结构为平面三角形 -
7、按下图装置进行实验(夹持装置省略),下列判断正确的是
 A、甲装置试管中的固体是 B、乙中a处比b处先变蓝 C、由于与酸产生铵盐,丙中有白烟 D、因为极易溶于水,所以丁中会产生倒吸
A、甲装置试管中的固体是 B、乙中a处比b处先变蓝 C、由于与酸产生铵盐,丙中有白烟 D、因为极易溶于水,所以丁中会产生倒吸 -
8、已知:反应常用来判断输送的管道是否漏气。设为阿伏加德罗常数的值。下列说法正确的是A、通入水中充分反应,溶液中分子数为 B、溶液中,含离子数为 C、中含极性键的个数为 D、含有键数为
-
9、实验室制取并验证其性质,下列装置及操作能达到相应实验目的的是
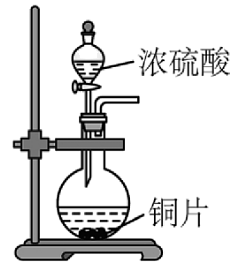

A.生成
B.验证的漂白性


C.干燥
D.吸收
A、A B、B C、C D、D -
10、化学之美无处不在。下列说法正确的是A、水可形成晶莹剔透的晶体冰,冰中存在氢键 B、绚丽的焰火与电子跃迁时产生的吸收光谱有关 C、手性分子互为镜像,能在三维空间里叠合 D、呈现规则多面体外形的金刚石为分子晶体
-
11、下列关于配制标准溶液并用其滴定草酸溶液浓度的操作正确的是A、
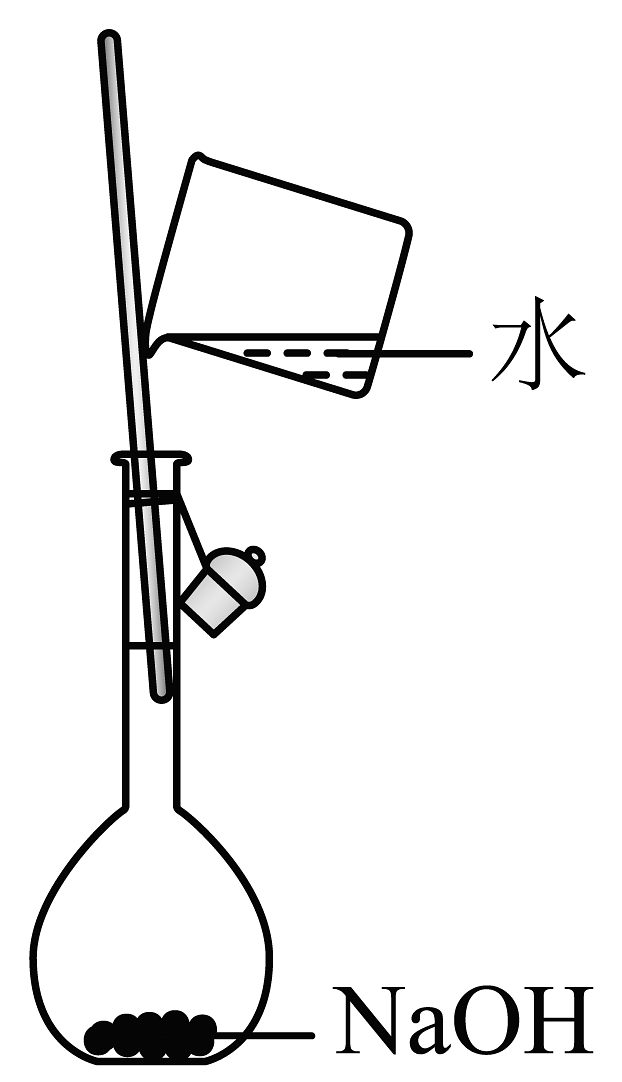 B、
B、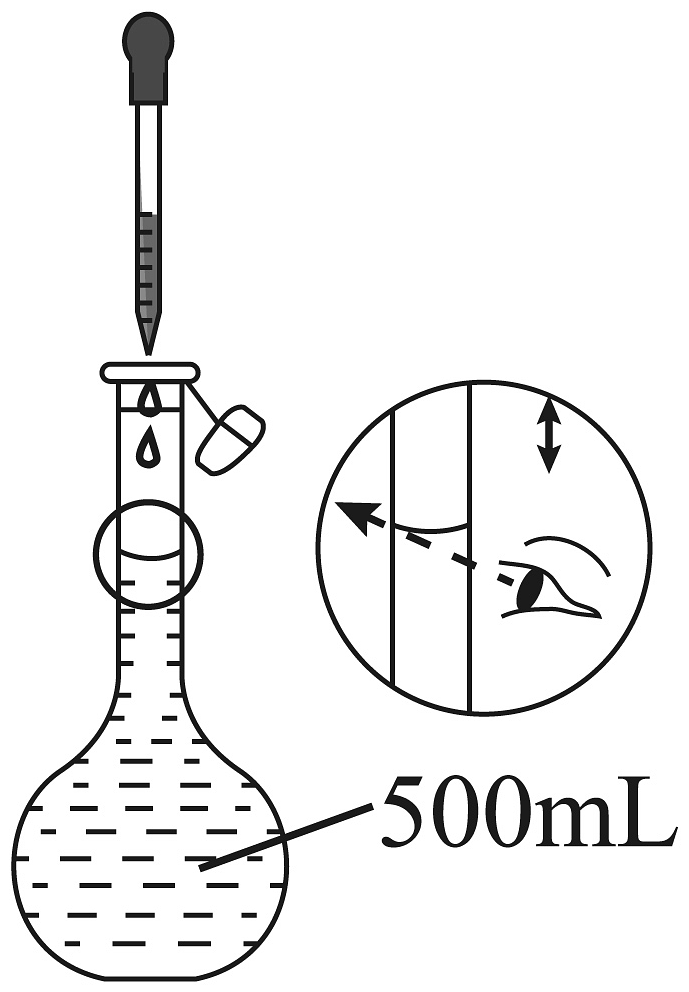 C、
C、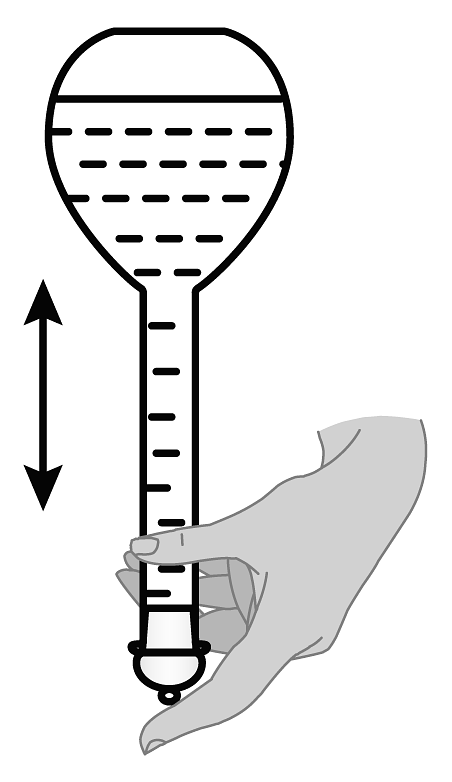 D、
D、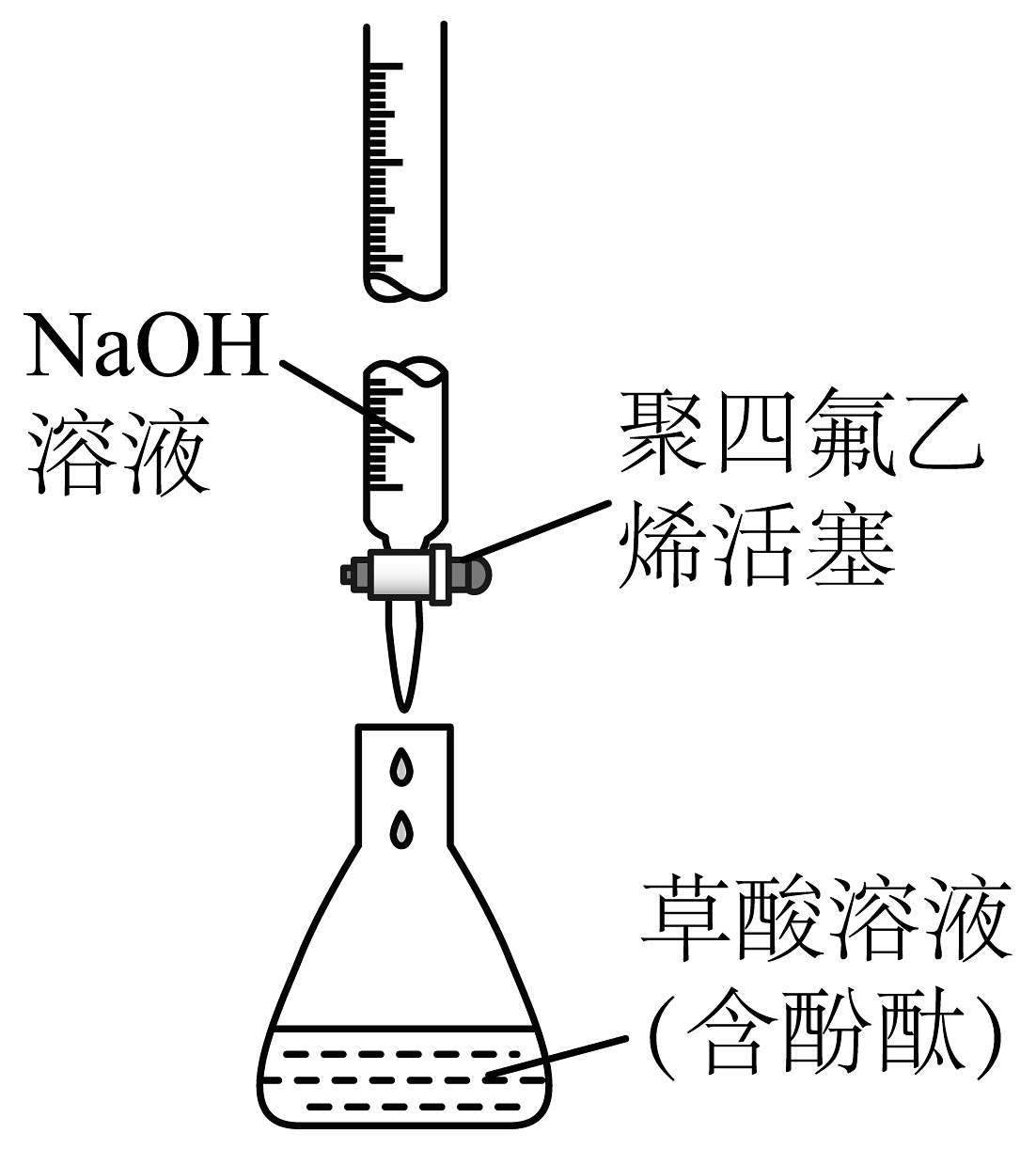
-
12、海水资源综合利用是发展海洋经济的重要部分。以下是模拟海水提镁的部分工艺过程。
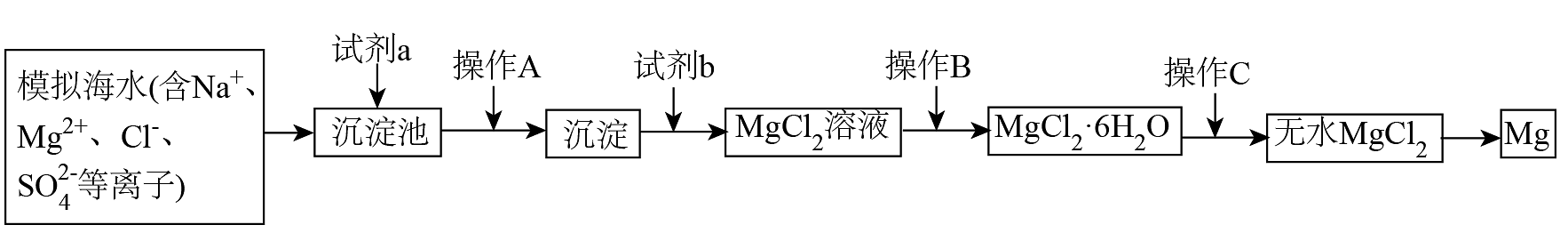
下列说法错误的是
A、试剂a、b可以分别为石灰乳和盐酸 B、操作是过滤 C、操作为在气流中加热,使脱水 D、为减少工艺环节,可直接电解氯化镁溶液获得金属 -
13、生活中许多现象与电化学原理密切相关,下列说法正确的是A、铜板打上铁铆钉后,铜板更易被腐蚀 B、用“保暖贴”取暖,铁做负极发生吸氧腐蚀,放出热量 C、保护水中的钢闸门,应将其与电源正极连接 D、生铁中含有碳,抗腐蚀能力比纯铁强
-
14、化学创造美好的生活。下列化学性质、实际应用和对应关系不正确的是
选项
化学性质
实际应用
A
维生素C具有强还原性
用维生素C可做中毒的急救药
B
聚乳酸可在自然界中生物降解
用聚乳酸制造环保包装材料
C
是酸性氧化物
可用作光导纤维
D
硫酸铝可与小苏打反应
泡沫灭火器灭火
A、A B、B C、C D、D -
15、科技的快速发展彰显国力的强大,下列说法正确的是A、“天舟六号”为中国空间站送去推进剂氙气Xe,Xe是第IA族元素 B、“嫦娥六号”探测器外钻杆是由碳化硅颗粒增强铝基复合材料制造,碳化硅属于合金 C、可控核聚变运行记录的“人造太阳”原料中的和互为同素异形体 D、“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷,其属于新型无机非金属材料
-
16、文物记载着中华文明的灿烂成就,下列文物的主要材质属于天然有机高分子的是




A.铜奔马
B.隋天龙山石佛首三彩
C.宋彩绘木雕观音
C.莲花形玻璃托盏
A、A B、B C、C D、D -
17、利用-丁内酯(M)制备四氢呋喃(X)和3-丁烯-1-醇(Y),涉及如下可逆反应:

已知:反应Ⅰ、Ⅱ均为放热反应。
回答下列问题:
(1)、在温度为时,分别以的和的为原料进行上述反应。当产物X和产物Y的产率均为10%时,体系放热;当产物X产率为15%、产物Y的产率为25%时,体系放热。若 , 则反应Ⅲ的焓变(Ⅲ)(填“>”“=”或“<”)0,反应Ⅱ在该条件下的焓变(用含、的代数式表示)。(2)、温度为时发生上述反应,测得产物X、Y的浓度随时间的变化如图所示,时反应达平衡。 , 。为获得产物Y可采取的措施为。相同条件下,若将催化剂改换成催化剂m,可加快反应Ⅱ,产物Y的浓度峰值点变为A处,说明峰值点变化的原因。 (3)、向容积为的恒容密闭容器中加入、 , 控制温度为 , 测得M的平衡转化率为 , 则平衡体系中X的物质的量为 , 反应①的平衡常数。相同条件下,在容积固定的密闭容器中,若增加的量,平衡时和的比值(填“增大”“减小”或“不变”)。
(3)、向容积为的恒容密闭容器中加入、 , 控制温度为 , 测得M的平衡转化率为 , 则平衡体系中X的物质的量为 , 反应①的平衡常数。相同条件下,在容积固定的密闭容器中,若增加的量,平衡时和的比值(填“增大”“减小”或“不变”)。 -
18、盐酸罗匹尼罗与左旋多巴联用,可治疗原发性帕金森病。两条合成罗匹尼罗的路线如下:
路线一:

已知:
i.路线中—代表
 ,
, 
ii.

iii.RCOOR'R'OH
回答下列问题:
(1)、C的结构简式是;D→E的反应类型为。(2)、B中含氧官能团的名称为。(3)、A→B反应的离子方程式为。(4)、罗匹尼罗分子中除苯环外,还存在一个五元环,罗匹尼罗分子的结构简式为。(5)、B的同分异构体有多种,其中满足下列条件的同分异构体的结构简式为。①能与溶液发生显色反应;能发生银镜反应 ②属于-氨基酸 ③核磁共振氢谱有6组峰
路线二:
 (6)、鉴别R中存在少量Q可选用的试剂为 , R合成罗匹尼罗时,还生成(填结构简式)。
(6)、鉴别R中存在少量Q可选用的试剂为 , R合成罗匹尼罗时,还生成(填结构简式)。 -
19、以硫铁矿(主要成分是FeS2 , 含少量Al2O3、SiO2)为原料制备纳米Fe3O4的流程如下:

已知几种金属离子沉淀的pH如下表所示:
金属氢氧化物
开始沉淀的pH
2.0
7.5
4.0
完全沉淀的pH
3.7
9.7
5.2
(1)、气体X为(填化学式)。(2)、“还原”过程发生反应的离子方程式是;先“还原”再“调pH”的原因为。(3)、“调pH”的范围为;滤渣2的成分是(填化学式)。(4)、工业上也可用电解法制备Fe3O4 , 工作原理如图。
已知:低共熔溶剂由有机物氯化胆碱(
 )与乙二醇混合形成。
)与乙二醇混合形成。①a为直流电源的(填“正”或“负”)极;甲电极的电极反应式为。
②电解过程中乙电极生成Cl2 , 若甲电极转化240gFe2O3 , 则理论上生成Cl2的体积是(标准状况下)。
-
20、亚硝酰氯()和硝酰氯()都是有机合成的常用氯化剂,都易水解。研究小组以和为原料在如图所示装置(加热和夹持装置略去)中制备 , 并测定产品中的质量分数。

已知:
①沸点:为-6℃,为5℃,为-34℃,为-152℃;
②溶液为黄色,为砖红色沉淀;;。
回答下列问题:
(1)、仪器a的名称是 , 实验时,检查装置气密性,加入药品后,通入和前,应进行的操作是。(2)、常温下,装置A中制取的离子方程式为。(3)、实验过程中会产生少量。装置控制的温度约为-15℃,所得中含有的杂质为(填化学式)。(4)、测定产品中的质量分数的实验步骤如下:i.准确称量锥形瓶(带塞子)的质量,取适量产品迅速加入锥形瓶中,盖紧塞子;称量,计算知所取产品为(忽略温度变化带来的称量误差),向锥形瓶中加入适量水,盖紧塞子,置入25℃恒温水浴中,待锥形瓶内温度恒定后,再配制成溶液。ii.取溶液于另一锥形瓶中,用溶液调节溶液在6.5∼10.5之间,再加入溶液作指示剂,用标准液进行滴定,平行滴定三次,达到滴定终点时平均消耗标准液。
①步骤ii中,溶液调节溶液的作用是。
②所得产品中的质量分数为;若铬酸钾指示剂浓度过高时,所测结果(填“偏大”“偏小”或“无影响”)。