相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、实验室将粗盐提纯并配制的溶液。下列仪器中,本实验必须用到的有( )
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A、①②④⑥ B、①④⑤⑥ C、②③⑦⑧ D、①⑤⑥⑧ -
2、下列物质结构与性质或物质性质与用途不具有对应关系的是A、分子间存在氢键,极易溶于水 B、盐酸有强酸性,可用于除去铁锈 C、具有氧化性,可用于腐蚀印刷电路板上的Cu D、聚合硫酸铁能水解并形成胶体,可用于净水
-
3、用NaCl固体与浓混合加热制得HCl,并用于制取无水。下列装置不能达到目的的是
 A、用装置甲制取HCl气体 B、用装置乙干燥HCl气体 C、用装置丙制取无水 D、用装置丁吸收尾气
A、用装置甲制取HCl气体 B、用装置乙干燥HCl气体 C、用装置丙制取无水 D、用装置丁吸收尾气 -
4、过碳酸钠(2Na2CO3·3H2O2)是一种易溶于水,易分解的强氧化剂。它的一种“常温结晶”制备方法的原理为:2Na2CO3(s)+3H2O2(1)=2Na2CO3·3H2O2(s) ΔH<0,实验装置如图所示(夹持装置略去)。

已知:通常以活性氧质量分数[ω(活性氧)=]来衡量过碳酸钠产品的优劣。
实验步骤:
ⅰ. 称取一定量无水碳酸钠,置于烧杯中,加蒸馏水溶解,将溶液转移到三颈烧瓶内,加入稳定剂,搅拌混匀。
ⅱ. 控制温度为25℃,边搅拌边向三颈烧瓶中缓慢滴加30%的H2O2溶液。
ⅲ. 再向三颈烧瓶中加入一定量的无水乙醇,反应一段时间。
ⅳ. 静置、真空抽滤、干燥得粗产品,冷却称重。
回答下列问题:
(1)、仪器a的名称为。(2)、实验过程中产生的气体副产物是 ( 填化学式),装置中玻璃导管的作用是。(3)、步骤ii中,可采取的控温措施是。滴加H2O2溶液速度不能太快,原因是(4)、步骤iii中,加入乙醇的目的是。反应时间与产率、活性氧质量分数(ω)的关系如下图所示,最适宜的反应时间为min左右。 (5)、现将0.50g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4 , 用0.1000 mol/LKMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。则粗产品中活性氧质量分数是。
(5)、现将0.50g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4 , 用0.1000 mol/LKMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。则粗产品中活性氧质量分数是。 -
5、姜酮酚是从生姜中提取得到的天然产物,具有多种重要的生物活性。姜酮酚合成路线如图所示:

已知:I.

II.

回答下列问题:
(1)、A→B反应类型为 , B→C的化学方程式为。(2)、1mol物质G能与mol Na反应,由H制备姜酮酚的反应条件为。(3)、符合下列条件的A的同分异构体有种(不考虑立体异构)。①能发生水解反应 ②能与三氯化铁溶液发生显色反应 ③能发生银镜反应
(4)、在合成化合物F的步骤中,使用代替得到的化合物结构简式为。(5)、结合姜酮酚的合成路线与已知信息,以苯甲醛为反应物,选择不超过4个碳原子的有机物,其他试剂任选,设计化合物 的合成路线。
的合成路线。 -
6、钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:

已知:①还原性:Cl->Co2+;
②Fe3+和结合生成较稳定的[Fe(C2O4)3]3- , 在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是。
(2)从含铝废液得到Al(OH)3的离子方程式为
(3)滤液A中的溶质除HCl、LiCl外还有(填化学式)。写出LiCoO2和盐酸反应的化学方程式
(4)滤渣的主要成分为(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号
温度范围/℃
化学方程式
固体失重率
Ⅰ
120~220
CoC2O4·2H2O CoC2O4+2H2O
19.67%
Ⅱ
300~350
59.02%
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4 , 将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为 mol·L-1。
-
7、某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示,下列说法错误的是
 A、铁在元素周期表中位于第4周期第Ⅷ族 B、普鲁士蓝的导电能力小于普鲁士白 C、普鲁士蓝中Fe2+与Fe3+个数比为1:2 D、普鲁士白的化学式为NaFe(CN)3
A、铁在元素周期表中位于第4周期第Ⅷ族 B、普鲁士蓝的导电能力小于普鲁士白 C、普鲁士蓝中Fe2+与Fe3+个数比为1:2 D、普鲁士白的化学式为NaFe(CN)3 -
8、常温下,用Hg(NO3)2测定NaCl溶液中的c(Cl-)时,含Hg微粒的分布系数(δ)与lg c(Cl-)的关系如图所示。Hg2+与Cl-的配合物存在如下平衡:HgClHgClHgCl2HgCl+Hg2+。下列说法错误的是
 A、K1=10-1 , K2=10-0.85 B、在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶2∶1 C、在Q点:c(Cl-)+3c(HgCl)>c(H+)-c(OH-) D、若P点pH=7,c(Na+)+c(HgCl+)-c(NO)+2c(HgCl2)=10-5.6 mol·L-1
A、K1=10-1 , K2=10-0.85 B、在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶2∶1 C、在Q点:c(Cl-)+3c(HgCl)>c(H+)-c(OH-) D、若P点pH=7,c(Na+)+c(HgCl+)-c(NO)+2c(HgCl2)=10-5.6 mol·L-1 -
9、聚碳酸酯(L)可用于制作滑雪镜镜片,透明性好、强度高、不易碎,其结构简式如图

已知:2R'OH+

 + 2R''OH。L可由两种链状单体经该反应制备。下列关于L的说法错误的是A、制备L的反应是缩聚反应 B、制备L的单体分子中均含两个苯环 C、1 mol L中sp3杂化的碳原子数目为3NA D、分离出苯酚可促进L的合成
+ 2R''OH。L可由两种链状单体经该反应制备。下列关于L的说法错误的是A、制备L的反应是缩聚反应 B、制备L的单体分子中均含两个苯环 C、1 mol L中sp3杂化的碳原子数目为3NA D、分离出苯酚可促进L的合成 -
10、双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极I为掺杂Na2S2的电极,电极Ⅱ为碳电极。电池工作原理如图所示。下列说法错误的是
 A、离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜 B、放电时,中间储液器中NaOH的浓度不断变大 C、充电时,电极I的电极反应式为:2S-2e-=S D、充电时,电路中每通过1mol电子,阳极室溶液质量理论上增加9g
A、离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜 B、放电时,中间储液器中NaOH的浓度不断变大 C、充电时,电极I的电极反应式为:2S-2e-=S D、充电时,电路中每通过1mol电子,阳极室溶液质量理论上增加9g -
11、下列有关说法正确的是A、Na2O和Na2O2固体中阳离子和阴离子个数比都是 B、CO2和SiO2的化学键类型和晶体类型相同 C、和NH3都可以作为配合物的配体 D、Al和N的原子轨道都有3个单电子
-
12、阴离子和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是
 A、的空间构型为正四面体 B、二脲基分子中N-H的H和离子的O形成氢键 C、所含元素原子的杂化轨道类型均相同 D、所含元素基态原子的第一电离能最大的是N
A、的空间构型为正四面体 B、二脲基分子中N-H的H和离子的O形成氢键 C、所含元素原子的杂化轨道类型均相同 D、所含元素基态原子的第一电离能最大的是N -
13、中国科学院研究员研究双层电容器中储能行为时,运用到某种离子化合物结构如图所示。其中X、Y、Z、M、L、Q均为短周期主族元素,且原子序数依次增大。M、Q同族且两种元素组成的某种阴离子在强酸性溶液环境下可以产生淡黄色沉淀;Y是有机物的基本骨架元素。下列结论正确的是
 A、Y的氢化物沸点一定高于Z的氢化物 B、Z的含氧酸不一定属于强酸 C、简单离子半径大小的顺序为: Q>X>M>L D、L的铵盐溶液能存放在玻璃试剂瓶中
A、Y的氢化物沸点一定高于Z的氢化物 B、Z的含氧酸不一定属于强酸 C、简单离子半径大小的顺序为: Q>X>M>L D、L的铵盐溶液能存放在玻璃试剂瓶中 -
14、湖北名菜“洪山菜薹”含有丰富的花青素,具有良好的抗氧化活性。其中矢车菊色素的结构如图所示。下列有关该物质的说法正确的是
 A、化学式为 B、与苯酚互为同系物 C、能与发生显色反应 D、能发生氧化反应、取代反应和消去反应
A、化学式为 B、与苯酚互为同系物 C、能与发生显色反应 D、能发生氧化反应、取代反应和消去反应 -
15、化学在生产生活中有着广泛的应用,下列两项内容说法正确且存在因果关系的是( )
物质性质
实际应用
A
硅为半导体材料
SiO2用于光纤通讯
B
Cl2具有氧化性
氯水可以漂白有色布条
C
Al表面易形成致密的氧化物薄膜
可以用铝槽车运送热的浓硫酸
D
乙醇可以使蛋白质变性
乙醇用于制作医用酒精
A、A B、B C、C D、D -
16、“空气变面包,氨功不可没”。下列说法错误的是A、液氨可用作制冷剂 B、是平面三角形的极性分子 C、可以还原CuO D、合成氨是人工固氮最重要途径
-
17、化学与生活、生产密切相关,下列说法正确的是A、为增强“84”消毒液的消杀新冠肺炎病毒效果,可加入浓盐酸 B、从石墨中剥离出的石墨烯薄片能导电,因此是电解质 C、油脂、糖类以及蛋白质在人体内均能发生水解反应 D、嫦娥五号返回器带回的月壤中含有 , 它与地球上的属于同位素
-
18、氯喹是合成一种抑制病毒药物的中间体,其合成路线如下图:
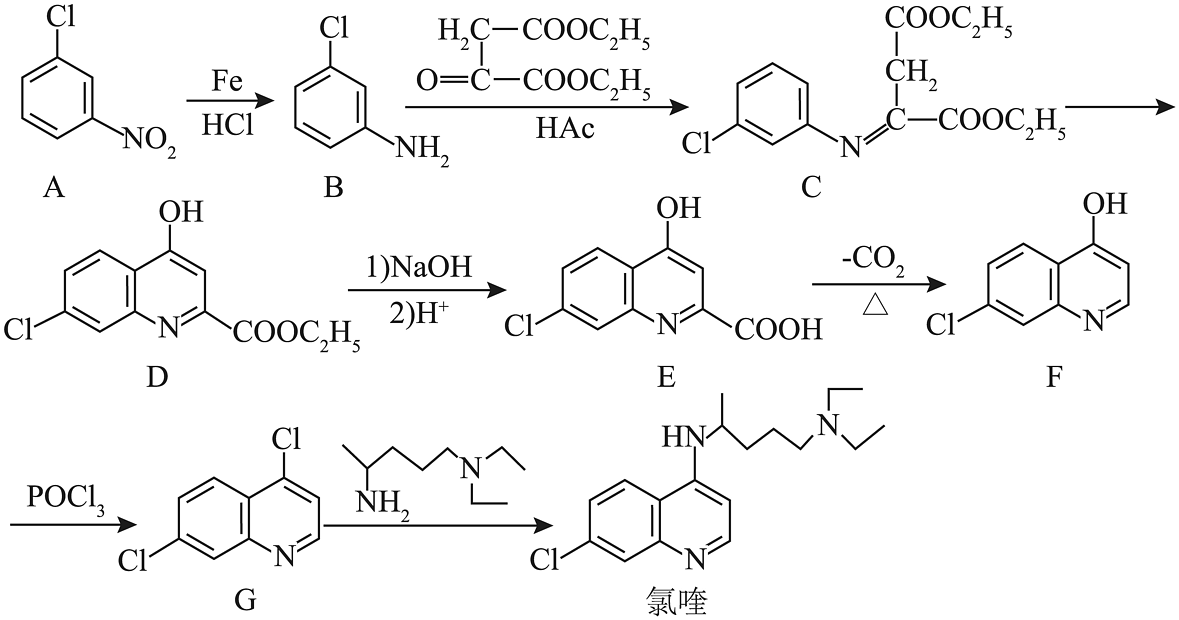 (1)、D分子中含氧官能团的名称是。(2)、的反应需经历两步,其反应类型依次为、。(3)、CD反应过程中有副产物X(与D互为同分异构体)生成,X的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、D分子中含氧官能团的名称是。(2)、的反应需经历两步,其反应类型依次为、。(3)、CD反应过程中有副产物X(与D互为同分异构体)生成,X的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①酸性条件下水解得两种均能发生银镜反应的有机产物,其中一种与溶液发生显色反应;②分子中有氰基(-CN);③分子中有4种不同化学环境的氢;④分子中有一个手性碳原子。
(5)、写出以1,3-丁二烯( )和
)和 为原料制备
为原料制备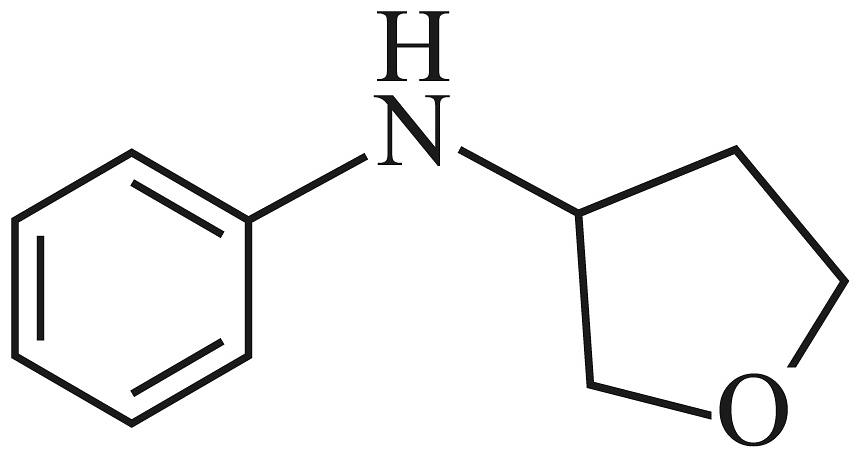 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
19、溴苯主要用于溶剂、分析试剂和有机合成等。合成溴苯所用原料苯、溴及溴苯的部分物理性质数据及实验装置如下所示。
苯
溴
溴苯
密度/g·cm-3
0.88
3.10
1.50
沸点/℃
80
59
156
水中溶解度
微溶
微溶
微溶
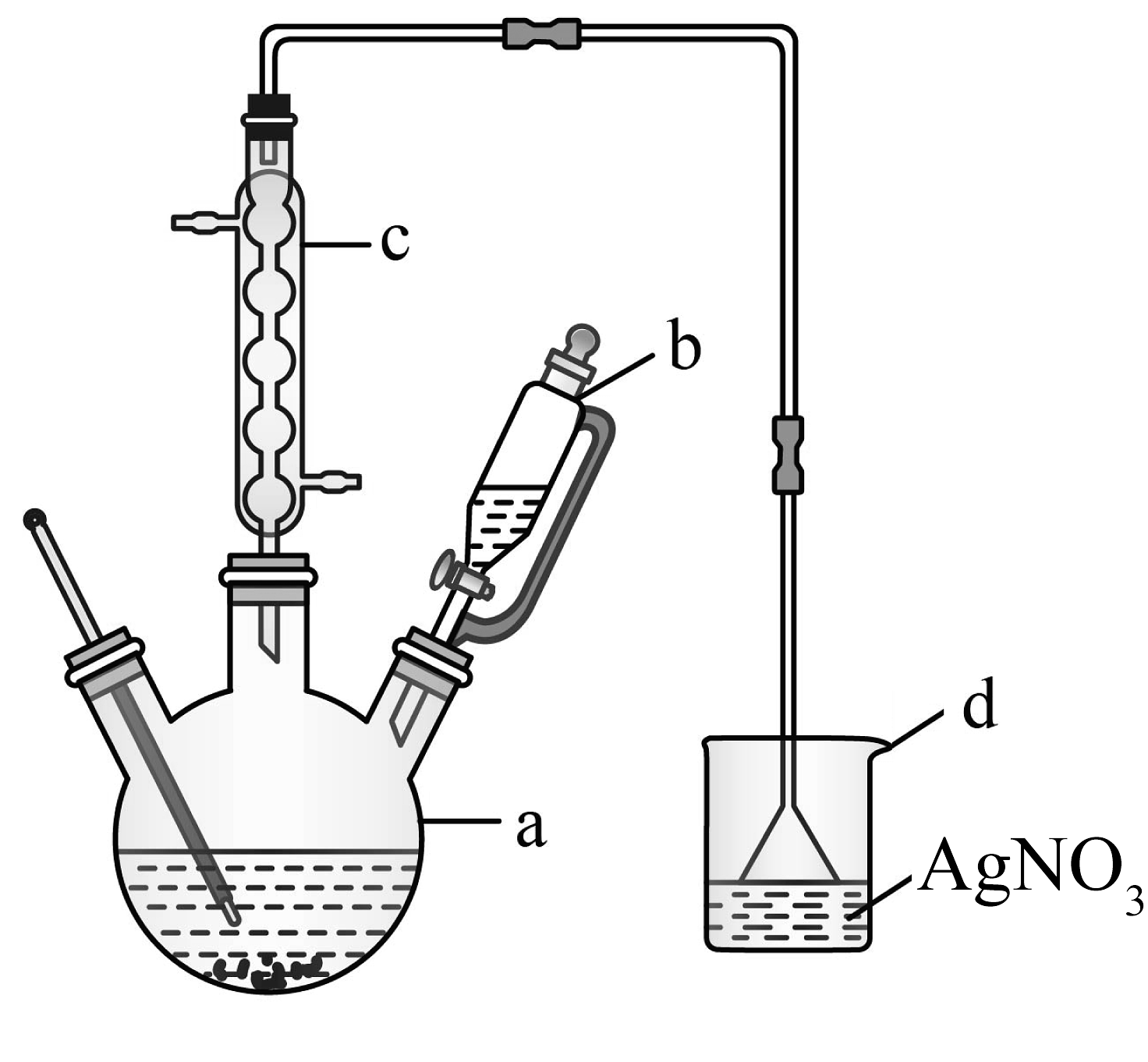 (1)、装置a名称是。(2)、在a中加入少量铁屑和苯,将b中液溴缓慢加入a,发生反应的化学方程式为 , 能说明该反应所属类型的实验现象是。装置c的作用是 , 水流方向是(填“下进上出”或“上进下出”)。(3)、若反应温度过高会生成二溴代苯,写出其中一种主要产物的结构简式。(4)、待反应结束后,从a中混合液分离、提纯产物。
(1)、装置a名称是。(2)、在a中加入少量铁屑和苯,将b中液溴缓慢加入a,发生反应的化学方程式为 , 能说明该反应所属类型的实验现象是。装置c的作用是 , 水流方向是(填“下进上出”或“上进下出”)。(3)、若反应温度过高会生成二溴代苯,写出其中一种主要产物的结构简式。(4)、待反应结束后,从a中混合液分离、提纯产物。①向a中加入水,过滤除去未反应的铁屑。
②补充完整由滤液提取溴苯的实验方案。(实验中可选用的设备和试剂:蒸馏水、10%的NaOH溶液、无水氯化钙、通风橱)
-
20、有机化合物是一种可用于小面积轻度创面镇痛的医用常见麻醉剂,对有机物A进行质谱分析、红外光谱分析,结果如图所示。
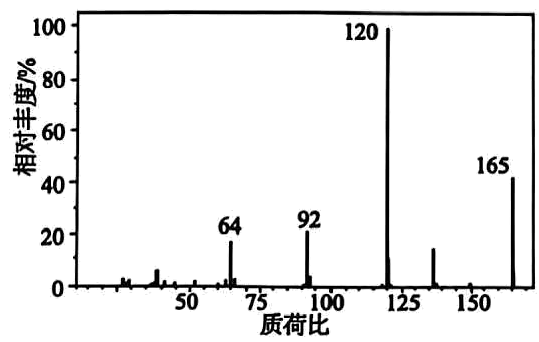
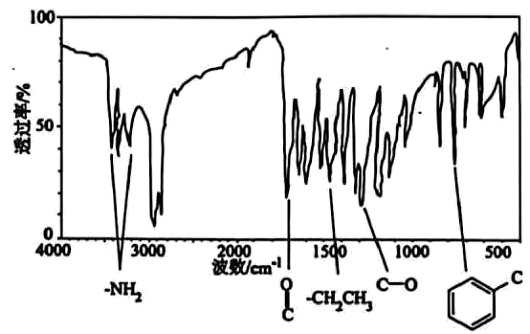 (1)、有机物完全燃烧生成二氧化碳、水和氮气,求该有机物的分子式(写出计算过程)。(2)、有机物A的核磁共振氢谱有5个峰且面积之比为3:2:2:2:2:2,该有机物的结构简式为。(3)、有机物A与氢氧化钠溶液反应的化学方程式为。(4)、有机物的一种芳香族同分异构体具有三种不同化学环境的氢,写出两种满足条件的同分异构体结构简式。
(1)、有机物完全燃烧生成二氧化碳、水和氮气,求该有机物的分子式(写出计算过程)。(2)、有机物A的核磁共振氢谱有5个峰且面积之比为3:2:2:2:2:2,该有机物的结构简式为。(3)、有机物A与氢氧化钠溶液反应的化学方程式为。(4)、有机物的一种芳香族同分异构体具有三种不同化学环境的氢,写出两种满足条件的同分异构体结构简式。