-
1、在探究新制氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )A、向氯水中滴加硝酸酸化的 AgNO₃溶液,产生白色沉淀,说明氯水中含有( B、新制氯水使红玫瑰变为白玫瑰,说明 Cl₂ 具有漂白性 C、向氯水中加入粉末,有气泡产生,说明氯水中含有 D、新制氯水呈浅黄绿色,说明氯水中有氯气分子
-
2、下列化学反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多: B、石灰乳与盐酸反应: C、氢氧化钡溶液跟稀硫酸反应: D、溶液中加足量B a(OH)₂溶液:)
-
3、下列有关氯及其化合物的性质与用途不具有对应关系的是( )A、盐酸呈酸性,可用于除铁锈 B、Cl2 能溶于水,可用于工业制盐酸 C、NaClO具有强氧化性,可用作漂白剂 D、HClO具有强氧化性,可用作棉、麻的漂白剂
-
4、我国在春秋初年已掌握了冶铁技术。下列关于铁及其化合物的说法中不正确的是( )A、铁具有良好的导热性、导电性和延展性 B、FeO是一种红棕色粉末,俗称铁红,常用作红色染料 C、加热条件下,Fe 与 Cl2 发生反应生成氯化铁 D、FeO和 Fe2O3都是碱性氧化物
-
5、室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液: B、的溶液中: C、使酚酞变红色的溶液中: D、溶液:
-
6、下列物质在给定条件下的转化均能一步实现的是( )A、 B、 C、BaCl₂ 溶液BaCO₃CO₂ D、
-
7、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为 1.3 nm)恢复了磁性。 下列关于“钴酞菁”分子的说法正确的是( )A、其在水中形成的分散系属于溶液 B、“钴酞菁”分子直径比 H⁺的直径小 C、其在水中形成的分散系能产生丁达尔效应 D、“钴酞菁”分子不能透过滤纸
-
8、世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是( )A、FeO B、Fe₂O₃ C、Fe₃O₄ D、Fe
-
9、双酰胺类杀虫剂的中间体吡啶联噻唑(Ⅴ)合成路线如下:
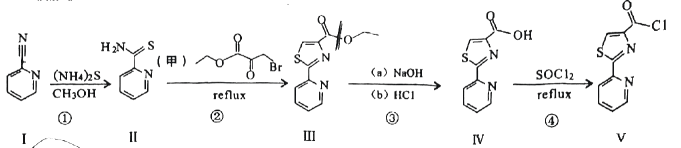
已知:

回答以下问题:
(1)、化合物Ⅰ的分子式为 .(2)、下列说法不正确的是____.A、化合物Ⅰ中所有原子共平面 B、Ⅳ→Ⅴ属于取代反应 C、化合物Ⅲ和Ⅴ分子中均含有羧基 D、化合物Ⅰ和Ⅱ分子中的C原子均为杂化(3)、写出Ⅲ→Ⅴ过程中步骤(a)的化学方程式 .(4)、根据化合物甲的同分异构体乙的结构特征,分析预测乙可能的化学性质,完成下表:序号
反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
, 浓硫酸,加热
③
氧化反应
(5)、化合物Ⅰ与的加成产物X的同分异构体有多种,写出其中符合下列条件的有机物的结构简式 .a.红外光谱显示分子中含一个苯环 b.苯环上仅含两个取代基 c.核磁共振氢谱中峰面积之比为
(6)、双酰胺类杀虫剂 , 对粘虫的杀虫活性达100%,以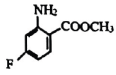 和中间体V为原料,合成的路线如图:
和中间体V为原料,合成的路线如图: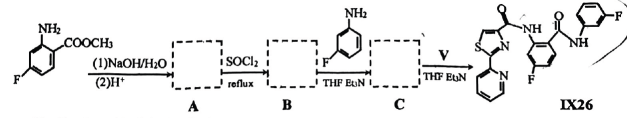
①物质C的结构简式为 .
②以物质A为原料合成有机高分子化合物的方程式为 .
-
10、“绿水青山就是金山银山”.的回收和利用有利于碳中和、碳达峰.回答下列问题:(1)、热化学循环还原制的原理如下图:
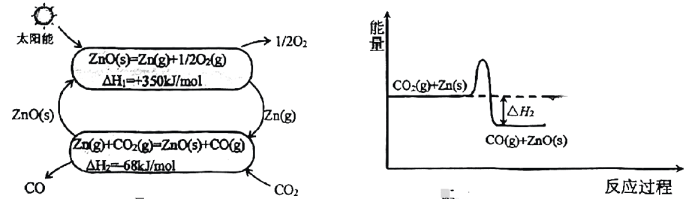
图3 图4
①晶体的模型为 .
②的反应过程如图3,在图4中仿照第一步反应画出第二步反应过程的能量变化示意图 .
③科研小组尝试利用固体表面催化工艺进行的分解.若用●、○和
 分别表示C原子、O原子和固体催化剂,在固体催化剂表面分解的过程如下图所示.下列有关说法中正确的是 .
分别表示C原子、O原子和固体催化剂,在固体催化剂表面分解的过程如下图所示.下列有关说法中正确的是 . 
A.固体催化剂降低了反应的 B.过程③体系能量降低
C.过程②有键的断裂 D.整个过程中形成了头碰头的键
(2)、二甲醚是重要的有机中间体,在一定条件下利用与可合成二甲醚:主反应Ⅰ:
副反应Ⅱ:
④一定条件下,的平衡转化率及平衡时的选择性(生成所消耗的与消耗总量的比值)随温度变化如图所示.下列说法不正确的是 .

A.增大压强,反应Ⅰ平衡正向移动,反应Ⅱ平衡不移动
B.当容器中不变时,两个反应均达到最大限度
C.
D.选用合适的催化剂可提高二甲醚的选择性
⑤图中后平衡转化率升高的原因为 .
⑥在下,将和通入刚性容器中发生反应Ⅰ、Ⅱ,时达到平衡,测得的转化率为60%,容器中的浓度为 , 则(用含t的式子表示),反应Ⅰ的平衡常数 .
-
11、金属铼广泛用于航空航天等领域.工业上用富铼渣(铼元素主要以形式存在,砷主要以形式存在)制取铼粉.工艺流程如下:

已知:常温下;为第四周期第ⅤA族元素;高铼酸铵微溶于冷水,易溶于热水.
回答下列问题:
(1)、的简化电子排布式为 .(2)、“氧化”时铼转化为强酸高铼酸 . “滤渣1”的主要成分是硫单质.写出“氧化”时发生反应的离子方程式: .(3)、综合考虑,富铼渣“氧化”中浸出温度选择为宜,原因是 .(4)、常温下,“反萃取”得到高铼酸铵溶液的 , 则溶液中(填“>”“<”或“=”).(5)、“析晶”得到的主要产品是 . 提纯粗高铼酸铵固体的方法是 , 图1是的X射线衍射图谱,则属于(填“晶体”或“非晶体”).
图1:高铼酸铵谱 图2
(6)、“热解”产生可再生循环利用的物质是 .(7)、已知的立方晶胞如图2,则在晶胞中的位置为;晶体中一个周围与其最近的O的个数为 . -
12、某实验小组根据以下装置制备84消毒液,并探究84消毒液的性质.
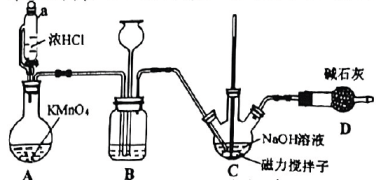
已知: , 若温度超过 , 会生成杂质.
回答下列问题:
(1)、Ⅰ.84消毒液的制备
仪器a的名称为 .(2)、装置A中反应的离子方程式为 .(3)、装置B的作用是(任写一个即可).(4)、制备溶液时,为减少杂质的产生,应采取的措施是(写两条).(5)、为探究性质,设计如右图所示装置,在A处通入未经于燥的氯气.当关闭K处弹簧夹时,C处红布条看不到明显现象;当打开K处的弹簧夹后,C处红布条逐渐褪色.则B瓶内液体可能是____. A、饱和溶液 B、溶液 C、 D、浓硫酸(6)、Ⅱ.探究84消毒液的性质
A、饱和溶液 B、溶液 C、 D、浓硫酸(6)、Ⅱ.探究84消毒液的性质84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究.
【提出假设】医用酒精中的被氧化为
【实验方案】实验方案及现象如下:
实验操作
取样检测时间点
实验现象
常温下将医用酒精和84消毒液混合,在不同反应时间点,分别取反应后的溶液滴加到新制氢氧化铜悬浊液中加热
①
橙黄色沉淀
黑色沉淀
【实验结论1】产物中有乙醛,且乙醛会被转化为其它物质.补充①的实验现象: .
【查阅资料】混合体系中可能发生以下反应:
(卤化反应)
【实验设计】取2份84消毒液,缓慢滴加医用酒精或蒸馏水各 , 通过测定过程中变化判断是否发生卤化反应(忽略过程中的热效应对的影响).实验结果如图.

【实验结论2】数据表明,反应过程中增大,说明乙醛发生了卤化反应.
【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定 , 在84消毒液中添加了少量 , 且由于乙醇的“锁水”效应也会使增大(提示:乙醇与不反应).
【数据分析】②已知上述实验:84消毒液中 .
通过计算证明84消毒液中添加了少量 , 写出计算过程.
(7)、【优化实验】③该同学增加了对照实验,证明反应生成了 . 请简述方案和结果: .【实验总结】医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应.
-
13、2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )
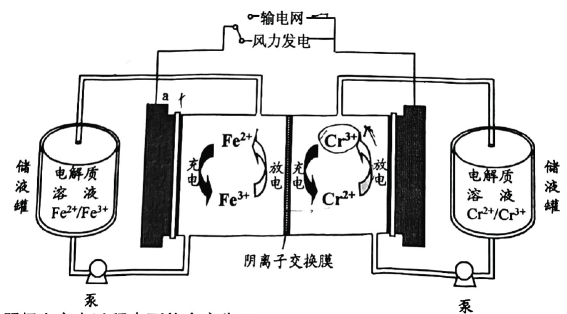 A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少
A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少 -
14、为减少对环境的污染,工业上常用电解法对煤进行脱硫处理.原理:利用电极反应先将变为再与煤中的含硫物质(主要为 , 结构如图)发生反应:(未配平).下列说法不正确的是( )
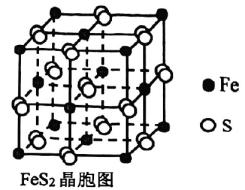 A、中存在非极性键 B、氧化性: C、还原剂与氧化剂的物质的量之比为 D、生成 , 转移电子的物质的量为
A、中存在非极性键 B、氧化性: C、还原剂与氧化剂的物质的量之比为 D、生成 , 转移电子的物质的量为 -
15、量子点的发现和合成掀开了元素周期表研究的新视角.W、X、Y、Z为原子序数依次增大的元素,W的一种同位素常用作测定文物年代,Y是地壳中含量最多的元素.血红素中的价电子排布式为 . 下列说法不正确的是( )
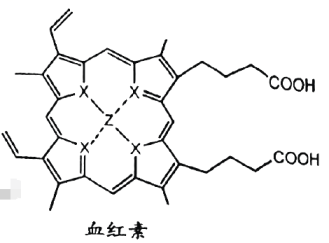 A、元素电负性: B、第一电离能: C、血红素能发生氧化反应、酯化反应 D、血红素的配位键中,由提供空轨道,X提供孤电子对
A、元素电负性: B、第一电离能: C、血红素能发生氧化反应、酯化反应 D、血红素的配位键中,由提供空轨道,X提供孤电子对 -
16、大约4000年前,埃及人会用硫燃烧产生的来漂白布匹.利用下列装置验证性质,有关说法不正确的是( )
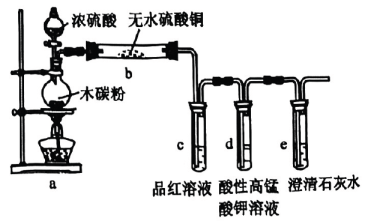 A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含
A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含 -
17、陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
装有的密闭烧瓶置于热水中颜色变深
B
在汽车尾气系统中安装催化器以减少尾气污染
和在催化剂作用下反应生成和
C
常温下,测定等物质的量浓度的和溶液的 , 前者的大
非金属性:
D
浓氨水可检验氯气管道是否泄漏
氨气是非电解质
A、A B、B C、C D、D -
18、海洋碳循环是影响全球气候变化的关键控制环节,下图为海洋中碳循环的原理图.设为阿伏加德罗常数的值.下列说法正确的是( )
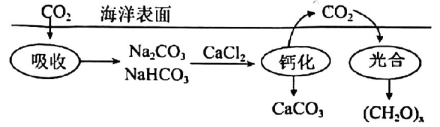 A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为
A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为 -
19、氮是组成氨基酸的基本元素之一,在生物体内有极大作用.部分含N物质的分类及相应化合价关系如图所示.下列说法不合理的是( )
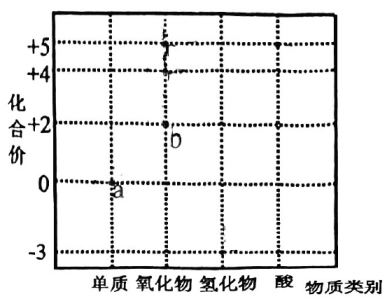 A、属于氮的固定 B、d可用作制冷剂 C、能与反应生成f的物质只有c D、f的浓溶液需要保存在棕色试剂瓶中
A、属于氮的固定 B、d可用作制冷剂 C、能与反应生成f的物质只有c D、f的浓溶液需要保存在棕色试剂瓶中 -
20、我国科学家发明一种新型电池,该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气.下列说法正确的是( )A、碳纳米管参与电极反应 B、负极发生还原反应 C、阳离子由正极移向负极 D、正极产物为