-
1、已知:20℃时,Ksp(AgCl)=1.1×10﹣10 , Ksp(AgBr)=2.0×10﹣13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,下列说法正确的是( )A、只有AgBr沉淀生成 B、AgCl与AgBr沉淀等量生成 C、AgCl与AgBr沉淀都有,但是以AgCl为主 D、AgCl与AgBr沉淀都有,但是以AgBr为主
-
2、有关下列装置的说法不正确的是( )
 A、图1所示不能构成原电池 B、图2锌锰干电池属于一次电池,锌作负极 C、图3是“纸电池”,Zn片失去电子,发生氧化反应 D、图4电池Al电极反应式为:Al-3e-+3H2O=Al(OH)3+3H+
A、图1所示不能构成原电池 B、图2锌锰干电池属于一次电池,锌作负极 C、图3是“纸电池”,Zn片失去电子,发生氧化反应 D、图4电池Al电极反应式为:Al-3e-+3H2O=Al(OH)3+3H+ -
3、某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图。下列说法正确的是( )
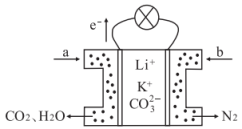 A、此电池在常温时也能工作 B、正极电极反应式为:O2+2CO2+4e-=2 C、向正极移动 D、a为CH4 , b为CO
A、此电池在常温时也能工作 B、正极电极反应式为:O2+2CO2+4e-=2 C、向正极移动 D、a为CH4 , b为CO -
4、将AgCl分别投入下列溶液中:
1. 40mL0.03mol·L-1的HCl溶液
2. 50mL0.03mol·L-1的AgNO3溶液
3. 30mL0.02mol·L-1的CaCl2溶液
4. 10mL蒸馏水
AgCl的溶解度由大到小的顺序是____。
A、1=2>3>4 B、3>1=2>4 C、4>1=2>3 D、4>3>2>1 -
5、银锌电池用作各种电子仪器的电源,电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2 , 下列说法不正确的是( )A、原电池放电时,负极上发生反应的物质是Zn B、正极发生的反应是Ag2O+2e−+H2O=2Ag+2OH- C、工作时,负极区溶液c(OH-)减小 D、溶液中OH-向正极移动,K+、H+向负极移动
-
6、常见的铅蓄电池的电极材料为PbO2和Pb,电解液为30%的稀硫酸溶液,电池放电的总反应为PbO2+Pb+2H2SO42PbSO4+2H2O,则下列说法正确的是( )A、PbO2为电池的负极 B、充电时电子由正极流向负极 C、充电时阴极发生氧化反应 D、放电时电解液的pH值逐渐增大
-
7、将用导线连接的锌片和铜片插入盛有稀硫酸的烧杯中,叙述正确的是( )A、正极有O2逸出 B、硫酸溶液的pH增大 C、电子通过导线由铜片流向锌片 D、锌片上有H2逸出
-
8、在某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,下列说法正确的是( )A、AgCl的溶解度、Ksp 均减小 B、AgCl的溶解度和Ksp均不变 C、AgCl的溶解度减小,Ksp不变 D、AgCl的溶解度不变,Ksp减小
-
9、现进行下列实验。
将2滴0.1 mol/L 溶液滴入2 mL 0.1 mol/L NaCl溶液中,观察到生成白色沉淀。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,静置。观察到沉淀变为黄色。
下列关于上述实验的分析错误的是( )
A、步骤(1)中存在沉淀溶解平衡: B、步骤(2)表明AgCl转化为AgI C、步骤(2)所得上层清液中不含 D、该实验可以证明AgI的比AgCl的小 -
10、锦纶1010()因其具有高韧性、耐磨性、电绝缘性、化学稳定性等优异性能成为宇航服的首选材料。其合成路线如下(部分反应试剂、反应条件略):

已知:
(1)、A的名称为: , E中官能团名称:。(2)、经研究表明由B电解合成C的方法具有无污染、合成路线单一等优势。电解过程中,B到C的转化发生在(填“阴极”或“阳极”)。(3)、M为D的同系物且相对分子量比D少了14,其核磁共振氢谱上只有2种峰,写出M的结构简式:。(4)、工业上常使用蓖麻油酸直接制备G,根据蓖麻油酸的结构式( ),分析预测其可能的化学性质,完成下表。
),分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
取代反应
b
(5)、下列关于反应E→F的说法中,正确的有____A、反应过程中有非极性键的断裂和形成 B、反应物E中,碳原子和氧原子均采用杂化 C、反应生成物除F外,均为非极性分子 D、化合物E中键电子云成轴对称(6)、己二酸又名肥酸,是脂肪族二元酸中最具应用价值的二元酸,以丁二醇()为原科,结合上述信息,制备己二酸。基于你设计的合成路线,回答下列问题:①从丁二醇出发,第一步的反应类型为。
②相关步骤涉及到酯化反应,其化学方程式为。
③最后一步反应中,有机反应物为(写结构简式)。
-
11、我国加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。(1)、铜基催化剂制甲醇其主要反应如下:
Ⅰ.合成甲醇:;;
Ⅱ.逆水煤气反应:;;
Ⅲ.成气合成甲醇:;;
回答下列问题:
①基态的3d电子轨道表示式为。
② , (用 , 表示)。
(2)、若时将6mol 和8mol 充入容积为2L的密闭容器中只发生反应Ⅰ: , 的物质的量变化如上表所示。物质的量/mol
/℃
/℃
0
5min
10min
15min
20min
25min
30min
8.0
3.5
2.0
2.0
1.7
1.5
1.5
①在℃条件下5-10min内,以表示的该反应速率 , 该条件下的平衡常数K=。
②下列说法正确的是。
A.
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)、某研究小组对催化剂材料进行了研究。下列四组实验,控制和初始投料比均为1∶2.2,经过相同反应时间( min)温度(K)
催化剂
转化率(%)
甲醇选择性(%)
综合选项
543
Cu/ZnO纳米棒材料
12.3
42.3
A
543
Cu/ZnO纳米片材料
11.9
72.7
B
553
Cu/ZnO纳米棒材料
15.3
39.1
C
553
Cu/ZnO纳米片材料
12.0
71.6
D
由表格中的数据可知,相同温度下不同的催化剂对的转化为的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(填字母符号)。
(4)、在p=4.00MPa、原料气、合适催化剂的条件下发生反应,温度对转化率、产率、选择性的影响如图所示。已知:的选择性。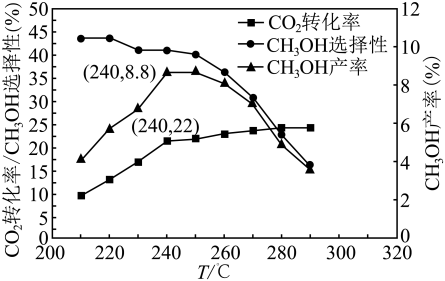
①转化率随温度升高而增大的原因可能是。
②选择性随温度升高而减小的原因可能是。
-
12、五氧化二钒()广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有、及少量、等杂质)回收的部分工艺流程如下:
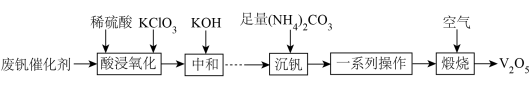
已知:
①可溶于热水,不溶于乙醇;
②常温下,部分含钒物质在水中的溶解性见下表;
物质
溶解性
难溶
可溶
易溶
难溶
③+5价钒在溶液中的主要存在形式与溶液pH的关系见下表;
pH
<6
6~8
8~10
10~12
主要离子
回答下列问题:
(1)、“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为____(填字母)。A、冷水 B、热水 C、乙醇 D、NaOH溶液(2)、“中和”时调节pH为7的目的,一是将转化为;二是。(3)、“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入生成“离子交换”和“洗脱”两步操作可简单表示为:(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(填“酸性”或“碱性”),理由是。(4)、“沉钒”析出的晶体需要洗涤,证明已洗涤干净的实验操作及现象为。(5)、写出“煅烧”中发生反应的化学方程式。(6)、钒(V)的某种氧化物的晶胞结构如图所示。该晶体的化学式为。
-
13、以溶液为实验对象,研究物质之间反应的复杂多样性。实验如下:(1)、Ⅰ.金属与溶液反应
配制溶液,需要将固体先溶于浓盐酸,再稀释至指定浓度,原因是。装置
序号
金属
现象及产物检验

ⅰ
镁条
立即产生大量气体,溶液颜色变红棕色;
片刻后气泡减少,金属表面产生红褐色沉淀。
ⅱ
锌粒
开始时无明显气泡,半分钟后有气体产生,溶液颜色慢慢加深;一段时间后,金属表面产生红棕色沉淀
ⅲ
铜粉
无气体产生,溶液逐渐变为蓝绿色;
(2)、根据实验ⅰ中的现象,推测红褐色液体为胶体,通过可以快速判断其是否为胶体。(3)、溶液与Cu反应的离子方程式为 , 实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化,甲同学认为产生该现象的原因可能是此实验条件下氧化性: , 乙同学认为可以根据ⅲ判断氧化性: , 理由是。(4)、Ⅱ.溶液与溶液反应:
取红棕色溶液少许,加入 , 产生蓝色沉淀,推测与反应的离子方程式是。
(5)、另取红棕色溶液少许,检测其为胶体,向其中继续滴加溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是。(6)、结合(4)、(5),推测溶液与溶液反应同时存在反应和反应。从下列选项选择:A.复分解 B.双水解 C.置换 D.氧化还原
-
14、“双极膜组”电渗析法可以实现含盐废水资源的循环利用。工业上也利用该方法实现海水的淡化,同时获得两种气体和副产品A、B.其工作原理如图所示,工作时,在双极BP膜界面处被催化解离成和。下列说法错误的是( )
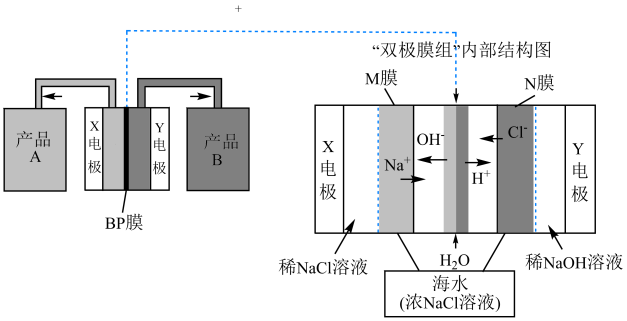 A、Y电极为阴极,电极反应式为 B、M膜为阳离子交换膜,可通过M膜、BP膜和N膜进入右室 C、每消耗58.5g NaCl,理论上获得副产品A和B各1mol D、“双极膜组”电渗析法也可应用于从溶液中制备KOH和
A、Y电极为阴极,电极反应式为 B、M膜为阳离子交换膜,可通过M膜、BP膜和N膜进入右室 C、每消耗58.5g NaCl,理论上获得副产品A和B各1mol D、“双极膜组”电渗析法也可应用于从溶液中制备KOH和 -
15、的排放来自汽车尾气,研究利用反应 , 用活性炭可对其进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。(已知:气体分压=气体总压×物质的量分数),下列有关说法错误的是( )
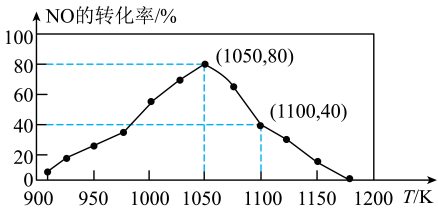 A、若能测得反应产生22g , 则反应放出的热量为17.0kJ B、达到平衡后增大活性炭的用量,平衡不移动 C、在950K~1000K之间,化学反应速率: D、1050K时,反应的化学平衡常数
A、若能测得反应产生22g , 则反应放出的热量为17.0kJ B、达到平衡后增大活性炭的用量,平衡不移动 C、在950K~1000K之间,化学反应速率: D、1050K时,反应的化学平衡常数 -
16、已知短周期元素A~G的原子序数与最高正价或最低负价的关系如图所示,下列有关说法正确的是( )
 A、元素电负性:B>C>A B、氢化物沸点:B>F>G>C C、D、E、G的最高价氧化物对应水化物间能相互反应 D、C与D形成的化合物只含有离子键
A、元素电负性:B>C>A B、氢化物沸点:B>F>G>C C、D、E、G的最高价氧化物对应水化物间能相互反应 D、C与D形成的化合物只含有离子键 -
17、下列陈述Ⅰ与陈述Ⅱ均正确,且两者存在因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
将稀硝酸加入过量铁粉中充分反应后,滴加KSCN溶液后无明显现象
稀硝酸有氧化性,只能将Fe氧化为
B
已知反应 , 压缩体积可观察到体系颜色加深
改变压强可使化学平衡发生移动
C
用熟石灰处理酸性废水
熟石灰中含有
D
用pH计测定相同浓度的、NaCl溶液,测得溶液的pH大于NaCl溶液
比较酸性:
A、A B、B C、C D、D -
18、三氯化氮可用于漂白,发生反应:。设为阿伏加德罗常数,下列说法错误的是( )A、中所有原子均满足8电子稳定状态 B、生成28g 时,反应转移的电子数目为6 C、标准状况下,33.6L HCl气体中含有H+数目为1.5 D、1L 1mol/L HClO溶液中含有的数目小于
-
19、实验小组按如图装置进行实验,制备并探究的性质。下列说法错误的是( )
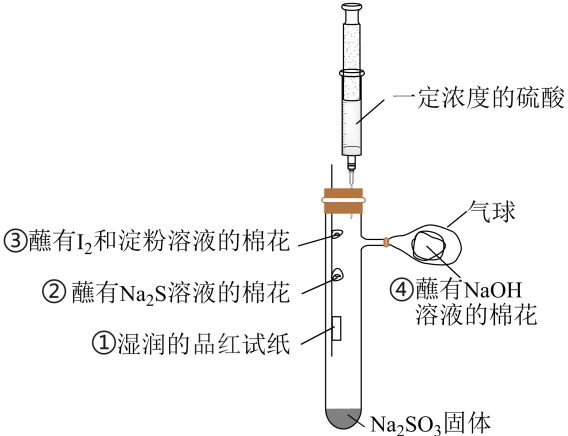 A、试管内制备的化学方程式为 B、②处观察到淡黄色固体生成,说明具有还原性 C、①、③处均可观察到颜色褪去,但褪色原理不相同 D、④处NaOH溶液可吸收多余的
A、试管内制备的化学方程式为 B、②处观察到淡黄色固体生成,说明具有还原性 C、①、③处均可观察到颜色褪去,但褪色原理不相同 D、④处NaOH溶液可吸收多余的 -
20、维生素D含量越高,老年大脑的认知功能越好。目前已知的维生素D至少有10种分子,维生素D3是其中重要的一种(结构如图),下列有关说法正确的是( )
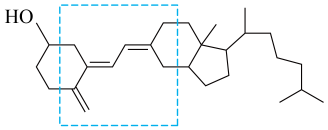 A、D3不存在手性碳原子 B、D3易溶于水,可溶解于水中服用 C、D3可与溴水发生取代反应使其褪色 D、D3分子中虚线框内所含碳原子可能共平面
A、D3不存在手性碳原子 B、D3易溶于水,可溶解于水中服用 C、D3可与溴水发生取代反应使其褪色 D、D3分子中虚线框内所含碳原子可能共平面