-
1、X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子.下列说法中不正确的是( )A、简单气态氢化物的热稳定性: B、第一电离能: C、Q在周期表的区 D、电负性:
-
2、关于熵变和焓变的理解,下列说法正确的是( )A、绝热体系中,自发过程向着熵增方向进行 B、水凝结成冰的过程中 C、反应能否自发进行与温度有关,一般高温时的影响为主 D、能够自发进行的反应一定是放热的反应
-
3、向溶液中滴加盐酸,反应过程中能量变化如图所示.下列说法正确的是( )
 A、反应为放热反应 B、 C、 D、 , 若使用催化剂,则变小
A、反应为放热反应 B、 C、 D、 , 若使用催化剂,则变小 -
4、可用作白色颜料和阻燃剂,实验室中可利用的水解反应制取 , 其总反应可表示为 , 下列说法中不正确的是:( )A、水解过程中可能会产生 B、配制溶液时可以加入稀盐酸抑制水解 C、反应前期为促进水解反应的进行,操作时应将缓慢加入少量水中 D、为得到较多 , 可在反应后期加入少量氨水
-
5、酒石酸是一种二元弱酸,下列关于的说法中不正确的是:( )A、向溶液中加水稀释,增大 B、属于正盐 C、向水中加入固体 , 可促进水的电离 D、溶液中:
-
6、下列有关电极方程式或离子方程式正确的是( )A、铅酸蓄电池充电时的阳极反应: B、用银作电极电解稀盐酸: C、与稀硝酸反应: D、硫化钠溶液中加入少量氯化铁溶液:
-
7、在给定条件下,一定能大量共存的离子组是( )A、加溶液显红色的溶液: B、使酚酞变红色的溶液中: C、与反应能放出的溶液中: D、在的溶液中:
-
8、和在恒容密闭容器中发生反应: . 已知的键能分别为(a、b、c均大于零).下列说法正确的是( )A、 , 则 B、氢原子与溴原子形成分子需吸收能量 C、氢气与溴单质充分反应后,放出的能量总是小于 D、若氢气与溴单质充分反应放出能量,消耗的和均大于
-
9、下列说法正确的是( )
 A、图1可用于稀硫酸和溶液反应的中和热测定 B、图2可用于由制取无水固体 C、图3可用于模拟钢铁的析氢腐蚀 D、图4可用标准溶液测定某醋酸溶液的物质的量浓度
A、图1可用于稀硫酸和溶液反应的中和热测定 B、图2可用于由制取无水固体 C、图3可用于模拟钢铁的析氢腐蚀 D、图4可用标准溶液测定某醋酸溶液的物质的量浓度 -
10、下列化学用语或说法中正确的有( )A、B原子由时,由基态转化为激发态,形成吸收光谱 B、疏原子最外层的电子排布
 违背了泡利原理
C、第三周期基态原子的第一电离能介于铝、磷之间的元素有3种
D、基态原子价层电子排布式为的元素的族序数一定为
违背了泡利原理
C、第三周期基态原子的第一电离能介于铝、磷之间的元素有3种
D、基态原子价层电子排布式为的元素的族序数一定为
-
11、已知是阿伏加德罗常数的值,下列说法中不正确的是( )A、的溶液中数目为 B、常温下的氢氧化钠溶液中由水电离出的的数目为 C、重水中所含质子数为 D、标准状况下将通入足量水中,溶液中数目之和小于
-
12、下列化学用语不正确的是( )A、基态原子最高能级电子云轮廓图:
 B、F-的结构示意图:
B、F-的结构示意图: C、总共含有4个能级的能层符号:N
D、第三周期中未成对电子数最多且中子数为17的元素的原子:
C、总共含有4个能级的能层符号:N
D、第三周期中未成对电子数最多且中子数为17的元素的原子:
-
13、下列水溶液因水解呈酸性的是( )A、 B、 C、 D、
-
14、滴定是分析化学重要的分析方法,根据其原理回答下列问题:(1)、Ⅰ.用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液(装置如图),某次滴定前、后盛放盐酸的滴定管中液面的位置。
仪器B的名称是。 (2)、此次滴定消耗的盐酸是mL。(3)、由下表可知,三次滴定中,有一次滴定所用标准盐酸体积有明显偏差,可能的原因是。(填写相应的字母)
(2)、此次滴定消耗的盐酸是mL。(3)、由下表可知,三次滴定中,有一次滴定所用标准盐酸体积有明显偏差,可能的原因是。(填写相应的字母)待测NaOH溶液体积(mL)
标准盐酸体积
滴定前的刻度(mL)
滴定后的刻度(mL)
10.00
0.40
20.50
10.00
2.10
24.20
10.00
4.10
24.00
a.锥形瓶用待测液润洗
b.滴定前滴定管尖嘴部分有气泡,滴定结束时气泡消失
c.滴定过程中锥形瓶中溶液溅出瓶外
d.滴定结束时,俯视读数
(4)、Ⅱ.高锰酸钾常用于亚硝酸盐含量的测定。有化学小组测定某样品中的含量,设计如下实验:①称取样品a g,加水溶解,配成100mL溶液
②取25.00mL溶液于锥形瓶中,用标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。
向滴定管中注入标准溶液之前的一步操作为。
(5)、高锰酸钾溶液应装在如图滴定管中。(填a或b) (6)、达到滴定终点时的现象是。
(6)、达到滴定终点时的现象是。 -
15、已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如表所示
酸
电离平衡常数
醋酸
K=1.75× 10-5
碳酸
K1=4.5×10-7 K2=4.7×10-11
亚硫酸
K1=1.4×10-2 K2=6.0×10-8
(1)、醋酸在水溶液中的电离方程式为: , 根据上表可知,酸性H2CO3H2SO3(填“>”“<”或“=”,下同),在相同条件下,试比较同浓度Na2CO3、Na2SO3溶液的 PH:Na2CO3 Na2SO3(2)、向0.1mol/L的CH3COONa溶液中加入少量下列物质,其水解程度增大的是____(填字母)。
A、NaCl溶液 B、Na2CO3固体 C、NH4Cl溶液 D、CH3COONa固体(3)、NaHSO3是中学化学常见的物质。HSO3- , 在水溶液中存在两个平衡:HSO3—⇋H+SO32- Ka2 , HSO3-+H2O ⇋H2SO3+OH- Kh2
已知25℃时,Ka2>Kh2 , 则0.1mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”)。
②溶液中 c(Na+)c(HSO3-)。(填“>”“<”或“=”)
-
16、根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示,其中盐桥内装琼脂-饱和KNO3溶液。请回答下列问题:
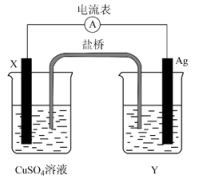 (1)、电极X的材料是;(填化学式,下同)电解质溶液Y是 。(2)、Ag是极。填(“正”或“负”)(3)、写出两电极的电极反应式:
(1)、电极X的材料是;(填化学式,下同)电解质溶液Y是 。(2)、Ag是极。填(“正”或“负”)(3)、写出两电极的电极反应式:银电极:;
X电极:。
(4)、外电路中的电子是从电极流向电极。(填电极材料名称)(5)、盐桥中向CuSO4溶液中迁移的离子是____(填字母)。A、K+ B、NO C、Ag+ D、SO(6)、1 mol Ag生成时,转移电子的物质的量为mol。 -
17、根据原电池的工作原理分析判断(填写“正极”或“负极”)。(1)、由组成原电池的电极材料判断。一般是活动性较强的金属为极,活动性较弱的金属或能导电的非金属为极。(2)、根据电流方向或电子流动方向判断。电流由极流向极;电子由极流向极。(3)、根据原电池中电解质溶液内离子的移动方向判断。在原电池的电解质溶液内,阳离子移向极,阴离子移向极。
-
18、要除去CuCl2溶液中的Fe3+ , 甲同学不知道调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38 ,
Cu(OH)2的溶度积Ksp=3×10-20 , 通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1 ,
(1)、则Cu(OH)2开始沉淀时溶液的pH为____A、4 B、4.4 C、5 D、5.5(2)、Fe3+完全沉淀时溶液的pH为____A、2 B、3 C、4 D、5(3)、通过调节溶液PH除去Fe3+而不损失Cu2+ , 调节PH的取值范围A、3≤PH<4 B、3≤PH≤4 C、2<PH≤3 D、2≤PH<3(4)、把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a、b相连,a为正极;c、d相连,c为负极;a、c相连,c上产生气泡;b、d相连,b质量减小,则四种金属的活动性由强到弱顺序为:____。A、a>b>c>d B、b>c>a>d C、b>a>c>d D、a>c>b>d -
19、工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:(1)、为除去溶液中的Fe2+ , 可先加入____,(从下面四个选项选择)将Fe2+氧化为Fe3+A、CuO B、Cl2 C、Cu(OH)2 D、H2O2(2)、然后加入适量的____,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。A、CuO B、Cl2 C、Fe(OH)3 D、H2O2
-
20、已知某温度下: , , 若加入来沉淀和 , 当溶液中和共存时,溶液中的为____。A、105 B、106 C、10-4 D、10-7