-
1、天津大学在存储信息方面取得重大突破,可让信息保存上万年.合成的脱氧核糖的结构如右图所示.下列说法不正确的是( )
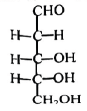 A、不能溶于水 B、含有手性碳 C、属于单糖 D、能发生加成反应
A、不能溶于水 B、含有手性碳 C、属于单糖 D、能发生加成反应 -
2、美好生活靠劳动创造.下列化学知识正确且与劳动项目有关联的是( )
选项
劳动项目
化学知识
A
使用复合肥料培育植物
复合肥含N、P、K三种元素中的两种或三种
B
用氢氟酸刻蚀玻璃生产磨砂玻璃
强酸制弱酸
C
用明矾处理含有悬浮微粒的水
具有吸附性
D
参观顺德糖厂制备蔗糖流程:提汁、清净、蒸发、结晶、分蜜、干燥
其中蒸发、结晶属于化学变化
A、A B、B C、C D、D -
3、从微观角度探析化学反应时,我们感受到一个神奇的微观世界.下列物质性质实验对应的化学方程式书写不正确的是( )A、过氧化钠放入水中: B、氯化铁溶液与铜反应: C、单质硫与铜反应: D、焦炭还原石英砂制粗硅:
-
4、实践是检验真理的唯一标准.下列实验操作或装置能达到目的的是( )
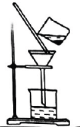
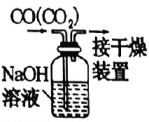
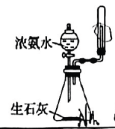
A.过滤
B.除去中的
C.制取并收集
D.实验室制取乙炔
A、A B、B C、C D、D -
5、化学处处呈现美.下列说法不正确的是( )A、漂亮的玛瑙是熔融态的快速冷却形成的 B、冰雪融化时需要破坏氢键和范德华力 C、乙烯分子呈现完美对称,呈正四面体形 D、云、雾、有色玻璃都属于胶体
-
6、生活处处皆化学.下列说法正确的是( )
A
B
C
D




节日燃放的焰火与电子跃迁有关
用于游泳池消毒的漂白粉的成分为
丹霞地貌的岩层因含而显红色
合金内原子层之间的相对滑动容易,故合金硬度比纯金属小
A、A B、B C、C D、D -
7、科技强国.下列说法不正确的是( )A、“北斗三号”导航卫星搭载铷原子钟,铷是碱金属元素 B、“弹性陶瓷塑料”具有很好的硬度和弹性,其中塑料的主要成分为有机物 C、量子计算机“悟空”即将面世,其传输信号的光纤主要成分为二氧化硅 D、的发现开启了碳纳米材料应用的新时代,属于混合型晶体
-
8、中华文化如长河,源远流长势不竭.下列国家级文物中,主要由硅酸盐材料制成的是( )



A.鎏金腰带
B.乘云绣绮
C.青瓷莲花尊
D.金漆木雕大神龛
A、A B、B C、C D、D -
9、某实验需要用1.0 mol·L-1 NaOH溶液450 mL。(1)、配制该溶液的实验操作步骤有:
a.在托盘天平上称量g NaOH固体放入烧杯中,加适量蒸馏水溶解,冷却至室温。
b.把烧杯中的溶液小心地注入中。
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用加蒸馏水至液面与刻度线相切。
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)、操作步骤的正确顺序为。(3)、该配制过程中两次用到玻璃棒,其作用分别是、。(4)、在进行b步操作时,不慎有液体溅出,下列处理措施正确的是____(填序号)。A、继续进行实验 B、添加部分NaOH溶液 C、倒掉溶液,重新配制 D、倒掉溶液,洗净容量瓶后重新配制(5)、现有硫酸和硫酸钠溶液200 mL,其中硫酸的浓度是1 mol·L-1 , 硫酸钠的浓度是0.5 mol·L-1。要使硫酸和硫酸钠的浓度分别为2 mol·L-1和0.2 mol·L-1 , 应加入98%的硫酸(密度为1.84 g·cm-3)的体积是 , 再加入水配制后溶液的体积是。 -
10、已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3(加热和夹持装置略去)。

回答下列问题:
(1)、装置A发生反应的化学方程式为 , 该反应氧化剂还原剂个数比 , 电子转移的总数为。(2)、装置D发生反应的化学方程式为。(3)、实验结束时,应先熄灭(填“A”或“D”)处酒精灯;E中冷水的作用是。(4)、装置F的作用是;装置G发生反应的离子方程式。 -
11、为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
 (1)、往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A , B。(2)、写出上述过程中有关反应的离子方程式:
(1)、往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A , B。(2)、写出上述过程中有关反应的离子方程式:Fe2O3→A;
A→B。
(3)、B→C可看到的现象是。(4)、将A的饱和溶液滴入沸水中并不断加热,可制得;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为。 -
12、(1)、等质量的CO和CO2 , 物质的量之比为;氧原子个数之比为(2)、1.5 mol H2SO4的质量是g,其中含有mol H(3)、9.03×1023个氨分子含mol NH3 , mol电子
-
13、25 ℃时,将10 mL质量分数为50%(密度为1.4 g·cm-3)的硫酸稀释成100 mL。下列说法正确的是 ( )A、仰视容量瓶刻度线定容,所配溶液的浓度偏大 B、上述稀释过程所需要的蒸馏水为90 mL C、质量分数为50%的硫酸溶液的物质的量浓度约为7.14 mol·L-1 D、上述10 mL稀硫酸中含溶质14 g
-
14、已知:①;
②;③。
根据上述反应,判断下列结论错误的是( )
A、溶液中可发生反应: B、氧化性强弱顺序为: C、在反应①③中均为氧化剂 D、反应①中,是的还原产物 -
15、设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )A、1 mol·L-1NaCl溶液中含有NA个Na+ B、18 g H2O中含有NA个H2、NA个O C、NA个 H2O分子在标准状况下的体积约为22.4 L D、2.3 gNa+中含有NA个电子
-
16、下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )A、加热时无气体放出 B、滴加盐酸时有气泡放出 C、溶于水后滴加BaCl2稀溶液有白色沉淀生成 D、溶于水后滴加澄清石灰水有白色沉淀生成
-
17、不能用于检验新制氯水和长期放置的氯水的试剂是( )A、干燥的有色布条 B、石蕊溶液 C、氯化亚铁溶液 D、硝酸银溶液
-
18、在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水中,石灰水变浑浊,由此判断该溶液中含有( )A、Cl-、SO42- B、Cl-、NO3- C、Cl-、CO32- D、Cl-、OH-
-
19、实验室需配制一种仅含五种离子的混合溶液,且在混合溶液中五种离子的物质的量浓度均为5 mol·L-1。下列四组离子能达到此实验目的的是( )A、Na+、K+、、、Cl- B、Ba2+、、、、Cl- C、Mg2+、K+、OH-、Cl-、 D、Al3+、Na+、Cl-、、
-
20、三个相同的恒温恒容密闭容器中分别盛有等质量的氢气、甲烷、氧气,下列说法正确的是( )A、三种气体的分子数目一定相等 B、三种气体物质的量之比为16∶2∶1 C、三种气体的密度之比为1∶2∶16 D、三种气体的压强一定相等