-
1、在银离子催化作用下,过二硫酸钠可将氧化为 , 反应的离子方程式为:。下列有关说法正确的是( )A、的酚酞溶液呈红色 B、中硫元素的化合价为+7价 C、反应中的氧化产物是 D、转移时可生成
-
2、海水提锂是一项具有巨大应用前景的技术。某电化学海水提锂的装置如图所示:

该装置工作步骤如下:
①打开电源b,海水中的嵌入电极形成;
②关闭电源b,打开电源a,同时向石墨电极通入空气(其中体积分数为20%),使中的脱出进入甲溶液。下列说法错误的是( )
A、步骤①中,电极应该与电源b的负极相连 B、步骤②中,电极应该与电源a的负极相连 C、步骤②中,阴极发生的电极反应为 D、每有进入甲溶液,理论上消耗标准状况下的空气28L -
3、科学家合成的某电子陶瓷材料有着广泛用途,其晶胞结构如图所示;该立方晶胞边长为apm,半径为bpm。设阿伏加德罗常数的值为 , 下列叙述错误的是( )
 A、晶体的化学式为 B、晶体中构成的多面体有12个面 C、半径为 D、晶体的密度为
A、晶体的化学式为 B、晶体中构成的多面体有12个面 C、半径为 D、晶体的密度为 -
4、了解分子结构有利于物质性质的学习。下列关于结构和性质的说法正确的是( )A、和的VSEPR模型均为四面体形 B、和HF很稳定均是因为分子间存在氢键 C、和均是键角为109°28'的正四面体形分子 D、HCOOH的酸性强于是因为烷基是推电子基团
-
5、下列实验操作正确的是( )




A.测定溶液的pH
B.实验室制取乙炔
C.制备氧化铝
D.实验室制取
A、A B、B C、C D、D -
6、由同周期元素X、Y、Z、W构成的离子导体阴离子结构如图。已知Y、W的核外电子总数分别是X的最外层电子数的2倍和3倍。下列说法正确的是( )
 A、第一电离能:X<Y<Z<W B、简单氢化物的稳定性:X>Y>Z>W C、X的最高价氧化物对应的水化物具有两性 D、化合物是由极性共价键形成的极性分子
A、第一电离能:X<Y<Z<W B、简单氢化物的稳定性:X>Y>Z>W C、X的最高价氧化物对应的水化物具有两性 D、化合物是由极性共价键形成的极性分子 -
7、下列离子方程式正确的是( )A、向溶液中滴加溶液: B、金溶于王水中: C、酸性环境下Cu发生腐蚀的正极反应式: D、酸性溶液氧化:
-
8、化学与生活密切相关。下列说法错误的是( )A、天然水中加入的明矾可作杀菌消毒剂 B、罐头中加入的维生素C可作抗氧化剂 C、食盐中加入的碘酸钾可作营养强化剂 D、面团中加入的小苏打可作食品膨松剂
-
9、某有机物是头痛药的主要成分,其结构简式如图所示。下列说法错误的是( )
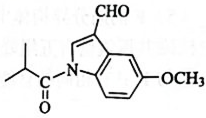 A、该物质的分子式为 B、该分子中碳原子的杂化方式有2种 C、利用溴水褪色实验可检验分子中含有不饱和碳碳双键 D、该分子完全氢化还原后的产物中含有5个手性碳原子
A、该物质的分子式为 B、该分子中碳原子的杂化方式有2种 C、利用溴水褪色实验可检验分子中含有不饱和碳碳双键 D、该分子完全氢化还原后的产物中含有5个手性碳原子 -
10、设为阿伏加德罗常数的值。下列说法正确的是( )A、晶体中化学键的数目为 B、1mol
 中含σ键的数目为
C、90g葡萄糖和醋酸的混合物中碳原子数目为
D、标况下与充分反应生成HClO的数目为
中含σ键的数目为
C、90g葡萄糖和醋酸的混合物中碳原子数目为
D、标况下与充分反应生成HClO的数目为
-
11、下列化学事实中没有体现“量变引起质变”的哲学观点的是( )A、向浓硫酸溶液中加入锌粉至过量,产生了二氧化硫和氢气 B、向苯酚钠溶液中通入二氧化碳气体至过量,产生白色沉淀 C、向淀粉碘化钾溶液中通入氯气至过量,溶液先变蓝后褪色 D、向硝酸银溶液中滴加氨水至过量,白色沉淀先产生后溶解
-
12、合金是生活中常用的材料之一。下列关于合金的叙述正确的是( )A、青铜是我国历史上使用最早的合金 B、铝合金是目前用量最大的合金材料 C、地铁列车中使用的不锈钢是一种常见的碳素钢 D、储氢合金与氢气结合成氢化物发生了物理变化
-
13、某小组学习了盐类水解,对溶液与溶液的反应产生了兴趣,进行如下探究。(1)、理论预测
甲同学认为两溶液的水解平衡相互促进并完全水解,实验中会观察到并闻到臭鸡蛋气味;
乙同学认为会发生氧化还原反应,并预测了还原产物为(填化学式)。
(2)、实验探究实验操作
实验现象
向稀的溶液中逐滴加入稀溶液,直至过量
立即产生黑色沉淀并逐渐增加,溶液过量后黑色沉淀部分溶解,观察到黄褐色浑浊
已知。
①实验中生成黑色沉淀的反应类型是;溶解生成的黄色固体为 .
②实验中首先观察到黑色沉淀出现,可能的原因是;溶液滴加至一定量时,溶解的原因是 .
③针对实验过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据数据分析,认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出沉淀转化的离子方程式 .
④丙同学设计实验证明③中乙同学的猜想,方案是:向洁净试管中加入新制并洗净的沉淀,若(填实验操作及现象)则证明猜想正确。
-
14、金属铟()广泛应用于生产液晶显示器和平板屏幕,以闪锌矿(主要成分是 , 还有等元素)为原料生产并提取钢,工艺流程如图所示。回答下列问题:

已知:i.常温下数据如下:
物质
ii.难溶于水,不溶于稀酸。
(1)、第二电离能(填“>”或“<”),理由是 .(2)、“焙烧”时产生难溶于的和 , 其中中的化合价为 , 同时生成的主要气体是(填化学式)。(3)、上清液中钴以存在,“除钴”时作(填“氧化剂”或“还原剂”);“脱氯”时发生反应 , 脱氯率与时间关系如下图所示,最适宜的反应时间为 . (4)、写出酸性条件下还原得到和的离子方程式;要水解得到 , 需先将和中的“还原”为价,原因是 .(5)、上述流程可循环利用的物质除了之外还有 .
(4)、写出酸性条件下还原得到和的离子方程式;要水解得到 , 需先将和中的“还原”为价,原因是 .(5)、上述流程可循环利用的物质除了之外还有 . -
15、氢气可作为火箭推进剂的理想清洁燃料。目前工业上广泛应用天然气重整制氢。回答下列问题:(1)、天然气工业制氢主要涉及如下反应:
主反应:
副反应:
b.
①副反应的;
②某温度下,向恒容密闭容器中通入等物质的量的和混合气体,初始压强为 , 经过达到平衡,此时体系内得压强为。忽略副反应,内的平均反应速率为;该温度下,反应的平衡常数(用气体分压代替浓度计算,分压总压物质的量分数)。
③考虑副反应,研究不同入口碳烷比对氢气产率的影响如图,解释入口碳烷比大于1时,氢气产率降低的可能原因是 .
 (2)、某文献报道,可在电解甲烷制氢,原理如下图所示。其中熔融电解质可传导和电极为极(填“阴”或“阳”),电极反应式为。
(2)、某文献报道,可在电解甲烷制氢,原理如下图所示。其中熔融电解质可传导和电极为极(填“阴”或“阳”),电极反应式为。 (3)、火箭推进器中氢气燃烧的机理如下图,链式反应共4步。从键能角度分析,“链引发”是断键而不是断键的原因是;“链传递”分两步完成,第一步的反应方程式为 .
(3)、火箭推进器中氢气燃烧的机理如下图,链式反应共4步。从键能角度分析,“链引发”是断键而不是断键的原因是;“链传递”分两步完成,第一步的反应方程式为 .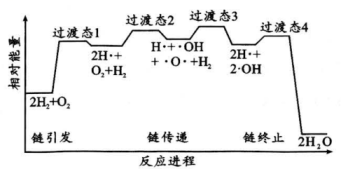
-
16、葡萄酒的主要成分有水、乙醇、有机酸等,是葡萄酒中常见的一种添加剂。实验小组对某葡萄酒开展探究,回答下列问题:(1)、元素在周期表中的位置是 .(2)、用氧化法滴定葡萄酒中总含量,装置如下图。取葡萄酒于烧瓶中,加热蒸出并用过量溶液吸收,除去过量后,加入几滴酚酞,用标准溶液滴定,消耗标准溶液。

①与溶液反应生成硫酸的离子方程式为;
②冷凝装置的作用是使有机酸回流,目的是;装置右侧接真空泵的作用是;
③滴定至接近终点时,控制标准溶液半滴滴入的操作是 , 使这半滴液体流入锥形瓶,必要时使用洗瓶冲洗;滴定终点时的现象为;
④计算该品牌葡萄酒中含量为。
-
17、常温下,向蒸馏水中加入碳酸钙粉末,测得电导率变化如下图,并于时刻再加入一定体积蒸馏水,体系一直保持浑浊。下列说法错误的是( )
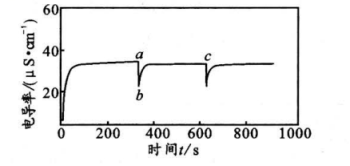 A、100~200s时间内,电导率不变,说明碳酸钙达到溶解平衡状态 B、加水后电导率变小,此时为不饱和溶液 C、点之后电导率增加,说明碳酸钙溶解度增大 D、忽略碳酸钙溶解时的热效应,整个实验过程中,保持不变
A、100~200s时间内,电导率不变,说明碳酸钙达到溶解平衡状态 B、加水后电导率变小,此时为不饱和溶液 C、点之后电导率增加,说明碳酸钙溶解度增大 D、忽略碳酸钙溶解时的热效应,整个实验过程中,保持不变 -
18、为研究沉淀的转化,某小组向悬浊液中滴加溶液,振荡后再滴加几滴溶液。下列说法错误的是( )
 A、实验中要注意所用试剂的浓度和用量 B、步骤①观察到有黄色沉淀即可停止滴加溶液 C、步骤②中的转化为 D、实验设计原理是
A、实验中要注意所用试剂的浓度和用量 B、步骤①观察到有黄色沉淀即可停止滴加溶液 C、步骤②中的转化为 D、实验设计原理是 -
19、某小组制作简单燃料电池,设计装置如下图所示。石墨棒经烘干活化处理,形管中注入滴有滴酚酞溶液的溶液。实验时,先打开、闭合 , 电解后,再打开 , 闭合 , 电流计指针偏转。下列叙述正确的是( )
 A、石墨棒除作为电极材料外,还可吸附和 B、电解过程中,左侧石墨棒附近溶液变为红色 C、打开 , 闭合后,右侧石墨棒发生反应: D、不考虑两极气体的逸出,电解所消耗的电能等于燃料电池产生的电能
A、石墨棒除作为电极材料外,还可吸附和 B、电解过程中,左侧石墨棒附近溶液变为红色 C、打开 , 闭合后,右侧石墨棒发生反应: D、不考虑两极气体的逸出,电解所消耗的电能等于燃料电池产生的电能 -
20、常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、在加入铝粉能产生的溶液中: B、含有大量的溶液中: C、水电离出来的的溶液: D、的混合液: