-
1、下图所涉及的物质均为中学化学中的常见物质,其中B为淡黄色固体,A为人类使用量最大的一种主族金属,P为含元素A的共价化合物,N为红褐色固体,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
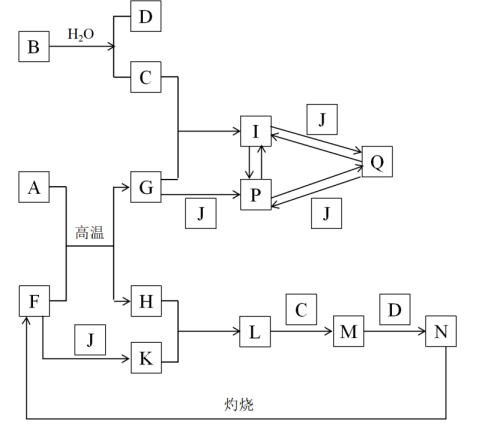 (1)、F的化学式为 , G的一种用途为。(2)、A与F在高温下反应生成G和H的方程式为。(3)、向L中滴加C的实验现象为。(4)、I与J反应转化为Q的离子方程式为 , 向P的溶液中加入过量氨水的离子方程式为。(5)、将A和F的混合物共10.7g进行如下操作。操作一:溶于500mL过量稀HNO3 , 产生标况下2.24LNO;操作二:操作一所得溶液加入2mol/LNaOH溶液500mL,恰好使沉淀质量达到最大(反应过程中溶液体积变化忽略不计)。①c(HNO3) = ;②操作一中反应后溶液c(H+)= 。
(1)、F的化学式为 , G的一种用途为。(2)、A与F在高温下反应生成G和H的方程式为。(3)、向L中滴加C的实验现象为。(4)、I与J反应转化为Q的离子方程式为 , 向P的溶液中加入过量氨水的离子方程式为。(5)、将A和F的混合物共10.7g进行如下操作。操作一:溶于500mL过量稀HNO3 , 产生标况下2.24LNO;操作二:操作一所得溶液加入2mol/LNaOH溶液500mL,恰好使沉淀质量达到最大(反应过程中溶液体积变化忽略不计)。①c(HNO3) = ;②操作一中反应后溶液c(H+)= 。 -
2、随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
 (1)、元素x在元素周期表中的位置是。(2)、元素x、z可形成含18电子的分子甲,其结构式为。在微电子工业中,可以用yx3的水溶液消除蚀刻剂中的分子甲,所得产物不污染环境,其化学方程式是。(3)、x分别与y、z、d形成的化合物中,沸点最高的物质是(填化学式)(4)、元素d、e、g、h形成的简单离子,半径由大到小为 (填离子符号)。(5)、这几种元素的最高价氧化物的水化物的酸性最强的是(填化学式)。(6)、元素e、f的最高价氧化物的水化物之间发生反应的离子方程式为。(7)、用电子式表示化合物ex的形成过程。
(1)、元素x在元素周期表中的位置是。(2)、元素x、z可形成含18电子的分子甲,其结构式为。在微电子工业中,可以用yx3的水溶液消除蚀刻剂中的分子甲,所得产物不污染环境,其化学方程式是。(3)、x分别与y、z、d形成的化合物中,沸点最高的物质是(填化学式)(4)、元素d、e、g、h形成的简单离子,半径由大到小为 (填离子符号)。(5)、这几种元素的最高价氧化物的水化物的酸性最强的是(填化学式)。(6)、元素e、f的最高价氧化物的水化物之间发生反应的离子方程式为。(7)、用电子式表示化合物ex的形成过程。 -
3、将一定量的Cl2通入一定浓度的KOH溶液中,二者恰好完全反应(已知该反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。下列说法错误的是( )
 A、反应中转移电子的物质的量为0.21mol B、的生成是温度升高而引起的 C、该KOH溶液中KOH的质量为5.04g D、整个反应过程中,被氧化和被还原的氯元素的质量之比为3:7
A、反应中转移电子的物质的量为0.21mol B、的生成是温度升高而引起的 C、该KOH溶液中KOH的质量为5.04g D、整个反应过程中,被氧化和被还原的氯元素的质量之比为3:7 -
4、下列选项描述与对应图像相符的是( )
 A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-
A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl- -
5、下列离子方程式的书写错误的是( )A、将投入到溶液中,有刺激性气味气体放出: B、和稀的反应:2Na2O2 + 4H+ = 4Na+ + O2↑+2H2O C、向NaHSO4溶液中滴加Ba(OH)2溶液至恰好沉淀完全:
H+ + OH- + SO42- + Ba2+ = BaSO4↓+ H2O
D、向漂白液中通入少量CO2:2ClO- + CO2 + H2O = CO32- + 2HClO -
6、科学家利用原子序数依次递增的短周期主族元素W、X、Y、Z组合成一种“超分子”,具有高效的催化性能,其结构如图所示。W、X、Z分别位于不同周期,Z的金属性在同周期元素中最强。下列说法错误的是( )
 A、向固体中加入少量水,会观察到固体溶解 B、Z和在不同条件下发生反应产物不同 C、L与Y同主族,并且位于Y的下一周期,则L与Z可以形成化合物 D、ZW与溶液反应的现象是生成白色沉淀并且有气泡产生
A、向固体中加入少量水,会观察到固体溶解 B、Z和在不同条件下发生反应产物不同 C、L与Y同主族,并且位于Y的下一周期,则L与Z可以形成化合物 D、ZW与溶液反应的现象是生成白色沉淀并且有气泡产生 -
7、我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献.下图为联合制碱法的主要过程(部分物质已略去)。下列说法不正确的是( )
 A、沉淀池中有析出,因为一定条件下的溶解度较小 B、滤液中主要含有、和 C、设计循环的目的是提高原料的利用率 D、某纯碱样品中含杂质 , 取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则样品中的质量分数为106(b-a)/a
A、沉淀池中有析出,因为一定条件下的溶解度较小 B、滤液中主要含有、和 C、设计循环的目的是提高原料的利用率 D、某纯碱样品中含杂质 , 取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则样品中的质量分数为106(b-a)/a -
8、下列实验操作、现象和结论均正确,且存在因果关系的是( )
选项
实验操作
现象
结论
A
将一个干燥的坩埚加热,切取一块绿豆大的钠,迅速投入热坩埚中,待熔化后撤掉酒精灯
剧烈反应,发出黄色火焰,生成淡黄色固体
钠与氧气在加热条件下生成过氧化钠
B
在某未知溶液中加入几滴酸性溶液
溶液的紫红色褪去
未知溶液一定含有
C
将有色的鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片
有色的鲜花不褪色
干燥的氯气没有漂白性
D
将饱和FeCl3溶液滴入煮沸的NaOH溶液中,用光束照射所得液体
生成红褐色透明液体,用光束照射可见一条光亮的通路
生成Fe(OH)3胶体有丁达尔效应
A、A B、B C、C D、D -
9、下列说法错误的有几项:( )
①钠着火用干沙土扑灭;
②明矾可用于水的净化和消毒;
③可用铁制容器盛放和运输浓硫酸;
④青铜、不锈钢、硬铝都是合金;
⑤打磨过的铝片加热熔化时会滴落,未打磨的铝片则不会滴落;
⑥用作呼吸面具的供氧剂;
⑦氧化铁常用来制造涂料;
⑧灼烧某待测液,焰色反应为黄色,则待测液中一定不含钾离子;
⑨用电子式表示的形成过程:
 ;A、3项 B、4项 C、5项 D、6项
;A、3项 B、4项 C、5项 D、6项 -
10、某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第1周期除外),每个“·”代表一种元素,“∙∙∙∙∙∙”相连代表同族元素。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子总数比最内层电子总数多一个,下列说法正确的是( )
 A、原子序数由大到小:X>Y>Z B、Z与M形成的化合物,各原子均满足8电子稳定结构 C、X、Y、Z最高价氧化物的水化物之间均能两两反应 D、X、R形成的两种常见化合物阴、阳离子个数比分别为1∶1、1∶2
A、原子序数由大到小:X>Y>Z B、Z与M形成的化合物,各原子均满足8电子稳定结构 C、X、Y、Z最高价氧化物的水化物之间均能两两反应 D、X、R形成的两种常见化合物阴、阳离子个数比分别为1∶1、1∶2 -
11、南京大学科研团队首次发现氨还原过程中的多米诺效应:即一旦完成第①步,将自发完成后续步骤,反应过程示意图如下。表示阿伏加德罗常数的值,下列说法正确的是( )
 A、含有个价电子 B、中含有个共价键 C、若参与第②步反应转移电子数为 D、该过程中Li作催化剂
A、含有个价电子 B、中含有个共价键 C、若参与第②步反应转移电子数为 D、该过程中Li作催化剂 -
12、下列化学用语正确的是( )A、的结构式:N≡N B、的电离方程式: C、中子数为10的氧原子: D、氯化氢的形成过程可表示为:

-
13、化学与社会、生活、科技密切相关。下列说法正确的是( )A、“人造太阳”的核燃料是氘、氚,、均为氢元素,其物理性质和化学性质均相同 B、我国已经实施在某些酱油中加入铁强化剂的措施,以减少缺铁性贫血问题的发生 C、近年的材料新宠黑磷(仅由P构成),它与白磷互为同位素 D、铝制餐具表面有一层致密的氧化膜保护,所以可以用来长时间存放酸性或碱性食物
-
14、甲烷水蒸气重整反应是制备甲醇的重要方法之一。传统的方式是在高温、高压条件下进行生产,有操作成本高、设备投资高等缺点。(1)、反应在加热炉中进行,通过冷凝将气体产物和液体产物进行分离,得到的气体产物为CO、、 , 液体产物为。若已知C-H键、C-O键、O-H键、C-C键、H-H键的键能,则下列反应中可以计算反应热的有(填反应序号)。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
(2)、利用等离子体催化,可在温和条件下制备甲醇。下列关于等离子体的叙述中,错误的有(填标号)。a.等离子体是带电的物质聚集体
b.等离子体是熔点低的离子化合物
c.等离子体是一种不同于固态、液态、气态的物质聚集状态
d.等离子体具有丰富的高能电子,可将不活泼的原料分子活化
(3)、在15W放电功率和14kHz放电频率条件下,将、、Ar以1:4:2的比例投入反应区,反应区温度对转化率和产物选择性的影响如图所示:【产物A的选择性】

①在130℃到200℃的温度范围内,随着反应区温度的升高,选择性先升高后降低的产物是(填化学式)。
②在170℃、250℃、300℃的条件下,生成的量最多的温度为 , 若此时投入 , 生成的的物质的量为。
③170℃时,反应Ⅰ的平衡常数(以分压表示,分压=总压×物质的量分数,列出计算式即可)。
(4)、在反应温度为170℃的条件下,不改变其他条件,投料比逐渐降低时,的转化率不断下降,原因是。 -
15、过氧化钙()可用于地表水质改善、医用应急供氧等;过氧化钙难溶于水(在水中以形式存在),不溶于乙醇,可溶于酸。实验室用30%溶液与溶液在碱性条件下制取过氧化钙,并测定过氧化钙的产率(装置如图所示,夹持类装置未画出)。

回答下列问题:
(1)、的电子式为。(2)、实验时,向C中的溶液中滴入A中足量的30%溶液,打开 , 调整三通阀,并不断向C中通入氨气,发生反应的化学方程式为 , 反应时仪器C的温度不宜过高的原因有、。(3)、仪器B的作用为。实验结束后,将C中所得产品取出,过滤,乙醇洗涤,干燥备用。(4)、将上述A、B、C装置清洗干净,重新组装,并做适当调整用于过氧化钙产率的测定,调整方法为。将产品溶于适量盐酸溶液后置于C中,溶液置于A中,将三通阀的旋塞调于 位,调整水准管液面使之与集气管液面相平,记录集气管液面刻度后,(填操作方法)。将产品溶于盐酸而不是硫酸的原因为。 (5)、按上述操作进行实验,一段时间后,当集气管液面保持稳定时,调整水准管与集气管液面相平,记录集气管刻度,测得集气管液面前后相差31.36mL(折合成标准状况下),则的产率为(保留两位小数)。
位,调整水准管液面使之与集气管液面相平,记录集气管液面刻度后,(填操作方法)。将产品溶于盐酸而不是硫酸的原因为。 (5)、按上述操作进行实验,一段时间后,当集气管液面保持稳定时,调整水准管与集气管液面相平,记录集气管刻度,测得集气管液面前后相差31.36mL(折合成标准状况下),则的产率为(保留两位小数)。 -
16、苯并卟啉是有机合成中的一种重要结构,可以通过吡咯衍生物制备。吡咯衍生物F的合成路线如下(Ph为苯基):

回答下列问题:
(1)、有机物A的名称为。(2)、A→B的化学方程式为。(3)、B→C的反应类型为。(4)、D的结构简式为;下列说法正确的有(填标号)。a.C和D之间存在构造异构现象 b.C和D的化学性质完全相同
c.C和D之间存在立体异构现象 d.C和D的物理性质有一定的差异
(5)、F的同分异构体中能同时满足以下三个条件的有种(不考虑立体异构),其中核磁共振氢谱有五组峰,且峰面积之比为4:2:2:2:1的结构简式为。①与F具有相同的官能团;②苯环上有三个取代基;③N原子上无不饱和键。
-
17、镍元素作为人体必需的微量元素之一,具有促进红细胞再生、维持大分子结构和膜结构稳定等重要作用。通过对硫酸镍粗产品(主要成分为 , 含As、Fe、Pb、Cd、Hg等元素)的提纯可制得食品级硫酸镍,其工艺路线如下:
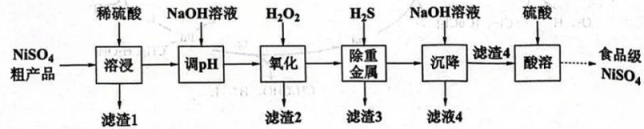
常温下,某些物质的相关常数数据见下表:
回答下列问题:
(1)、Fe的价层电子的空间运动状态有种。(2)、已知粗品中As元素含量较Fe、Pb元素高,且以的形式存在,则“氧化”除去铅的离子方程式为 , 优先除去的金属元素为(填Ni、Fe或Pb)。(3)、硫化法“除重金属”需严格控制溶液的pH,若要使滤液中的浓度小于 , 需控制溶液pH不小于(保留一位小数)。但在实际反应时为了提高产量,要将溶液pH调为4.5左右,其原因是。(已知常温下饱和溶液的浓度为0.1mol/L)(4)、检验“滤渣4”是否洗涤干净的操作是。(5)、“离子极化”是指正负离子的电子云受到对方电场的影响而导致形变的现象。化合物中正离子电荷越高、离子半径越小,极化作用越大,则化学键中离子键成分的百分数越小。化合物和的性质比较中,正确的是(填标号)。a.熔点: b.密度: c.溶解度:
-
18、常温下,向20.00mL0.100mol/L的乙二酸()溶液中滴加同浓度的NaOH溶液,过程中lgX(X为或)、V(NaOH)与pH的变化关系如图所示。下列说法错误的是( )
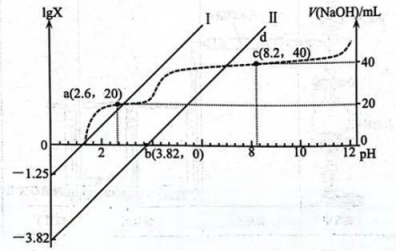 A、直线Ⅰ中X表示 B、乙二酸的 C、c点溶液中 D、pH=7时,
A、直线Ⅰ中X表示 B、乙二酸的 C、c点溶液中 D、pH=7时, -
19、Wacker法主要用于乙烯制取乙醛,其催化循环过程如图所示。下列说法错误的是( )
 A、微粒
A、微粒 中乙烯提供π电子与形成配位键
B、若反应物换为丙烯,可能制得两种官能团不同的有机物
C、乙醛制取过程中、、均是催化剂
D、反应③的离D子方程式为
中乙烯提供π电子与形成配位键
B、若反应物换为丙烯,可能制得两种官能团不同的有机物
C、乙醛制取过程中、、均是催化剂
D、反应③的离D子方程式为
-
20、为了探究浓硫酸与木炭粉在加热条件下的反应产物,某同学设计了如图所示的实验装置。下列说法正确的是( )
 A、装置甲中浓硫酸的作用是强氧化性和酸性 B、装置乙固体变蓝不能说明反应中有水生成 C、装置丙的作用是检验并除净二氧化硫气体 D、装置丁的作用是吸收尾气以防止空气污染
A、装置甲中浓硫酸的作用是强氧化性和酸性 B、装置乙固体变蓝不能说明反应中有水生成 C、装置丙的作用是检验并除净二氧化硫气体 D、装置丁的作用是吸收尾气以防止空气污染