-
1、中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )A、In是第五周期第ⅢA族元素 B、11549In的中子数与电子数的差值为17 C、原子半径:In>Al D、碱性:In(OH)3>RbOH
-
2、以Fe粉、稀硫酸、溶液为原料,用如图所示装置制备能较长时间保存的 , 下列说法正确的是( )
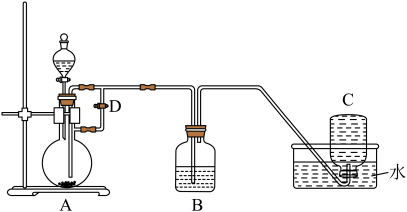 A、反应前圆底烧瓶中放入铁粉,分液漏斗中装入溶液 B、生成在装置A中 C、实验开始前,应先关闭止水夹D D、若铁粉中含有少量 , 不影响本实验
A、反应前圆底烧瓶中放入铁粉,分液漏斗中装入溶液 B、生成在装置A中 C、实验开始前,应先关闭止水夹D D、若铁粉中含有少量 , 不影响本实验 -
3、下列有关钠的化合物说法不正确的是( )A、完全与反应生成产物,失去电子数约为 B、将澄清石灰水分别加入溶液和溶液中,前者不生成沉淀 C、与水的反应中,每生成氧气转移电子 D、固体中含少量 , 可用加热法除去
-
4、下列说法不正确的是( )A、等质量的CO和原子数之比为 B、常温常压下,物质的量为 C、同温同压下,和的密度之比为 D、的溶液中含氧原子的个数约为
-
5、关于下列物质说法正确的是( )
①氨水;②熔融;③固体;④固体;⑤铜;⑥蔗糖
A、能导电的有①②③④⑤ B、不能导电的有③④⑥ C、属于电解质的有①②③④ D、属于非电解质的有⑤⑥ -
6、在一定条件下采用如下装置用铁粉和水蒸气反应,可以得到铁的氧化物,进一步还原可以得到超细铁粉(加热和夹持装置已略去)。装置如图,下列说法正确的是( )
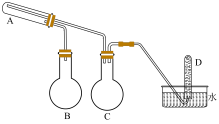 A、装置C的作用是提供水蒸气 B、装置A中发生反应: C、收集到气体时(标况下),则A中固体增重 D、可以用磁铁检验该反应是否完全
A、装置C的作用是提供水蒸气 B、装置A中发生反应: C、收集到气体时(标况下),则A中固体增重 D、可以用磁铁检验该反应是否完全 -
7、下列实验仪器或药品配置合理,并且能达到相对应选项中实验目的是( )
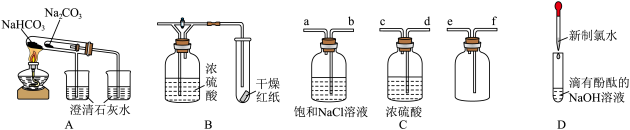 A、验证热稳定性 B、验证潮湿氯气与干燥氯气的漂白性 C、净化并收集干燥氯气的装置连接顺序为dcbafe D、滴有酚酞的溶液红色褪去,证明氯水中有酸
A、验证热稳定性 B、验证潮湿氯气与干燥氯气的漂白性 C、净化并收集干燥氯气的装置连接顺序为dcbafe D、滴有酚酞的溶液红色褪去,证明氯水中有酸 -
8、下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛NaOH溶液的洗气瓶,
再通过盛有浓硫酸的洗气瓶
④
NaNO3固体
CaCO3
溶解、过滤、蒸发
A、①②③④ B、①③④ C、①②③ D、②③④ -
9、下列离子方程式正确的是( )A、澄清石灰水中通入过量: B、氧化: C、将通入溶液中: D、氢氧化钡溶液与稀硫酸反应:
-
10、下列有关铁的说法中正确的是( )A、铁与硫粉反应的产物是 B、铁和稀硫酸反应的离子方程式为 C、铁在纯氧中燃烧生成 D、常温下,Fe与浓硫酸不发生化学反应
-
11、下列反应中,调节反应条件(温度、反应物用量比)后反应产物不会改变的是( )A、钠与氧气 B、铁与氯气 C、镁粉和氯化铁 D、二氧化碳与氢氧化钠溶液
-
12、下列微粒所含有的质子和电子总数都约为的是( )A、 B、 C、 D、NO
-
13、氧化还原反应的实质是( )A、化合价的升降 B、分子中各原子重新组合 C、电子的得失或偏移 D、氧原子的得失
-
14、下列技术应用中,其工作原理不涉及化学反应的是( )




A.火药使用
B.用和合成
C.转轮排字
D.用氧化铁冶炼铁
A、A B、B C、C D、D -
15、某实验小组探究Cu与Fe(NO3)3溶液的反应。取3 g 铜粉加入到100 mL 0.6 mol/L Fe(NO3)3溶液(用HNO3调pH=1)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。(1)、预测NO3-和Fe3+分别与Cu发生了反应,补充反应Ⅱ的离子方程式。
反应 Ⅰ 3Cu + 2NO + 8H+ = 3Cu2+ + 2NO↑ + 4H2O
反应 Ⅱ 。
(2)、探究反应Ⅰ是否发生①设计实验:取3 g 铜粉加入到100 mL 溶液中,振荡、静置30分钟。
②若反应 Ⅰ能够发生,预计观察到的现象有。
实际现象不明显,借助传感器证明反应Ⅰ能够发生。
(3)、探究反应Ⅱ是否发生步骤1:取3 g 铜粉加入到100 mL 0.3 mol/L Fe2(SO4)3溶液(用H2SO4调pH=1)中,溶液迅速变为蓝绿色。
步骤2:取步骤1中上层清液,滴加少量KSCN溶液,出现白色浑浊,溶液变红,振荡后红色褪去。
①KSCN溶液的作用是 。
②已知,CuSCN是难溶于水的白色固体。结合平衡移动原理,解释步骤2中“溶液变红,振荡后红色褪去”的原因。
(4)、查阅资料可知,反应 Ⅰ和反应Ⅱ 的平衡常数分别为KⅠ=6.3×1062 和KⅡ=5×1014。请从化学反应速率和限度的角度简述对Cu与Fe(NO3)3溶液反应的认识。 -
16、我国科学家用粗氢氧化高钴[主要含Co(OH)3]制备硫酸钴晶体(CoSO4•7H2O),其工艺流程如下。

已知:i.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
ii.部分物质的溶度积常数如下(25℃)
物质
Ksp
CaF2
4.0×10−11
Fe(OH)3
2.8×10−39
iii.CoSO4•7H2O溶解度随温度升高而明显增大
(1)、氢氧化高钴溶于硫酸的化学方程式是。(2)、还原浸出Co2+时,理论上氧化性离子和还原性离子物质的量之比为。(3)、氧化沉铁后,浊液中铁离子浓度为 mol/L(此时25℃,溶液pH为4)。(4)、结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因。(5)、萃取后,经反萃取得到硫酸钴溶液。将硫酸钴溶液经操作,分离后得到硫酸钴晶体。(6)、用滴定法测定硫酸钴晶体中钴的含量,其原理和操作如下。在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2+ + [Fe(CN)6]3− = Co3+ + [Fe(CN)6]4−。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取m g硫酸钴晶体,加水配成200 mL溶液,取20 mL待测液进行滴定,消耗V1 mL铁氰化钾标准液、V2 mL Co(Ⅱ)标准液。(Co的相对原子质量为59)
计算样品中钴含量ω=(以钴的质量分数ω计)。
-
17、改进工艺,降低能耗是氯碱工业发展的重要方向。(1)、写出氯碱工业原理的方程式。(2)、将氢燃料电站应用于氯碱工业,其示意图如下:

① a极为(填“正”或“负”)极。
② 甲装置中,Na+向极移动(填“a”或“b”)
③下列关于乙装置说法中,正确的是。
A.在c极区获得氯气
B.在d极区获得的产物,可供甲装置使用
C.当NaCl溶液浓度较低时,及时更换为精制饱和NaCl溶液,以保证生产效率
(3)、向乙装置中的阴极区通入O2 , 能够替代水中的H+获得电子,降低电解电压,减少电耗。写出O2在阴极区发生反应的电极反应式。(4)、杂质离子可造成交换膜损伤,导致OH−迁移至阳极区,对产品质量造成不良影响。请结合化学用语说明原因。 -
18、镁基储氢材料MgH2具有储氢量高、成本低廉等优点,发展前景广阔。
Ⅰ.MgH2热分解放出H2 , 反应的能量变化如图所示。
 (1)、写出MgH2热分解的热化学方程式。(2)、提高H2平衡产率的措施有(答1条即可)。(3)、Ⅱ.MgH2水解制备H2
(1)、写出MgH2热分解的热化学方程式。(2)、提高H2平衡产率的措施有(答1条即可)。(3)、Ⅱ.MgH2水解制备H2MgH2与H2O反应制备H2的化学方程式是。
(4)、资料:25℃时,有关物质的溶度积常数如下物质
Mg(OH)2
Ni(OH)2
Cu(OH)2
Ksp
5.6×10−12
5.5×10−16
2.2×10−20
①MgH2与H2O反应时,最初生成H2的速率很快,但随后变得缓慢,原因是。
②在水中加入优先与OH-结合的离子,能够避免①中现象发生,提升H2的制备效率。下列物质中,能达到此目的的是。
a.NaNO3 b.NiCl2 c.CuCl2
-
19、研究电解质在水溶液中的离子反应与平衡有重要的意义。(1)、常温下,用0.100 mol/L NaOH溶液滴定10 mL 0.100 mol/L CH3COOH溶液的滴定曲线如右图所示。a、b、c三点中:

①c(Na+) =c(CH3COO−)的点是.(填“a”、“b”或“c”,下同)。
②水的电离程度最大的点是 。
(2)、已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:化学式
CH3COOH
H2CO3
HClO
电离平衡常数
(Ka)
1.75×10–5
Ka1=4.5×10–7
Ka2=4.7×10–11
4.0×10–8
①CH3COOH的电离平衡常数表达式Ka=。
②比较等物质的量浓度溶液的pH:pH(NaClO) pH(CH3COONa) (填“>”、“<”或“=”)。
③预测下列化学反应能够发生的是。
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2
-
20、锂(Li)元素在新能源领域应用广泛。(1)、基态Li原子的电子排布式是 。(2)、Li元素在周期表中的位置是(填写周期、族、区)。(3)、比较第一电离能的大到小:I1(Li) I1(Na)(填“>”、“=”或“<”),从原子结构的角度解释原因。(4)、碳酸锂(Li2CO3)是一种电池原料,其中所含元素的电负性从大到小的顺序是>>。