-
1、气体微溶于水,有强还原性,可由反应制得。实验室制取少量的原理及装置均正确的是( )
 A、制取 B、干燥 C、收集 D、吸收尾气中的
A、制取 B、干燥 C、收集 D、吸收尾气中的 -
2、反应可用于制备。下列说法正确的是( )A、中子数为37的锌原子: B、中硫元素的化合价: C、的结构示意图:
 D、的电子式:
D、的电子式:
-
3、近日,科学家研制出了由石墨烯(结构模型如图所示)材料制成的功能性半导体。这主要是利用了石墨烯的( )
 A、导电性 B、导热性 C、高熔点 D、高沸点
A、导电性 B、导热性 C、高熔点 D、高沸点 -
4、阿斯巴甜(G)是一种广泛应用于食品工业的添加剂,一种合成阿斯巴甜(G)的路线如下:

已知如下信息:
①


②


回答下列问题:
(1)、A中官能团的名称是。(2)、A生成B反应的化学方程式为。(3)、D的结构简式为 , D生成E的反应中浓硫酸的作用是。(4)、E生成G的反应类型为。(5)、写出能同时满足下列条件的C的同分异构体的结构简式。①分子中含有苯环,且苯环上有两个取代基
②能与FeCl3溶液发生显色反应
③能在氢氧化钠溶液中发生水解反应,且含有苯环的水解产物的核磁共振氢谱只有一组峰
(6)、参照上述合成路线,设计以乙醛为起始原料制备聚丙氨酸的合成路线(无机试剂任选)。 -
5、近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。(1)、I.工业上在Cu -ZnO催化下利用CO2发生如下反应①来生产甲醇,同时伴有反应②发生。
①CO2(g) +3H2(g) ⇌ CH3OH(g)+ H2O(g) ΔH1
②CO2(g)+ H2(g) ⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
已知:CO(g)+2H2(g) ⇌ CH3OH(g) ΔH = -90.6kJ·mol-1 , 则△H1= 。(2)、向密闭容器中加入CO2(g)和H2(g),合成CH3OH(g)。已知反应①的正反应速率可表示为v正=k正·c(CO2)·c3(H2),逆反应速率可表示为v逆=k逆·c(CH3OH)·c(H2O),其中k正、k逆为速率常数。如图中能够代表k逆的曲线为 (填“L1”“L2”“L3”或“L4”)。 (3)、不同条件下,按照n(CO2) : n(H2)=1 : 3投料,CO2的平衡转化率如图所示。
(3)、不同条件下,按照n(CO2) : n(H2)=1 : 3投料,CO2的平衡转化率如图所示。
①压强p1、p2、p3由大到小的顺序是。压强为p1 时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大的原因是。
②图中点M(500,60),此时压强p1为0.1 MPa,CH3OH的选择性为(选择性:转化的CO2中生成CH3OH占整个转化的CO2的百分比)。则该温度时反应①的平衡常数Kp=(MPa)-2(分压=总压×物质的量分数)。
(4)、II.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应为 , 该装置中使用的是(填“阴”或“阳”)离子交换膜。
-
6、锗是重要的半导体材料,是一种“稀散金属”,如图是以中和渣(主要成分为GeO2、Fe2O3、ZnO、SiO2、CaSO4等)为原料生产二氧化锗的工艺流程:

已知:
①GeCl4的沸点:83℃,FeCl3的沸点:315℃。
②H2GeO3在高酸度时易聚合形成胶状多聚锗酸。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表(离子浓度低于10-5 mol·L-1视为沉淀完全)。
离子
Fe3+
Zn2+
开始沉淀pH
2.2
6.2
完全沉淀pH
3.2
8.2
回答下列问题:
(1)、①“酸浸”时加热的目的是 , 浸渣的主要成分是。②测得相同时间内锗的浸出率与硫酸的物质的量浓度(mol·L-1)的关系如图所示。硫酸浓度过高,浸出率反而降低的原因是。
 (2)、常温下,若“沉锗”时用饱和NaOH溶液调pH=3.0,此时滤液中-lgc(Fe3+)为。(3)、“残余液”的溶质主要成分为 (填化学式)。(4)、“中和水解”的化学反应方程式为。(5)、纯度测定
(2)、常温下,若“沉锗”时用饱和NaOH溶液调pH=3.0,此时滤液中-lgc(Fe3+)为。(3)、“残余液”的溶质主要成分为 (填化学式)。(4)、“中和水解”的化学反应方程式为。(5)、纯度测定称取m g GeO2样品,在加热条件下溶解,用NaH2PO2将其还原为Ge2+ , 用c mol·L-1 KIO3标准溶液滴定,消耗KIO3标准溶液的平均体积为V mL,需选用的指示剂为 , 样品纯度为%。(实验条件下,NaH2PO2未被KIO3氧化)[已知:+H+Ge4++I-+H2O(未配平);]。
-
7、己二酸[HOOC(CH2)4COOH]是一种重要的工业原料,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。实验室以环己醇(
 )为原料制取己二酸实验流程如图:
)为原料制取己二酸实验流程如图:
已知:“氧化”过程发生的主要反应为:
 KOOC(CH2)4 COOK △H<0
KOOC(CH2)4 COOK △H<0该反应装置如图所示。

回答下列问题:
(1)、装置图中仪器A的名称为。(2)、“氧化”过程应采用____加热(填标号)。A、酒精灯 B、水浴 C、油浴 D、电炉(3)、“氧化”过程中,当环己醇滴速不同时,溶液温度随时间变化曲线如下图所示,实验过程中应选择的环己醇滴速为滴/min。 (4)、“氧化液”中加浓盐酸酸化时有气泡产生,推测该气体的成分有(填化学式)。(5)、已知:不同温度下,相关物质在水中的溶解度如下表:
(4)、“氧化液”中加浓盐酸酸化时有气泡产生,推测该气体的成分有(填化学式)。(5)、已知:不同温度下,相关物质在水中的溶解度如下表:物质
己二酸
氯化钠
氯化钾
25℃时溶解度/g
2.1
36.1
34.3
70℃时溶解度/g
68
37.8
48
100℃时溶解度/g
160
39.5
56.3
①己二酸晶体“洗涤”的方法为(填字母)。
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
②除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为。
(6)、实验时称取10.0g环己醇(M=100g/mol),最终得到纯净的己二酸(M=146g/mol)晶体11.68g,则该实验中己二酸的产率为(保留两位有效数字)。 -
8、在体积均为2L的恒容容器中,分别在200℃和T℃时,发生如下反应 , A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
时间/min
0
2
4
6
8
10
200℃
0.80
0.55
0.35
0.20
0.15
0.15
T℃
1.00
0.65
0.35
0.18
0.18
0.18
下列有关该反应的描述正确的是( )
A、在200℃时,4min内用B表示的化学反应速率为0.225mol/(L·min) B、T℃下,6min时反应刚好达到平衡状态 C、从表中可以看出T>200℃ D、在该题目条件下,无法判断正反应方向是否为放热反应 -
9、高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料。它的发现和使用曾引起计算机的一场“革命”。可以按下列方法制备:
SiO2Si(粗) SiHCl3Si(纯)
下列说法不正确的是( )
A、步骤①的化学方程式为SiO2+CSi+CO2↑ B、步骤①中每生成1 mol Si,转移4 mol电子 C、高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料 D、SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl3 -
10、我国华中科技大学李钰团队研究了H2S在CuFe2O4催化剂表面吸附的历程,他们通过计算机模拟出的一种机理如图所示。

下列说法正确的是( )
A、CuFe2O4催化剂能降低该反应的焓变 B、决定该吸附历程速率的步骤是 C、吸附在催化剂表面的水分子解吸出来时放出能量 D、该吸附历程是H2S的分解过程 -
11、下图是实验室模拟制备“84”消毒液的过程,其中装置和描述错误的是( )
选项
A
B
C
D
装置




描述
制备
净化氯气
制备“84”消毒液
尾气的处理
A、A B、B C、C D、D -
12、我国科学家在世界上首次实现人工合成淀粉,下图是中间产物GAP的结构式,其中X、Y、Z、W均为短周期且原子序数依次增大的主族元素,且W的原子序数为其最外层电子数的3倍。下列说法正确的是( )
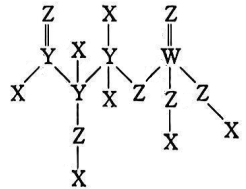 A、对应氢化物的沸点:Y<Z B、X2Z2是由极性键和非极性键组成的非极性分子 C、W所在周期中,第一电离能比其小的元素有5种 D、1mol的该物质可以和足量的Na反应转移4mol的电子
A、对应氢化物的沸点:Y<Z B、X2Z2是由极性键和非极性键组成的非极性分子 C、W所在周期中,第一电离能比其小的元素有5种 D、1mol的该物质可以和足量的Na反应转移4mol的电子 -
13、化学用语是学习化学最好的工具,下列化学用语能用于解释相应实验且书写正确的是( )A、测得碳酸钠溶液呈碱性: B、饱和溶液滴入沸水中变红褐色: C、铅酸蓄电池正极反应: D、小苏打与明矾共溶于水,产生大量气泡:↓
-
14、设为阿伏加德罗常数的值。下列说法中正确的是( )A、常温下,pH为13的溶液中含有的数目为 B、溶液中含N的粒子数目为 C、粗铜精炼时,若阳极材料减少 , 电路中通过电子数一定为 D、%的甲酸水溶液中,含有的氧原子数为
-
15、2023年5月28日,国产大飞机C919迎来商业首飞,C919机身部分采用第三代新型铝锂合金材料。下列关于铝和锂及合金的认识,正确的是( )A、铝锂合金用于机身材料是因为密度较大,强度较大 B、多相R-Mg-Ni系储氢合金中,基态Ni原子中自旋状态相反的两种电子的个数比为13∶15 C、铝锂合金属于新型无机非金属材料 D、铝锂合金的性质保持了原来金属的性质,与各成分金属的性质都相同
-
16、利用甲醇催化脱氢法制备甲酸甲酯涉及到如下化学反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)、。(2)、250℃,向密闭容器中通入 , 恒压条件下进行反应Ⅰ。①下列有关说法正确的是(填标号)。
A.高温有利于反应Ⅰ自发
B.说明该反应体系达到平衡状态
C.温度升高有利于提高的平衡转化率
D.通过增大分压可以提高的平衡产率
②要缩短达到平衡的时间,可采取的措施有。
③250℃,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压(分压=总压×物质的量分数)关系如图。M点kPa(计算结果保留2位小数,下同);该反应的平衡常数kPa(为以分压表示的平衡常数)。
 (3)、一种在上高度分散的铜颗粒催化剂()制备方法如下。CuO(w%)+酸性硅溶胶(),为测试催化剂性能,将甲醇蒸汽以的流速通过负载的催化反应器,甲醇转化率和甲酸甲酯选择性随w%、反应温度的变化如图。
(3)、一种在上高度分散的铜颗粒催化剂()制备方法如下。CuO(w%)+酸性硅溶胶(),为测试催化剂性能,将甲醇蒸汽以的流速通过负载的催化反应器,甲醇转化率和甲酸甲酯选择性随w%、反应温度的变化如图。①如图,当w%=15%时,生成甲酸甲酯的反应速率为(列计算式)。

②最适合的反应温度为(填标号)。
A.553K B.563K C.573K D.583K
③如图,当温度高于563K时,甲酸甲酯选择性下降的可能原因为。

-
17、神经病理性疼痛治疗药物米洛巴林苯磺酸盐的部分合成路线如下:

已知:
(1)、A的结构简式为。(2)、B中所含官能团名称为。(3)、 的系统命名为;Ⅲ的反应类型为。 (4)、V的化学方程式为。(5)、米洛巴林的一种同分异构体F,同时满足下列条件:
的系统命名为;Ⅲ的反应类型为。 (4)、V的化学方程式为。(5)、米洛巴林的一种同分异构体F,同时满足下列条件:①属于芳香族化合物且能与发生显色反应;
②核磁共振氢谱有四组峰,峰面积之比为。
则F的结构简式为。
(6)、Ⅵ为成盐反应,其目的是将米洛巴林转化为米洛巴林苯磺酸盐。①米洛巴林中能与苯磺酸反应的官能团为 , 从结构角度分析其能与苯磺酸反应的原因是。
②熔点:米洛巴林米洛巴林苯磺酸盐(填“>”“<”或“=”)。
(7)、参照上述合成路线,设计由 和制备
和制备 的合成路线。
的合成路线。 -
18、以和丙烯酸合成-巯基丙酸( , 沸点为130℃)的过程如下。(1)、制备的四氢呋喃(THF)溶液,实验装置如图。

①将浓硫酸稀释成30%硫酸的实验操作为。
②下列措施有利于提高吸收率的是(填标号)。
A.缓慢滴加30%硫酸 B.快速滴加30%硫酸
C.水浴X使用热水浴 D.水浴X使用冰水浴
③该装置存在的不足之处是。
(2)、合成-巯基丙酸的实验过程如下:将上述所得溶液转移至反应容器内,依次加入0.3mol丙烯酸、3.0mmol离子液体催化剂ILs,密封反应器后于90℃水浴恒温反应一段时间。其反应机理如图。
①
 中N1结合的孤电子对所处的原子轨道为。
中N1结合的孤电子对所处的原子轨道为。②虚线框内中间产物的结构简式为。
③若反应时间过长,-巯基丙酸与丙烯酸会进一步发生上述反应,其产物的结构简式为。
(3)、分离产物与催化剂的实验流程如下。
①操作1、操作2依次为、。
②操作3是通过加入适当浓度的、溶液来提纯分离,其原理是。
-
19、从钒矿石(主要含、、及少量)中分离提取的流程如下:

已知:有机溶剂对萃取率高于;有机溶剂只萃取Fe(Ⅲ)不萃取Fe(Ⅱ)。
(1)、“焙烧”过程中转化为 , 该反应的还原剂为。(2)、“酸浸”过程中将转化为 , 该反应的离子方程式为。(3)、为提高钒的萃取率和纯度,“操作X”中M和N可分别选择____(填标号)。A、、Fe B、Fe、 C、、H2O2(4)、以HA( )和HB(
)和HB( )“协同萃取”,其主要萃取物结构如图。
)“协同萃取”,其主要萃取物结构如图。
①HA和HB可通过两个氢键形成环状二聚体,其结构示意图为。
②比更稳定的原因为。
(5)、“氧化”过程中转化为的离子方程式为。(6)、“氧化”后的溶液中 , 为了使沉钒率达到98%,加入氯化铵(设溶液体积增加1倍),“沉钒”时应控制溶液中不低于。[25℃时,](7)、的晶胞如图(晶胞参数:;)。为阿伏加德罗常数的值。
①的配位数为。
②位于构成的空隙中(填标号)。
A.八面体 B.四面体 C.平面三角形
③该晶胞的密度为(用含的代数式表示)。
-
20、用溶液分别滴定20.00mL丁酸、2-氯丁酸、3-氯丁酸,溶液pH随NaOH溶液体积变化如图。下列说法错误的是( )
 A、的数量级为 B、HZ为2-氯丁酸 C、b点: D、水的电离程度:c>b>a>d
A、的数量级为 B、HZ为2-氯丁酸 C、b点: D、水的电离程度:c>b>a>d