-
1、利用丙酮酸与废水中的电催化耦合温和条件下去除和生产高值化丙氨酸,其工作原理如图。25℃,丙氨酸主要以
 形式存在,其。下列说法错误的是( )
形式存在,其。下列说法错误的是( ) A、丙氨酸酸性很弱是因为形成了内盐 B、阴极的电极反应式为
A、丙氨酸酸性很弱是因为形成了内盐 B、阴极的电极反应式为 ++10e-+11H+=
++10e-+11H+= +4H2O
C、理论上阳极区每生成 , 阴极区减少4.4mol
D、该装置整合了电化学—化学—电化学串联反应
+4H2O
C、理论上阳极区每生成 , 阴极区减少4.4mol
D、该装置整合了电化学—化学—电化学串联反应
-
2、利用CaO焙烧浸出法从炼钢粉尘(主要含ZnO和)中回收Zn的流程如下:

已知:“焙烧”主要产物为ZnO、;“盐浸”滤液的主要成分为。下列说法错误的是( )
A、若略去“焙烧”操作,则“盐浸”过程无法浸出 B、“盐浸”过程发生反应为 C、“盐浸”时通入适量HCl气体,可提高锌浸出率 D、“电解”时通入适量HCl气体,有利于放电 -
3、利用为原料制备 , 涉及的物质转化关系如下:
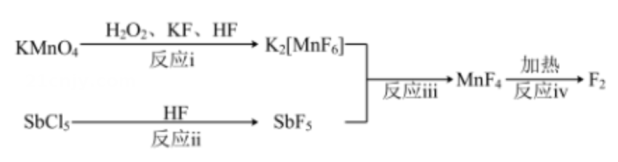
其中反应iii为。下列有关制备过程中的说法错误的是( )
A、反应i中为还原剂 B、键能:Sb-F>Sb-Cl C、Sb原子的价层电子对数发生变化 D、反应i~iv中有3个氧化还原反应 -
4、下列实验探究方案能达到探究目的的是( )
选项
探究方案
探究目的
A
向中滴加少量酸性溶液,振荡,溶液褪色
中含有碳碳双键
B
向溶液中加入少量NaCl固体,振荡,溶液由蓝色变为黄绿色
配位键稳定性大于
C
向酸性溶液中加入相同体积不同浓度的NaOH溶液,浓度越大,溶液黄色越深
pH越大,化学反应速率越快
D
向碳酸钠溶液中滴加浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊
碳酸的酸性大于苯酚
A、A B、B C、C D、D -
5、电还原空气污染物NO的转化路径如图。25℃,NH2OH的。为阿伏加德罗常数的值。下列说法错误的是( )
 A、含有的质子数为 B、含有的键数为 C、路径①中生成11.2L(已折算为标准状况)时,转移电子数为 D、25℃,1LNH2OH和HCl混合液中,若 , 则数目为
A、含有的质子数为 B、含有的键数为 C、路径①中生成11.2L(已折算为标准状况)时,转移电子数为 D、25℃,1LNH2OH和HCl混合液中,若 , 则数目为 -
6、一种金属有机框架材料的化学式为 , 其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大,的d轨道全充满。下列说法正确的是( )
 A、键角: B、最简单氢化物沸点:Z>Y>X C、电负性:X>Y>M D、最高价氧化物对应水化物酸性:Z>X
A、键角: B、最简单氢化物沸点:Z>Y>X C、电负性:X>Y>M D、最高价氧化物对应水化物酸性:Z>X -
7、某溶液中存在较多的、、 , 该溶液中还可能大量存在的离子是( )A、 B、 C、 D、
-
8、一种治疗高血压药物的中间体结构如图。下列有关该物质的说法正确的是( )
 A、分子式为 B、含有手性碳原子 C、含有3种官能团 D、1mol该物质最多可与6molNaOH反应
A、分子式为 B、含有手性碳原子 C、含有3种官能团 D、1mol该物质最多可与6molNaOH反应 -
9、我国科学家首次成功精准合成了和。下列有关说法正确的是( )
 A、和均含有大键 B、和均为共价晶体 C、和互为同分异构体 D、和均可发生取代反应
A、和均含有大键 B、和均为共价晶体 C、和互为同分异构体 D、和均可发生取代反应 -
10、某实验小组为了探究“氧化剂对检验的影响”,进行实验1:
实验1
试剂
现象
试管
滴管(各1滴)

溶液与1滴溶液
a.饱和氯水
溶液立即变为浅红色
b.稀硝酸
溶液立即变为红色
c.5%溶液
溶液立即变为深红色,无气体产生
(1)、向溶液中滴加1滴溶液,无明显现象,通入 , 无明显变化。①该实验的目的是。
②用离子方程式表示a中出现浅红色的原因:、。
(2)、对a中溶液呈浅红色的原因,甲同学提出以下假设。假设1:氯水加入量少,氧化生成的浓度低。
设计实验ⅰ排除了假设1:取a中浅红色溶液,操作a , 观察到溶液浅红色消失
假设2:氯水氧化性强,氧化了部分。
(已知:与可在溶液中大量共存;易被氧化为)
进行实验ⅱ证明假设2成立:向水中滴加1滴溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有。
①操作a为。操作b是。
②补全ⅱ中被氧化的离子方程式:
=
(3)、乙同学针对上述实验1的现象做了进一步思考并设计了实验2,分别取上述溶液于试管中,向其中滴加一定浓度的溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为)。记录消耗溶液的体积,实验记录如表:实验2
试管
消耗溶液的体积(mL)
d.水与1滴溶液和1滴溶液
2.40
e.实验a中溶液
1.52
f.实验b中溶液
1.60
g.实验c中溶液
1.84
则由d~g可以得出的结论是(答出2点)。
-
11、我国是世界上最早冶炼锌的国家之一,有独立的炼锌发展史。现代炼锌主要采取湿法工艺,以闪锌矿(主要成分为 , 还含铁等元素)、软锰矿(主要成分为)为原料联合生产锌和高纯度二氧化锰的一种流程如下:
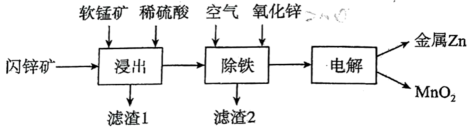 (1)、浸出:加入能促进的溶解,提高锌的浸出率,同时生成硫单质。的作用类似催化剂,“催化”过程可表示为:
(1)、浸出:加入能促进的溶解,提高锌的浸出率,同时生成硫单质。的作用类似催化剂,“催化”过程可表示为:ⅰ:
ⅱ:……
①写出ⅱ的离子方程式:。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的溶液中加入溶液,溶液几乎无色,再加入少量 , 溶液变红。
b.。
(2)、除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量的理由是。(3)、电解:总反应(未配平):。若不考虑副反应,为了使溶液中的、均恰好完全反应,理论上需要再添加哪种离子?(填“”、“”或“都不需要”)。 -
12、下图是元素周期表的一部分,参照元素①~⑤在表中的位置,回答问题:
族
周期
ⅠA
0
1
ⅡA
~
ⅢA
Ⅳ
ⅤA
ⅥA
ⅦA
2
①
3
②
③
④
⑤
(1)、①的原子结构示意图是。(2)、②、③、④、⑤四种元素中,简单离子半径最小的是(写离子符号)。②、③、④三种元素的单质与酸反应的剧烈程度的次序为>>(填元素符号),从原子结构的角度解释原因。
(3)、②和④各自的最高价氧化物的水化物发生反应的离子方程式为。⑤的单质与②的最高价氧化物的水化物发生反应的离子方程式为。(4)、下列事实能判断②和③的金属性强弱的是(填字母,下同)。a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.单质作为还原剂的时候,失去电子个数
(5)、硒(Se)位于第四周期,与①同主族。下列推断正确的是。a.只具有还原性
b.Se的最低负化合价是价
c.Se的气态氢化物的稳定性比①的强
(6)、室温下向固体表面吹 , 得到两种单质和 , 该反应的方程式为。 -
13、要配制的溶液,配制过程中有如下操作步骤:
①把称量好的绿矾放入小烧杯中,加适量蒸馏水溶解;
②待溶液恢复到室温;
③把①所得溶液小心转入____中;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
⑤继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用____滴加蒸馏水至液面与刻度线相切;
⑥将容量瓶塞紧,反复上下颠倒,摇匀。
请填写下列空白:
(1)、补全相应实验操作中所缺的仪器名称:③ , ⑤。(2)、实验室用绿矾来配制该溶液,用托盘天平称量绿矾g。(3)、实验室保存该溶液为了防止被氧化,一般在溶液底部加入少量(填试剂名称)。(4)、若实验测得该溶液的质量分数为 , 则该溶液的密度为(填表达式)。(5)、由于错误操作,使得实际浓度比所要求的浓度偏小的是____(填写编号)。A、称量的固体中混有少量无水 B、使用容量瓶配制溶液时,俯视液面定容 C、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 D、容量瓶底部残留少量蒸馏水,没有干燥完全 E、定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 -
14、电子工业中,人们常用溶液蚀刻印刷电路板,并进一步从腐蚀液中回收Cu和溶液。实验室模拟流程如图所示:
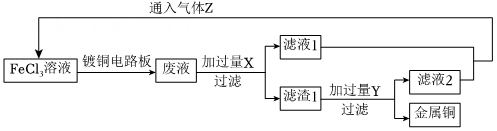
请回答下列问题:
(1)、写出溶液蚀刻镀铜电路板的离子方程式。(2)、写出加入过量X的离子方程式 , 。(3)、若取滤液1加入试管中,然后滴加足量氢氧化钠溶液,产生的现象是;在实际工业流程中,可替代气体Z的试剂为(填字母)。A.酸性溶液 B.氯水 C.溴水 D.硝酸溶液 E.过氧化氢溶液
-
15、下列选项描述与对应图像相符的是( )
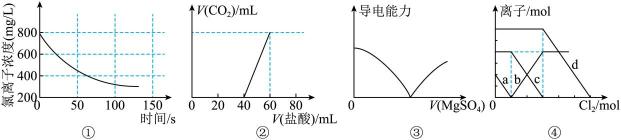 A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-)
A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-) -
16、高效净水剂高铁酸钾制备流程如图所示,下列离子方程式正确的是( )
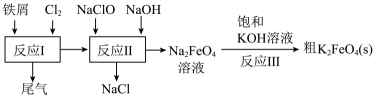 A、净水原理:(胶体) B、用溶液吸收尾气 C、反应Ⅱ: D、反应Ⅲ:
A、净水原理:(胶体) B、用溶液吸收尾气 C、反应Ⅱ: D、反应Ⅲ: -
17、将一定量的铁粉投入硫酸铜和硫酸铁混合溶液中充分反应,下列说法正确的是( )A、反应后若无固体剩余,则溶液中一定含有 B、反应后若无固体剩余,则溶液中一定含有 C、反应后若有固体,则固体一定为Fe和Cu的混合物 D、反应后若有固体,则溶液中的金属离子只有
-
18、铁是人体必需的微量元素,下面是一种常见补铁药品说明书中的部分内容:该药品含33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有并探究Vc的作用:

以下说法不正确的是( )
A、试剂1为溶液,目的是溶解药片 B、加入溶液后溶液变为淡红色,说明溶液中有少量 C、加入Vc后红色溶液颜色褪去,说明Vc具有一定的氧化性 D、新制氯水可替换为双氧水进行实验 -
19、向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )A、11.2g B、5.6g C、2.8g D、无法计算
-
20、短周期中8种元素a~h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。下列判断不正确的是( )
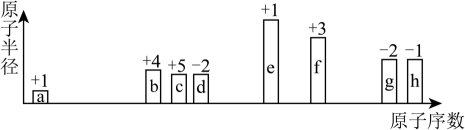 A、d、f组成的化合物能溶于强碱溶液 B、e的阳离子与g的阴离子具有相同的电子层结构 C、a可分别与b或c组成含10个电子的分子 D、最高价氧化物对应水化物的酸性:h>g>b
A、d、f组成的化合物能溶于强碱溶液 B、e的阳离子与g的阴离子具有相同的电子层结构 C、a可分别与b或c组成含10个电子的分子 D、最高价氧化物对应水化物的酸性:h>g>b