-
1、下列解释事实的方程式不正确的是( )A、小苏打溶液呈弱碱性:HCO3-+H2OCO32-+H3O+ B、测0.1mol/L氨水的pH为11:NH3·H2ONH4++OH- C、pH=5的硫酸稀释1000倍,pH约等于7:H2OH++OH- D、用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO32-(aq)SO42-(aq)+CaCO3(s)
-
2、下列物质属于强电解质的是( )A、蔗糖 B、NaCl C、CH3COOH D、Cu
-
3、90℃时水的离子积Kw=3.8×10-13 , 该温度时纯水的pH是( )A、等于7 B、小于7 C、大于7 D、无法确定
-
4、合成氨解决了地球上因粮食不足而导致的饥饿和死亡问题,下列有关工业合成氨的说法错误的是( )A、反应物是和 B、过程属于生物固氮 C、反应属于可逆反应 D、反应条件是高温、高压、催化剂
-
5、湿法炼锌净化钴渣中含有、、和的单质及 , 可利用过硫酸钠()氧化水解法实现钴的富集,其工艺流程如下:

已知:该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表:
金属离子
开始沉淀()的
2.2
6.8
7.7
沉淀完全()的
3.2
8.3
9.2
回答下列问题:
(1)、“浸渣”的主要成分为。(2)、根据以上流程判断离子的还原性:(填“小于”或“大于”)。(3)、利用上述表格数据,计算的。如果“滤液I”中浓度为 , 则“除铁”应控制的范围是。()(4)、①已知过硫酸钠中的化合价为+6,则过硫酸钠中含有的过氧键()数目为。(用表示阿伏加德罗常数的值)②写出“沉钴”时发生反应的离子方程式:。
(5)、上述流程中____(填字母)可返回湿法炼锌系统,提高锌的利用率。A、浸渣 B、滤渣I C、滤液I D、滤渣Ⅱ E、滤液Ⅱ -
6、工业上将一种以为主要成分的浸出液(含有、、、等杂质)经过一系列处理后,用于制备金属锌,其流程如下:

已知该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的如下表所示:
金属离子
开始沉淀的
2.3
6.8
4.7
6.2
完全沉淀的
3.2
8.3
6.7
8.2
回答下列问题:
(1)、“调”时选择氧化锌的目的是 , 优点是。(2)、若“滤渣1”的主要成分是 , “调”的范围应是 , 写出相关反应的离子方程式:。(3)、“除氯”时发生反应:。已知:时, , , 请计算该反应的平衡常数(列出计算式即可)。(4)、“电解”时生成产品的一极是(填“阴极”或“阳极”);缺少“除氯”步骤的影响是 -
7、的资源化有利于实现“碳中和”,利用氧化烷烃可制得烯烃。以和乙苯(
 )为原料合成苯乙烯(
)为原料合成苯乙烯( )为例,涉及以下反应:
)为例,涉及以下反应:I.

 +
+Ⅱ.


回答下列问题:
(1)、写出与反应生成和的热化学方程式:。(2)、下列说法正确的是____。(填字母)A、当时,反应Ⅱ达到平衡状态 B、升高温度,反应Ⅱ的正、逆反应速率都增大 C、增大压强,反应I平衡逆向移动,平衡常数减小 D、反应I加入催化剂,可降低该反应的活化能(3)、在刚性容器中,进料浓度比[(乙苯):]分别等于1:5、1:15、1:50时,乙苯的平衡转化率随反应温度的变化关系如图所示:

曲线的进料浓度比[(乙苯):]为 , 判断依据是。
(4)、某温度下,等物质的量的乙苯和在刚性容器内只发生反应Ⅱ。若初始的总压强为 , 平衡时乙苯的转化率为40%,则平衡时的总压强为(用表示,下同),反应Ⅱ的平衡常数。(用平衡分压代替平衡浓度计算,分压=总压物质的量分数) -
8、某研究性学习小组用如图所示的装置进行实验,探究原电池、电解池和电解制备钴的工作原理。一段时间后装置甲的两极均有气体产生,且极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:
查阅资料:高铁酸根()在溶液中呈紫红色。
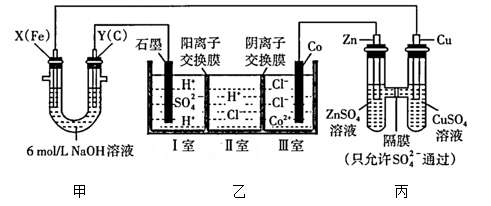 (1)、上述装置中,发生还原反应的电极有____(填字母)。A、 B、 C、 D、(2)、丙池中的(填“从左向右”“从右向左”或“不”)移动。(3)、若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除外,还可能有。(4)、乙池是电解制备金属钴的装置图,相比电解前,电解完成后理论上I室中(填“变大”“变小”或“不变”),该电解池总反应的化学方程式是。(5)、反应过程中,极处发生的电极反应为和。(6)、一段时间后,若极质量减小 , 极收集到气体,则在极收集到的气体体积为(均已折算为标准状况时的气体体积)。
(1)、上述装置中,发生还原反应的电极有____(填字母)。A、 B、 C、 D、(2)、丙池中的(填“从左向右”“从右向左”或“不”)移动。(3)、若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除外,还可能有。(4)、乙池是电解制备金属钴的装置图,相比电解前,电解完成后理论上I室中(填“变大”“变小”或“不变”),该电解池总反应的化学方程式是。(5)、反应过程中,极处发生的电极反应为和。(6)、一段时间后,若极质量减小 , 极收集到气体,则在极收集到的气体体积为(均已折算为标准状况时的气体体积)。 -
9、室温下,相关弱酸的电离常数如下表所示:
弱酸
电离常数
回答下列问题:
(1)、室温下,浓度相同的和两种溶液的大小:(填“<”或“>”),判断依据是。(2)、室温下,向的溶液中加入相同浓度的溶液。①当滴加溶液至溶液中的时,溶液的7(填“<”“=”或
“>”,下同),此时(溶液)。
②该温度下,反应的平衡常数(列出计算式即可)。
(3)、为测定某溶液的浓度,取待测溶液于锥形瓶中,滴加2滴酚酞溶液,用浓度为的标准溶液滴定。①达到滴定终点的现象是。
②某同学第一次滴定后标准溶液的液面如图所示,读数为。
③平行滴定三次的实验数据如下表所示,请计算待测溶液的浓度为。

实验次数
溶液的体积/
待测溶液的体积/
1
②
25.00
2
24.71
25.00
3
24.69
25.00
-
10、下表为元素周期表的一部分,每个字母分别代表一种元素。

回答下列问题:
(1)、元素Y、Z、M、Q中,原子半径最大的是(填元素名称)。(2)、基态Q原子中,其占据的最高能层的符号是 , 其最高能级的原子轨道的形状是。(3)、下列关于R的说法正确的是(填序号)。①R的原子序数为26
②依据核外电子排布,把元素周期表划分为5个区,R位于ds区
③基态的价层电子轨道表示式为
 (4)、的中心原子杂化轨道类型为 , 键角为。的空间结构名称为。
(4)、的中心原子杂化轨道类型为 , 键角为。的空间结构名称为。 -
11、常温下,将过量粉末置于水中,达到沉淀溶解平衡: , 。[已知: , , , ],下列说法错误的是( )A、上层清液中: B、上层清液中: C、向体系中通入气体,溶液中增大 D、向体系中加入溶液,存在:
-
12、常温下,将等浓度的溶液分别滴加到等、等体积的、两种弱酸溶液中,溶液的与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
 A、的浓度大于的浓度 B、a点水的电离程度小于b点水的电离程度 C、常温下的电离常数是 D、向溶液中滴加溶液至时,
A、的浓度大于的浓度 B、a点水的电离程度小于b点水的电离程度 C、常温下的电离常数是 D、向溶液中滴加溶液至时, -
13、一定条件下,按2:1的比例向容积为的密闭容器充入A物质和B物质,发生反应: , 温度、压强()对A物质的平衡转化率的影响如下图所示,下列说法错误的是( )
 A、压强: B、压强为时,若和时该反应的速率分别为、 , 则: C、该反应的 D、平衡常数:A点=B点
A、压强: B、压强为时,若和时该反应的速率分别为、 , 则: C、该反应的 D、平衡常数:A点=B点 -
14、臭氧分解的反应历程包括:反应①(快);反应②(慢)。大气中的氯氟烃光解产生的氯自由基()能够催化分解,加速臭氧层的破坏。下列说法正确的是( )A、活化能:反应①>反应② B、分解为的速率主要由反应①决定 C、参与了的分解反应,改变了分解的反应历程 D、参与反应提高了分解为的平衡转化率
-
15、下列实验事实不能证明是弱电解质的是( )A、将的醋酸溶液稀释100倍后 B、的醋酸溶液的约为2.9 C、溶液能使酚酞试液变红 D、的醋酸溶液恰好与的溶液中和
-
16、贮备电池具有下列特点:日常将电池的一种组成部分(如电解质溶液)与其他部分隔离备用;使用时电池可迅速被激活并提供足量电能。贮备电池主要用于应急救援和武器系统等。电池是一种可被海水激活的贮备电池,下列叙述错误的是( )A、负极反应为 B、正极反应为 C、电池放电时由正极向负极迁移 D、负极可能发生副反应:
-
17、利用电解法可将含有、、、等杂质的粗铜提纯。下列叙述正确的是( )A、电解时以精铜作阳极 B、电解时阴极上发生的反应为 C、用溶液作电解质溶液,反应一段时间后浓度保持不变 D、电解后,可在电解槽阴极下方收集到少量、等金属
-
18、利用下列装置进行的实验,不能达到预期目的的是( )




A.在铁制品上电镀铜
B.制作水果(柠檬)电池
C.将溶液蒸干制备无水
D.粗测碳酸钠溶液的
A、A B、B C、C D、D -
19、下列叙述中,不能用盐类水解原理解释的是( )A、常用明矾作净水剂 B、向沸水中滴加饱和溶液制备胶体 C、施肥时,草木灰(有效成分)与铵态氮肥不可混用 D、抢救钡离子中毒者时,可用硫酸钠溶液洗胃
-
20、下列有关金属腐蚀和保护的说法中,错误的是( )A、生铁中含碳,比纯铁容易生锈 B、牺牲阳极法是利用电解原理保护金属 C、埋在潮湿土壤里的铁管比在干燥的土壤里更容易被腐蚀 D、镀银的铁制品,镀层损坏后,露出的铁比镀银的铁制品更容易被腐蚀