-
1、铁与水蒸气反应的实验装置如图,下列说法正确的是( )
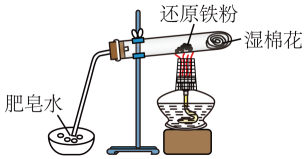 A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、产生的气体在点燃前不需要检验纯度 D、试管中发生化合反应
A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、产生的气体在点燃前不需要检验纯度 D、试管中发生化合反应 -
2、如下图所示的装置中A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶。下列说法正确的是( )
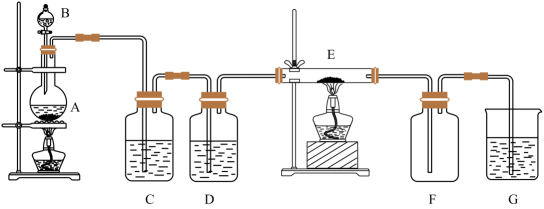 A、C瓶的作用是收集氯气 B、G中加入氢氧化钠溶液用于吸收多余的氯气 C、E中发生的化学反应为Fe+Cl2=FeCl2 D、用该装置制备氯气前不需要检查装置的气密性
A、C瓶的作用是收集氯气 B、G中加入氢氧化钠溶液用于吸收多余的氯气 C、E中发生的化学反应为Fe+Cl2=FeCl2 D、用该装置制备氯气前不需要检查装置的气密性 -
3、下列溶液中,与100mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )A、100mL 0.5mol/L MgCl2溶液 B、200mL 0.25mol/L HCl溶液 C、50mLL1mol/L NaCl溶液 D、200mL0.25mol/L CaCl2溶液
-
4、同温同压下,同体积的甲、乙两种气体的质量比是17∶14,若乙气体是一氧化碳,则甲气体是( )A、O2 B、HCl C、CO2 D、H2S
-
5、NA表示阿伏加德罗常数,下列说法正确的是( )A、2.3克Na变为Na+时,失去的电子数为0.1NA B、18克H2O所含有的电子数为8NA C、28克N2所含的原子数为NA D、在标准状况下,11.2LO2所含的分子数为NA
-
6、下列说法正确的是( )A、H2的摩尔质量是2g B、18gH2O的物质的量是2mol C、阿伏加德罗常数符号为NA , 没有单位 D、标准状况下,气体摩尔体积约为22.4L•mol-1
-
7、实验室制取氯气的化学方程式为: MnO2 + 4 HCl(浓)MnCl2+ Cl2↑+2H2O。下列有关该反应的说法正确的是( )A、MnO2是还原剂 B、MnO2中的Mn元素被还原 C、HCl中的氯元素得到电子 D、消耗4mol HCl转移4mol电子
-
8、在无色溶液中下列离子能大量共存的是( )A、Na+、H+、Cl-、 B、K+、Ba2+、OH-、Fe2+ C、Cu2+、Na+、Br-、Cl- D、Na+、K+、Cl-、
-
9、下列离子方程式书写正确的是( )A、氢氧化钠溶液和稀盐酸反应:H++OH-=H2O B、大理石与盐酸反应制取二氧化碳:+ 2H+=H2O + CO2↑ C、铁粉投入FeCl3溶液中:Fe + Fe3+=2Fe2+ D、用小苏打治疗胃酸过多:+ 2H+=CO2↑+H2O
-
10、下列生活中常见物质的俗名与化学式相对应的是( )A、纯碱—NaHCO3 B、石灰石—Ca(OH)2 C、铁红—FeO D、酒精—C2H5OH
-
11、下列各组选项中属于同位素的是( )A、与 B、O2与O3 C、与 D、金刚石和石墨
-
12、下列说法正确的是( )A、石墨导电,所以是电解质 B、SO2的水溶液导电,所以SO2是电解质 C、固体NaCl不导电,所以NaCl是非电解质 D、CaCO3虽然难溶于水但CaCO3是电解质
-
13、胶体在人们的日常生活中随处可见。下列分散系属于胶体的是( )A、泥水 B、豆浆 C、生理盐水 D、油水混合物
-
14、某含锰废料中主要含及少量的 , 、 , 以此为原料制备的流程如下:
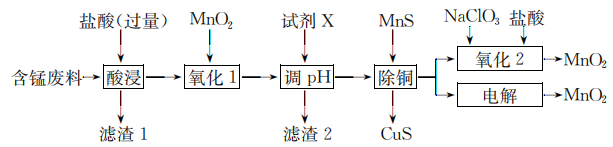
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
开始沉淀时
8.3
6.3
2.7
4.7
完全沉淀时
9.8
8.3
3.7
6.7
Ⅱ.常温下、。
回答下列问题:
(1)、滤渣1的主要成分是(填化学式)。(2)、“氧化1”的目的是(用离子方程式表示)。(3)、“调”时,试剂X为(任写一种),|的调节范围为。(4)、“除铜”时,当溶液中 , 溶液中=。(5)、“氧化2”制备(恰好完全反应)时,=();“电解”制备的阳极电极反应式为。 -
15、水溶液中的离子反应与平衡在生产和生活中有广泛的用途。回答下列问题:(1)、25℃时,若向氨水中加入少量硫酸铵固体,则溶液中将(填“增大”“减小”或“不变”)。(2)、25℃时,若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:;所得溶液的7(填“>”“<”或“=”),用离子方程式表示其原因:。(3)、25℃时,若向氨水中加入稀硫酸至溶液的 , 此时溶液中 , 则=。(4)、25℃时,为配制:溶液,取固体少许溶于2~3mL水中,有白色沉淀产生,此溶液的7(填“<”“>”或“=”),配制;溶液的正确方法是。(5)、在化学分析中,以标准溶液滴定溶液中的时,采用为指示剂,利用与反应生成砖红色沉淀指示滴定终点。当溶液中的恰好沉淀完全(浓度等于)时,溶液中= , =(结果保留两位有效数字。已知:25℃时、的分别为和。)
-
16、酸性锌锰干电池是一种常用的一次电池,其结构如图所示。该电池在放电过程中产生和。回答下列问题:
 (1)、该电池的正极为(填“”或“”)极,该电池总反应的化学方程式为。(2)、如图为电解100mL溶液的装置,该装置的电源为上述酸性锌锰干电池。
(1)、该电池的正极为(填“”或“”)极,该电池总反应的化学方程式为。(2)、如图为电解100mL溶液的装置,该装置的电源为上述酸性锌锰干电池。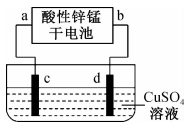
①电解一段时间后,石墨电极出现的现象为;石墨电极上的电极反应式为。
②当上述电池消耗3.25g时,电解后溶液中为(忽略电解前后溶液体积变化)。欲将电解后的溶液恢复至原溶液,应加入的试剂是 , 其质量为g。
-
17、在1L密闭容器中发生反应: , 其化学平衡常数与温度的关系如下表:
(℃)
650
700
800
830
1000
0.5
0.6
0.9
1.0
1.7
回答下列问题:
(1)、该反应的(填“>”或“<”)0。(2)、某温度时,测得平衡体系中各物质的物质的量浓度相等,则此时对应的温度为℃。保持温度和体积不变,充入一定量的 , 则平衡常数(填“增大”“减小”或“不变”)。(3)、下列措施不能提高的平衡转化率的是____(填字母)。A、选择适当的催化剂 B、增大压强 C、及时分离出 D、升高温度(4)、650℃时,将2mol和3mol投入上述容器中开始反应,达到平衡时的转化率为。(5)、800℃时,某时刻测得 , , ¹、 , 则此时反应是否达到平衡状态(填“是”或“否”),此时,(填“>”“<”或“=”)。 -
18、某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,装置如图所示。其中乙装置中X为阳离子交换膜。下列有关说法错误的是( )
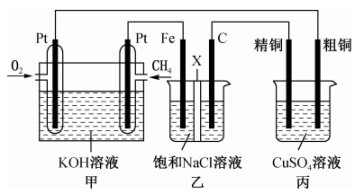 A、通入的极为正极,该电极反应式为 B、乙装置中铁电极为阴极,电极反应式为 C、反应一段时间后,乙装置中在铁电极区生成氢氧化钠溶液 D、反应一段时间后,丙装置中硫酸铜溶液浓度可能减小
A、通入的极为正极,该电极反应式为 B、乙装置中铁电极为阴极,电极反应式为 C、反应一段时间后,乙装置中在铁电极区生成氢氧化钠溶液 D、反应一段时间后,丙装置中硫酸铜溶液浓度可能减小 -
19、强碱的溶液和等体积、等物质的量浓度的弱酸的溶液混合后,溶液中有关离子浓度的大小关系是( )A、 B、 C、 D、
-
20、现进行下列实验。
将溶液和溶液等体积混合,得到悬浊液;将悬浊液过滤,得到滤液和白色沉淀。
向滤液中滴加溶液,滤液出现浑浊。
向沉淀中滴加溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )
A、悬浊液中存在沉淀溶解平衡: B、滤液中不含 C、实验(3)表明转化为 D、实验可以证明的比的小