-
1、类推时要充分考虑物质的相似性和特殊性,下列类推结论正确的是( )
选项
化学事实
类推结论
A
Al与溶液反应能置换出Cu
Na比Al活泼,也能从溶液中置换出Cu
B
受热分解生成和
也能受热分解为CuO和
C
溶解度:
溶解度:
D
、FeO、等均属于碱性氧化物
金属氧化物都属于碱性氧化物
A、A B、B C、C D、D -
2、下列实验装置或操作能达到相应实验目的的是( )
选项
A
B
C
D
装置




实验目的
验证Na与水反应放热
测定氯水的pH
比较、的热稳定性
完成铁粉与水蒸气的实验
A、A B、B C、C D、D -
3、下列物质中既含共价键又含离子键的是( )A、 B、 C、NaOH D、
-
4、我国新一代“人造太阳”HL-2M“托卡马克”装置的等离子体电流突破1兆安培,距离可控核聚变点火又近了一步。“人造太阳”中的核聚变反应之一为。下列说法错误的是( )A、和属于不同的核素 B、中的“2”与中的“2”意义不相同 C、的中子数比的中子数多个 D、和的化学性质不同
-
5、用代表阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,和的混合气体中含有的分子数为 B、0.1mol/L的NaOH溶液中含的数目为 C、5.6gFe在中充分燃烧时转移的电子数为 D、4.6gNa与100mL1mol/L的盐酸溶液反应时转移的电子数为
-
6、常温下,下列各组离子在指定环境中一定能大量共存的是( )A、一定浓度的NaOH溶液:、、、 B、pH=3的溶液;、、、 C、澄清透明的溶液:、、、 D、能与铝反应生成的溶液:、、、
-
7、下列关于物质性质和用途的说法正确的是( )A、次氯酸具有酸性,能杀死水中的病菌,起到消毒的作用 B、在元素周期表金属与非金属的分界处可以找到制造催化剂的元素 C、铝的化学性质不活泼,所以铝制品耐腐蚀 D、氧化铁呈红棕色,可用于制作红色涂料
-
8、下列反应既属于氧化还原反应,又属于离子反应的是( )A、水滴石穿 B、氢氧化铝治疗胃酸过多 C、金属钠放入水中 D、燃料的燃烧
-
9、金属材料是人类社会发展的见证者,在人类社会各个转型期起到了举足轻重的作用,即使在信息材料、功能材料、纳米材料飞速发展的今天,金属材料的地位仍举足轻重。下列关于金属材料的说法中正确的是( )A、合金具有金属特性,合金中不含非金属元素 B、铜比铁先成功冶炼的原因是铜比铁活泼 C、储氢合金能大量吸收氢气,并与氢气结合成金属氢化物 D、生铁具有良好的延展性,可以锻轧和铸造
-
10、高铁酸钠是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体.某工厂利用废金属屑(主要成分为和 , 含有少量)制取并回收金属 , 工艺流程如下:
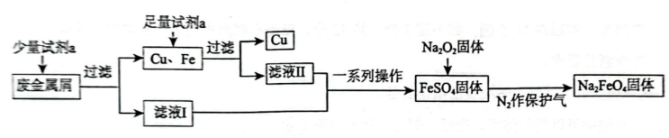 (1)、试剂为(填化学式);在过滤操作中要使用玻璃棒,其作用是 .(2)、证明滤液Ⅰ中无的实验方法是;用离子方程式解释滤液Ⅰ不含有可能的原因 .(3)、流程中固体不可暴露在空气中时间过长,原因是(用化学方程式表示).(4)、高铁酸钠中铁的化合价为价.高铁酸钠处理水过程中所发生的化学反应主要为(胶体) , 该反应中物质的氧化性强弱关系是(填“>”或“<”) . 净水时能吸附悬浮物的原因是 .
(1)、试剂为(填化学式);在过滤操作中要使用玻璃棒,其作用是 .(2)、证明滤液Ⅰ中无的实验方法是;用离子方程式解释滤液Ⅰ不含有可能的原因 .(3)、流程中固体不可暴露在空气中时间过长,原因是(用化学方程式表示).(4)、高铁酸钠中铁的化合价为价.高铁酸钠处理水过程中所发生的化学反应主要为(胶体) , 该反应中物质的氧化性强弱关系是(填“>”或“<”) . 净水时能吸附悬浮物的原因是 . -
11、“84”消毒液是生活中常见的消毒剂,可用与溶液在冷水浴中制备.(1)、Ⅰ.配制溶液:
配制溶液时,一般有以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其正确的操作顺序为(填标号).
A.①②④⑤⑦⑥③ B.②①③⑤⑥⑦④ C.②①⑥③⑤④⑦ D.①②⑥③⑦⑤④
实验中必须用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、 .
(2)、下列操作使所配溶液浓度偏低的是____(填标号).A、在天平两边放相同大小的滤纸后,再进行称量 B、未冷却至室温就将溶液转移到容量瓶中 C、定容时俯视刻度线 D、未洗涤溶解固体的烧杯 E、固体在称量前已部分变质(3)、Ⅱ.“84”消毒液的制备(装置如图所示):
已知是实验室制取氯气的装置,中广口瓶内为溶液,中试剂为 , 中发生反应的化学方程式为 , 的作用为 .
(4)、某同学设计实验探究84消毒液的漂白性.a.在消毒液中加入水后,放入红色纸片,观察到纸片慢慢褪色.
b.在消毒液中加入白醋后,放入红色纸片,观察到纸片迅速褪色.
c.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示.
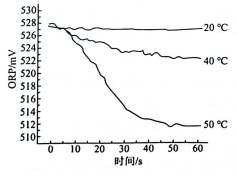
已知ORP表示水溶液中物质的氧化性或还原性强弱.ORP值越大,氧化性越强.
①实验a、b现象不同的原因是 .
②实验c中,随时间的变化ORP值不同的原因可能是 .
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度.已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100g,加水稀释为8%的溶液,则需加水的质量为g.
-
12、下表是元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题.
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
③
④
⑤
三
⑥
⑦
⑧
⑨
(1)、④、⑧、⑨三种元素的常见简单离子的半径由小到大的顺序为(用离子符号表示).(2)、④、⑦、⑨三种元素形成的化合物中含有的化学键类型为 .(3)、写出⑧的单质与⑥的最高价氧化物对应的水化物反应的离子方程式 .(4)、写出②元素和④元素形成的化合物的电子式 .(5)、②、③、④三种元素的简单氢化物中最稳定的是(填化学式).(6)、用电子式表示⑥与⑨形成的化合物的形成过程;该化合物属于(填“共价”或“离子”)化合物.(7)、镓是31号元素,镓的化合物氮化镓和砷化镓作为第三代半导体材料,具有耐高温、耐高电压等特性,随着技术的发展,它们的商用价值进入“快车道”.下列有关说法正确的是(填标号).a.位于元素周期表第四周期ⅣA族
b.为门捷列夫预言的“类铝”
c.的最高价氧化物对应水化物的碱性比⑧元素最高价氧化物对应水化物的碱性强
d.元素在第四周期第ⅤA族,则酸性: ,
-
13、(1)、Ⅰ.现有以下几种物质:
① ②氢氧化钠固体 ③ ④ ⑤盐酸 ⑥酒精 ⑦熔融硝酸钾 ⑧液氯
其中属于电解质的是(填序号),能导电的是(填序号).(2)、写出④在熔融状态下的电离方程式 .(3)、Ⅱ. 亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用.已知能发生反应:
配平上述化学方程式,并在方程式上面用“双线桥”经明电子转移的方向和数目 .
(4)、该反应中表现的性质是;氧化剂与还原剂的物质的量之比为;当反应转移电子时,则在标准状况下生成NO的体积为L.(5)、误食会导致血红蛋白中的转化为而中毒,可服用维生素解毒,维生素C在解毒过程中作剂. -
14、某无色溶液仅由中的若干种离子组成,且各离子浓度相等,取适量溶液进行如下实验:
①加过量盐酸无明显现象,且阴离子种类不改变;进行焰色试验显黄色,透过蓝色钴玻璃观察,未见紫色;②取操作①后的溶液,加入过量溶液,产生白色沉淀.
下列推断错误的是( )
A、原溶液中一定存在 B、②中的白色沉淀只有 C、溶液中一定不含 D、由溶液呈电中性可知溶液中一定含有 -
15、下列选项所示的物质间转化能一步实现的是( )A、 B、 C、 D、
-
16、下列“实验结论”与“实验操作及现象”不相符的一组是( )
实验操作及现象
实验结论
A
某溶液中先加入溶液有白色沉淀产生,再加盐酸,
沉淀不消失
该溶液不一定有
B
向饱和 , 溶液中加入足量氯水,有无色气体产生
氯水中含
C
向饱和 , 溶液中通入足量 , 有白色固体析出
溶解度:
D
把绿豆大的和K分别投入水中,K与水反应更剧烈
金属性:
A、A B、B C、C D、D -
17、歌曲《青花瓷》唱道“䆖外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是(碱式碳酸铜).铜在潮湿的空气中生锈的化学反应为 . 下列有关该反应的说法错误的是( )A、碱式碳酸铜既是氧化产物,又是还原产物 B、该反应属于氧化还原反应,化合价发生改变的只有两种元素 C、该反应中铜失电子,氧气得电子 D、若有铜单质参与反应,则转移电子的物质的量为
-
18、已知① ② , ③ , 请依据上述反应判断还原性由强到弱的顺序是( )A、 B、 C、 D、
-
19、设为阿伏加德罗常数的值,下列说法正确的是( )A、含的浓盐酸与足量反应生成的分子数目为 B、与过量铁反应,转移的电子数为 C、溶液中含有的原子数目为 D、标准状况下,含共用电子对数为
-
20、下列有关化学用语的说法正确的是( )A、质子数为53、中子数为78的碘原子: B、互为同位素 C、次氯酸的结构式为 D、的结构示意图: