-
1、下列装置或操作正确且对应的实验能达到实验目的的是( )A、测定溶液的浓度
 B、测定中和反应反应热
B、测定中和反应反应热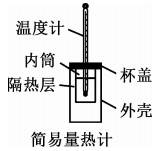 C、通过注射器活塞右移,验证与反应放热
C、通过注射器活塞右移,验证与反应放热 D、研究 , 对分解速率的影响
D、研究 , 对分解速率的影响
-
2、在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
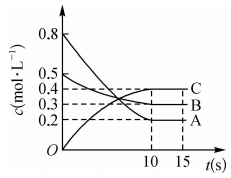 A、该反应的化学方程式为 B、反应物A的平衡转化率为60% C、0~10s内,A的平均反应速率为 D、在10~15s内,
A、该反应的化学方程式为 B、反应物A的平衡转化率为60% C、0~10s内,A的平均反应速率为 D、在10~15s内, -
3、常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液:、 , 、 B、含的溶液:、、、 C、滴加甲基橙试液显红色的溶液:、 , , D、水电离出来的的溶液:、、、
-
4、将金属X连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。下列有关说法错误的是( )
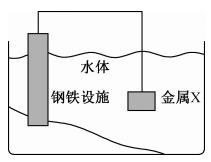 A、钢铁设施表面因有电子流入而被保护 B、钢铁设施的电极反应式为 C、形成电化学保护时,金属X作负极 D、通常情况下,钢铁设施在海水中的腐蚀速率比在河水中的快
A、钢铁设施表面因有电子流入而被保护 B、钢铁设施的电极反应式为 C、形成电化学保护时,金属X作负极 D、通常情况下,钢铁设施在海水中的腐蚀速率比在河水中的快 -
5、恒温下气体反应达到化学平衡,平衡常数。恒容时,若降低温度,D的浓度增大。下列说法错误的是( )A、该反应的化学方程式为 B、增大、 , 减小 C、恒容时,向容器中充入 , 反应速率不变 D、正反应为放热反应
-
6、实验室用标准溶液滴定未知浓度的溶液,下列说法或操作正确的是( )A、滴定前锥形瓶用溶液润洗2~3次 B、将标准溶液置于碱式滴定管中备用 C、滴定前俯视读数、滴定后仰视读数会导致滴定结果偏高 D、当锥形瓶内溶液颜色由浅绿色变为紫红色时,立即记下滴定管液面所在刻度
-
7、与的反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
 A、反应①、反应②均为吸热反应 B、活化能:反应①<反应② C、反应速率:反应①>反应② D、
A、反应①、反应②均为吸热反应 B、活化能:反应①<反应② C、反应速率:反应①>反应② D、 -
8、下列叙述中错误的是( )A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、在铁制品上镀铜时,铁制品为阳极,铜盐为电镀液 D、铁管上镶嵌锌块,铁管不易被腐蚀
-
9、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )A、 B、 C、 D、
-
10、下列有关电解的叙述中错误的是( )A、与电源正极相连的是阳极 B、与电源负极相连的是阴极 C、在阴极上发生氧化反应 D、阴离子向阳极方向迁移
-
11、化学与生产、生活关系密切。下列操作或应用错误的是( )A、将草木灰与铵态氮肥混合施用 B、用白醋除去热水瓶内的水垢 C、用高铁酸钾()作为净水剂 D、用活性炭去除冰箱里的异味
-
12、84消毒液是常用消毒剂,主要成分为NaClO,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
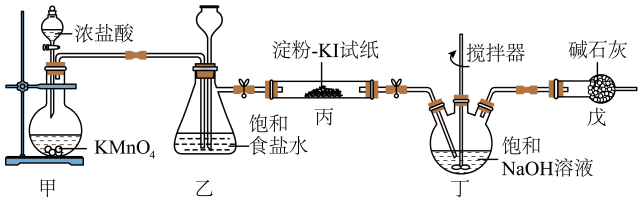 (1)、装置甲中盛放浓盐酸的仪器名称是 , 装置甲中反应的离子方程式为。(2)、装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为。(3)、装置丁制备的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 , 理论上反应中转移电子数为。(4)、装置戊的作用是。(5)、为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
(1)、装置甲中盛放浓盐酸的仪器名称是 , 装置甲中反应的离子方程式为。(2)、装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为。(3)、装置丁制备的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 , 理论上反应中转移电子数为。(4)、装置戊的作用是。(5)、为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。猜测1:双氧水与消毒液发生反应产生氧气
猜测2:……
①猜测1中反应的化学方程式为;猜测2可能为。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到 , 则证明猜测1正确。
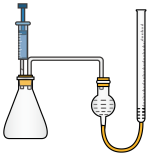
-
13、绿矾()可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含、FeO,还有一定量的)可用于制绿矾晶体,其工艺流程如下:
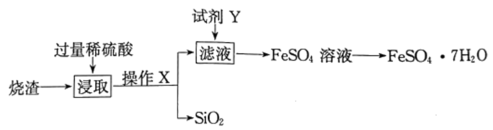
查阅资料:不溶于水,也不与稀硫酸反应。
(1)、操作X的名称为。(2)、“浸取”步骤中,反应的离子方程式分别为、。(3)、试剂Y的作用是将转化为。①若试剂Y是 , 转化原理用离子方程式表示为 , 属于(填“氧化产物”或“还原产物”)。
②若试剂Y是Fe,转化原理用离子方程式表示为 , 化工生产中②比①好,从物质利用率角度考虑,其原因是。
(4)、加入试剂Y充分反应后,如何证明滤液中已不含 , 写出实验操作和现象:。 -
14、如图是元素周期表的一部分。回答下列问题:
 (1)、世界上绝大部分卤素都存在于海洋中,海洋是卤素的资源宝库。
(1)、世界上绝大部分卤素都存在于海洋中,海洋是卤素的资源宝库。①的离子结构示意图为。
②表中几种元素的最高价氧化物对应水化物酸性最强的是(填化学式);写出该物质在水溶液中的电离方程式:。
③用电子式表示短周期元素中,原子半径最大的元素与氯形成的简单化合物的形成过程:。
④氰是一种无色、可燃气体,剧毒、有苦杏仁味,与卤素单质的性质相似,试写出氰与NaOH溶液在常温下反应的离子方程式:。
(2)、硒是人体必需的微量元素,起到抗氧化的作用。①写出Se在周期表中的位置:。
②溶于水生成 , 向所得溶液中通入气体发生反应,生成Se和。写出与反应的化学方程式:。
(3)、下列说法正确的是(填字母)。a.原子半径:
b.中存在的化学键为非极性共价键
c.非金属性:Cl>Se>Br
-
15、化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋() ③结晶苏打() ④双氧水() ⑤高锰酸钾消毒液() ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)、以上物质的主要成分或有效成分属于盐的是(填序号)。(2)、若要鉴别某白色晶体是食盐还是结晶苏打,可以用(填序号)来鉴别,若白色固体是结晶苏打,观察到的现象是。(3)、酸性和会发生如下反应:+ + = (配平上述方程式)。
(4)、在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:。(5)、家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:。 -
16、水体中氨氮含量超标会造成水体富营养化,用次氯酸钙除去氨氮的原理如图所示。下列说法正确的是( )
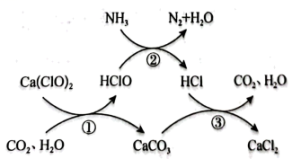 A、上述反应①②③均属于氧化还原反应 B、反应②中有非极性共价键和极性共价键的生成 C、水的分子结构为直线形:H-O-H D、若要除去标准状况下2.24L的 , 需消耗的物质的量至少为0.15mol
A、上述反应①②③均属于氧化还原反应 B、反应②中有非极性共价键和极性共价键的生成 C、水的分子结构为直线形:H-O-H D、若要除去标准状况下2.24L的 , 需消耗的物质的量至少为0.15mol -
17、X、Y、Z、W、Q为原子序数依次增大的五种短周期主族元素,最外层电子数之和为16,X与Y能形成具有10电子的微粒 , X与Z能形成共价化合物 , 该化合物受热易分解,W元素的焰色为黄色。下列说法正确的是( )A、元素的非金属性:Y>Z B、简单离子半径:Q>W C、最高价氧化物对应水化物的碱性:Q>W D、X、Y、Z三种元素也可形成离子化合物
-
18、下列物质的转化不能全部通过一步反应直接完成的是( )A、 B、 C、 D、
-
19、实验室配制250mL1mol/L的NaOH溶液,下列情况会使所配溶液浓度偏高的是( )A、称量NaOH固体时间过长 B、烧杯及玻璃棒的洗涤液未转移至容量瓶中 C、定容时,俯视容量瓶的刻度线 D、定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
-
20、对下列离子方程式的评价合理的是( )
选项
离子方程式
评价
A
与水的反应:
正确
B
向溶液中通入足量:
正确
C
溶液与盐酸反应:
错误;应生成沉淀
D
向溶液中滴加过量的NaOH溶液:
正确
A、A B、B C、C D、D