-
1、氢和氧是构建化合物的常见元素。请回答:(1)、钴氧化物和按照适量的比例高温煅烧可得到钴蓝,钴蓝可用于青花瓷的颜料。钴蓝晶体结构是由图1中Ⅰ型和Ⅱ型两种小立方体平移所得。图2是钴蓝的晶胞,已知钴原子位于晶胞的顶角和面心。

①钴蓝晶胞中、、O原子个数比为。
②原子间最短的距离为。
③图2所示字母中,Ⅰ型小立方体分别是a、(填字母序号)。
(2)、苯、1,3-丁二烯都是平面分子,碳原子均提供一个p轨道肩并肩成共轭大π键。①下列说法正确的是。
A.同周期元素中,第一电离能大于碳的元素有3种
B.苯中碳原子杂化方式为
C.1,3-丁二烯的2、3号位碳原子间的键长大于乙烷中的碳碳键键长
D.
 的二氯代物有9种(不考虑立体异构)
的二氯代物有9种(不考虑立体异构)②苯环之间通过共用苯环的若干条环边而形成的芳香烃称为稠环芳烃,例如:萘(
 )、蒽(
)、蒽( )、菲(
)、菲( )。
)。分子式为的稠环芳烃,一个分子中σ键有个。
(3)、邻羟基苯甲醛( )能形成分子内氢键。
)能形成分子内氢键。①画出邻羟基苯甲醛的分子内氢键。
②邻羟基苯甲醛在分子内形成氢键,在分子间不存在氢键的原因是。
-
2、根据实验目的设计方案并进行实验,观察到相关现象,下列方案设计、结论均正确的是( )
实验目的
方案设计
现象
结论
A
探究金属、的金属性强弱
将金属、分别切成体积相等的颗粒,投入蒸馏水中
金属与水反应更加剧烈
的金属性强于
B
判断的化学键类型
将固体溶于水,进行导电性实验
溶液可导电
中含有离子键
C
探究浓硝酸与炭在加热条件下能否反应
将红热的木炭投入浓硝酸中
产生红棕色气体
炭与浓硝酸在加热条件下反应生成
D
探究有机物中官能团之间的影响
分别向丙烯酸乙酯()和α-氰基丙烯酸乙酯[]中滴入水
前者无明显现象,后者快速固化
氰基活化双键,使其更易发生加聚反应
A、A B、B C、C D、D -
3、常温下,往0.35mol/L溶液中通入。
已知: , , ,
下列说法不正确的是( )
A、通入一定量后溶液 , 未出现沉淀 B、往溶液中加盐酸酸化,将有生成 C、通入一定量后溶液中 , 滴入酚酞试剂,溶液一直呈无色 D、已知自然条件下,饱和碳酸溶液的 , 则自然条件下饱和碳酸溶液中存在 -
4、乙醛与氢氰酸( , 弱酸)能发生加成反应,生成2-羟基丙腈,历程如下:

下列说法不正确的是( )
A、因氧原子的电负性较大,醛基中的碳原子带部分正电荷,与作用 B、易挥发且有剧毒,是该反应不在酸性条件下进行的原因之一 C、往丙酮与反应体系中加入一滴溶液,反应速率明显加快,因此碱性越强,上述反应越容易进行 D、与加成的反应速率: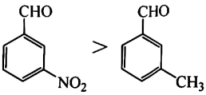
-
5、高氯酸在化工生产中有广泛应用,工业上以为原料制备高氯酸的原理如图所示。下列说法正确的是( )
 A、上述装置中,f极为光伏电池的正极 B、a、b处均通入溶液 C、d处得到较浓的溶液,c处得到HClO4溶液 D、若转移2mol电子,理论上生成100.5gHClO4
A、上述装置中,f极为光伏电池的正极 B、a、b处均通入溶液 C、d处得到较浓的溶液,c处得到HClO4溶液 D、若转移2mol电子,理论上生成100.5gHClO4 -
6、有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为。下列说法不正确的是( )
 A、Z与N可形成化合物、 B、最简单氢化物的沸点: C、M元素的第一电离能比同周期相邻元素的大 D、离子中Y发生杂化
A、Z与N可形成化合物、 B、最简单氢化物的沸点: C、M元素的第一电离能比同周期相邻元素的大 D、离子中Y发生杂化 -
7、有机物L的合成路线(反应条件和其他产物已经略去)如下图所示,下列说法不正确的是( )
 A、1molX最多能与2mol(水溶液)发生反应 B、在Z→M的过程中,发生还原反应,M的结构简式为 C、Y能使溴水和酸性高锰酸钾溶液褪色,但褪色原理不同 D、N和L均难溶于水
A、1molX最多能与2mol(水溶液)发生反应 B、在Z→M的过程中,发生还原反应,M的结构简式为 C、Y能使溴水和酸性高锰酸钾溶液褪色,但褪色原理不同 D、N和L均难溶于水 -
8、下列指定反应与方程式不相符的是( )A、淀粉碘化钾溶液在空气中变蓝: B、用惰性电极电解溶液,阴极的电极反应式: C、甘油与硝酸发生酯化反应:
 D、在酸催化下,苯酚与甲醛反应生成羟甲基苯酚:
D、在酸催化下,苯酚与甲醛反应生成羟甲基苯酚:
-
9、关于有机物检测,下列说法正确的是( )A、分子式为的有机物不能使酸性溶液褪色,则该有机物一定不是醇 B、可用溴水鉴别甲酸水溶液、甲醛水溶液和甲苯 C、与的核磁共振氢谱谱图是完全相同的 D、淀粉水解液碱化后,加入新制氢氧化铜并加热,出现砖红色沉淀,说明淀粉水解生成了还原性糖
-
10、某实验小组为制备1-氯-2-甲基丙烷(沸点69℃),将2-甲基-1-丙醇和溶于中,加热回流(伴有气体产生)。反应完全后倒入冰水中分解残余的 , 分液收集层,再用无水干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的部分装置(夹持及加热装置略)如下图,下列说法不正确的是( )
 A、装置①在加热回流时,需加入沸石或碎瓷片 B、装置②与装置①的冷凝管上端相连,因气体极易溶于水,需将尾气处理装置设计成防倒吸 C、装置③在分液前无法区分水层与有机层时,可向分液漏斗中滴水,若上层无水滴通过轨迹,则上层为水层 D、沸点为39.8℃,为增强冷凝效果,可使用装置④的蒸馏装置,对圆底烧瓶进行控制温度的温水浴加热
A、装置①在加热回流时,需加入沸石或碎瓷片 B、装置②与装置①的冷凝管上端相连,因气体极易溶于水,需将尾气处理装置设计成防倒吸 C、装置③在分液前无法区分水层与有机层时,可向分液漏斗中滴水,若上层无水滴通过轨迹,则上层为水层 D、沸点为39.8℃,为增强冷凝效果,可使用装置④的蒸馏装置,对圆底烧瓶进行控制温度的温水浴加热 -
11、类比和推理是学习化学的重要方法,下列结论合理的是( )
已知
结论
A
15—冠—5(冠醚)能识别
12—冠—4(冠醚)能识别
B
酸性:三氟乙酸>三氯乙酸
酸性:氢氟酸>氢氯酸
C
溶解度:
D
晶体硅是半导体材料
晶体硅的化学键含金属键成分
A、A B、B C、C D、D -
12、《开宝本草》记载“取钢煅作叶,如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣”。铁华粉[主要成分为]可用如下方法检测。下列相关说法不正确的是( )
 A、气体X为 B、铁华粉中含有铁单质 C、由上述实验可知,结合的能力强于 D、制备铁华粉的主要反应为
A、气体X为 B、铁华粉中含有铁单质 C、由上述实验可知,结合的能力强于 D、制备铁华粉的主要反应为 -
13、下列各组离子在给定溶液中能大量共存的是( )A、1.0mol/L氨水溶液()中:、、 B、1.0mol/L氯化钠溶液()中:、、 C、0.1mol/L碳酸钠溶液()中:、、 D、0.1mol/L酸性高锰酸钾溶液()中:、、
-
14、具有强氧化性,可发生反应:。下列说法不正确的是( )(为阿伏加德罗常数的值)A、既是氧化产物,又是还原产物 B、仅作氧化剂 C、生成1mol转移电子的数目为 D、实验室不可用加热固体的方法制备
-
15、下列表示正确的是( )A、的价层电子对互斥(VSEPR)模型:
 B、的电子式:
C、基态的价层电子轨道表示式:
B、的电子式:
C、基态的价层电子轨道表示式: D、
D、 的名称:乙二酸乙二酯
的名称:乙二酸乙二酯
-
16、碳酸氢钠常用作食用碱或工业用碱,下列说法不正确的是( )A、向碳酸氢钠固体中加入少量水后,会出现吸热现象 B、碳酸氢钠溶液呈碱性,加入溶液后,产生较多氨气 C、分别同时加热等量碳酸钠和碳酸氢钠固体,碳酸氢钠先发生分解 D、往饱和碳酸钠溶液中通入 , 会产生碳酸氢钠沉淀
-
17、常温常压下,下列物质为气态的是( )A、甲醇 B、甲醛 C、甲酸 D、水
-
18、伯舒替尼(J)是一种激酶抑制剂,可用于治疗成人慢性粒细胞性白血病。其一种合成路线如图。请回答下列问题:
 (1)、A→B的反应类型为 , 设计A→B、G→H的目的为。(2)、物质B中所含官能团的名称为 , C的结构简式为。(3)、
(1)、A→B的反应类型为 , 设计A→B、G→H的目的为。(2)、物质B中所含官能团的名称为 , C的结构简式为。(3)、 的化学名称为。 (4)、D→E的反应方程式为。(5)、K比化合物
的化学名称为。 (4)、D→E的反应方程式为。(5)、K比化合物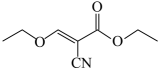 少两个H原子,K的芳香族同分异构体中,符合下列条件的结构有种,核磁共振氢谱图上只有3组峰的结构简式为(写一种即可)。
少两个H原子,K的芳香族同分异构体中,符合下列条件的结构有种,核磁共振氢谱图上只有3组峰的结构简式为(写一种即可)。a.苯环上有4个取代基 b.与苯环直接相连 c.能与氯化铁溶液发生显色反应
(6)、 是一种新型的整合酶链转移抑制剂,设计以
是一种新型的整合酶链转移抑制剂,设计以 、
、 为含碳原料制备
为含碳原料制备 的合成路线(其他无机试剂或溶剂等任选)。
的合成路线(其他无机试剂或溶剂等任选)。 -
19、为了消除含金硫精矿中硫对氰化浸出产生的不利影响,使被硫化物包裹的金得以解离,获得孔隙率较高的氧化焙烧渣,需对含金硫精矿进行氧化焙烧预处理。已知焙烧过程中发生的反应有:
反应1:
反应2:
反应3:
(1)、= , 有利于反应3自发进行的条件为(填“高温”或“低温”)。(2)、焙烧温度和时间对硫的脱除率和金的浸出率的影响如图。
最佳的焙烧温度为℃;最佳焙烧时间为2h,理由是。
(3)、在密闭容器中充入一定量的和进行反应,测得平衡时的体积分数随X的变化关系如图。
①X表示的是(填“温度”或“压强”),判断的理由是。
②下列条件能判断反应1达到平衡状态的是(填标号)。
a.的生成速率与的消耗速率相等
b.和浓度相等
c.容器中气体的平均摩尔质量不变
d.的质量保持不变
(4)、℃下,在恒压密闭容器中充入1.5mol和3.5mol进行反应,已知起始压强为140kPa,经过10min达到平衡,测得生成、的物质的量均为0.2mol。①0~10min内,分压的平均变化率为。②℃下,反应1的压强平衡常数=(为用分压表示的平衡常数,分压=总压×物质的量分数,列计算式即可)。
-
20、SrCO3可用于金属冶炼和锶盐制备等。以天青石(成分为SrSO4、BaSO4、CaSO4、SiO2)为原料制备SrCO3的工艺流程如图。

已知:常温下,Ksp(SrSO4)=3.2×10-7、Ksp(BaSO4)=1.0×10-10、Ksp(SrCO3)=1.6×10-9。
回答下列问题:
(1)、天青石磨成粉的目的是。(2)、天青石粉中的SrSO4与氨水、NH4HCO3溶液反应的离子方程式为;NH4HCO3溶液中c(NH3·H2O)+c(OH-)+c()(填“>”“<”或“=”)c(H2CO3)+c(H+);将滤液1蒸发浓缩、冷却结晶可得副产物(填化学式)。(3)、滤渣的主要成分为 (填化学式)。(4)、打浆酸溶后的滤液加热至95~100C.加NaOH溶液调pH=14的目的是。(5)、碱析后获得Sr(OH)2的操作为。(6)、以SrCO3和TiO2为原料,在1300~1500℃下煅烧,可制得优良的光学材料及人造宝石SrTiO3.SrTiO3的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞参数为apm。
①生成SrTiO3的化学方程式为。
②SrTiO3晶体的密度为。