-
1、钢铁表面发黑(在钢铁表面形成一层致密的氧化物膜)可提高其耐磨、耐腐蚀性能。某实验小组欲利用下列装置进行发黑实验,并探究氧化物成分。

已知:实验过程中产生了一种能使湿润的红色石蕊试纸变蓝的气体。
(1)、实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是和。(2)、向圆底烧瓶中逐滴滴入、的混合溶液至过量,在140℃下处理15~90min。①盛装混合溶液的仪器为。
②下列加热方法中,最合适的为(填标号)。
A.水浴 B.油浴 C.酒精灯
(3)、用乙装置收集产生的气体,请在装置中补全仪器。(4)、试剂X可以为。(5)、探究甲装置中固体产物(无铁单质剩余)成分。取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有(填离子符号)。
②不用硝酸溶解固体的原因为。
③向b试管中滴入(填化学式)溶液,溶液变为血红色,说明b试管中含有(填离子符号)。
(6)、根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:。 -
2、常温下,向含、、的溶液中滴加溶液,混合液中[、、]与的关系如图所示。已知:。下列叙述正确的是( )
 A、直线代表与的关系 B、图像中G点坐标为 C、向含、和的混合溶液中滴加溶液,最先产生的沉淀是 D、的平衡常数K大于100
A、直线代表与的关系 B、图像中G点坐标为 C、向含、和的混合溶液中滴加溶液,最先产生的沉淀是 D、的平衡常数K大于100 -
3、萃取剂P204对钒(V)有强萃取力,萃取平衡:。常温下,溶液中的随时间的变化如图所示。下列叙述正确的是( )
 A、min时,萃取反应已停止 B、min时,正反应速率大于逆反应速率 C、min时,若增大 , 平衡向左移动,平衡常数减小 D、min内平均速率
A、min时,萃取反应已停止 B、min时,正反应速率大于逆反应速率 C、min时,若增大 , 平衡向左移动,平衡常数减小 D、min内平均速率 -
4、零价铝是一种应用于环境修复的极有潜力的两性金属材料。构建微观腐蚀原电池体系(如图),实现了零价铝在近中性溶液中处理硝酸盐。下列叙述正确的是( )
 A、在电极上发生氧化反应 B、生成的电极反应式: C、若表面生成了致密的 , 能提高去除率 D、生成等物质的量的和 , 转移的电子数之比为1∶5
A、在电极上发生氧化反应 B、生成的电极反应式: C、若表面生成了致密的 , 能提高去除率 D、生成等物质的量的和 , 转移的电子数之比为1∶5 -
5、由煤矸石(主要成分为及铁铝的氧化物,还含有少量)制备铁红的工艺流程如图,下列说法错误的是( )
 A、使用硝酸酸浸会产生污染环境的气体 B、氧化过程的反应为 C、溶液中存在的化学键有离子键、共价键、氢键 D、煅烧氢氧化铁前,需洗去表面吸附的杂质
A、使用硝酸酸浸会产生污染环境的气体 B、氧化过程的反应为 C、溶液中存在的化学键有离子键、共价键、氢键 D、煅烧氢氧化铁前,需洗去表面吸附的杂质 -
6、根据下列实验操作和现象得出的结论正确的是( )
选项
实验操作及现象
结论
A
甲、乙金属在溶液中构成原电池,甲极表面产生气泡,乙极不断溶解
还原性:甲<乙
B
在21溶液中先滴加几滴1溶液,后滴加几滴l溶液,先产生白色沉淀,后产生黄色沉淀
:
C
将通入品红溶液中,品红溶液褪色
具有漂白性
D
在酸性溶液中加入丙烯醛,溶液褪色
丙烯醛含碳碳双键
A、A B、B C、C D、D -
7、叶绿素C的结构简式如图所示。下列叙述错误的是( )
 A、由结构可知,叶绿素C中镁元素为+4价 B、叶绿素C中碳原子采用sp2、sp3杂化 C、叶绿素C含σ键和π键 D、叶绿素C中C、N、O的第一电离能:N>O>C
A、由结构可知,叶绿素C中镁元素为+4价 B、叶绿素C中碳原子采用sp2、sp3杂化 C、叶绿素C含σ键和π键 D、叶绿素C中C、N、O的第一电离能:N>O>C -
8、由原子序数依次增大的短周期主族元素X、Y、Z、R组成的一种化合物 , 常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是( )
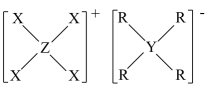 A、电负性: B、键角: C、最简单氢化物的稳定性: D、1含1配位键
A、电负性: B、键角: C、最简单氢化物的稳定性: D、1含1配位键 -
9、劳动创造美好生活、下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
用石膏点卤制作豆腐
石膏是白色固体
B
用小苏打和白醋疏通下水道
碳酸氢钠与醋酸反应生成气体
C
用特氟龙不粘锅煎牛排
聚四氟乙烯耐高温,易清洁
D
用热的纯碱溶液洗碗
碳酸钠溶液呈碱性,可以去油污
A、A B、B C、C D、D -
10、动、植物生长促进剂克拉酮(Z)可由如下反应制得,下列有关说法错误的是( )
 A、X能发生银镜反应 B、X、Y、Z中所有原子可能共平面 C、X、Y、Z均能使溴水褪色 D、Y、Z互为同分异构体
A、X能发生银镜反应 B、X、Y、Z中所有原子可能共平面 C、X、Y、Z均能使溴水褪色 D、Y、Z互为同分异构体 -
11、下列过程用离子方程式表示正确的是( )A、铅蓄电池充电时阴极的电极反应式: B、以铁为电极电解溶液的阳极的电极反应式: C、把铜粉加入含双氧水的氨水中,溶液变蓝: D、在溶液中滴加少量溶液:
-
12、完成下列实验,对应的仪器选择正确的是( )
 A、除去中的:①② B、蒸发食盐水得到固体:④⑤ C、配制一定物质的量浓度的溶液:①③⑤ D、用标准溶液滴定未知浓度的醋酸:③⑥
A、除去中的:①② B、蒸发食盐水得到固体:④⑤ C、配制一定物质的量浓度的溶液:①③⑤ D、用标准溶液滴定未知浓度的醋酸:③⑥ -
13、已知:① , ②。为阿伏加德罗常数的值。下列叙述正确的是( )A、反应①中物质的氧化性: B、标准状况下,11.2L参与反应时转移的电子数为5N C、1L0.5溶液含有的分子数为0.5 D、反应②生成28.4g时,还原产物分子数为0.05
-
14、下列化学用语错误的是( )A、的电子式:
 B、中键的形成过程:
B、中键的形成过程: C、基态P原子的价层电子轨道表示式:
C、基态P原子的价层电子轨道表示式: D、3―氨基―1,5―戊二酸的键线式:
D、3―氨基―1,5―戊二酸的键线式:
-
15、贵州文化多姿多彩,传统与时尚共舞。下列选项中涉及的物质的主要成分为无机非金属材料的是( )A、苗族银首饰 B、遵义会议时使用的木桌 C、水族的铜鼓 D、布依族的石板房
-
16、卡巴拉汀可用于治疗阿尔茨海默病,其中间体F的合成路线如下(部分试剂和条件略去):

回答下列问题:
(1)、A的分子式为。由B生成C的反应类型为。(2)、C中含氮官能团的名称是。(3)、利用Eschweiler-Clarke反应(N-甲基化的一个经典反应)使C生成D,其第一步反应为: , 有机产物X为(写结构简式)。 (4)、碳原子上连有4个不同的原子或基团时,该碳称为手性碳。每分子D中含手性碳原子个。(5)、E的结构简式为。(6)、在A的芳香族同分异构体中,同时满足下列条件的共有种;
, 有机产物X为(写结构简式)。 (4)、碳原子上连有4个不同的原子或基团时,该碳称为手性碳。每分子D中含手性碳原子个。(5)、E的结构简式为。(6)、在A的芳香族同分异构体中,同时满足下列条件的共有种;①能发生银镜反应:②能与溶液发生显色反应。
其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的同分异构体的结构简式为。
-
17、早在2000多年前我国已掌握铜镍合金的冶炼,但直到250年前才有科学家制得单质镍。回答下列问题:(1)、基态镍原子的价电子排布式为。基态铜、镍原子的第二电离能分别为、、的原因是。(2)、丁二铜肟常用于检验。在稀氨水介质中,丁二酮肟与反应生成鲜红色沉淀,其结构如图所示,该物质中:

①非金属元素电负性由大到小的顺序为。
②氢氧原子间存在作用。
③的配位数为。
④已知:和N位于同一平面。可采用配合物的杂化轨道理论进行解释:原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测采用的杂化轨道类型为(填字母标号)。
A. B. C. D.
(3)、二元铜镍固溶体称为普通白铜,其晶胞结构如图。
已知立方晶胞边长为acm,阿伏加德罗常数为。
①该晶体类型为 , Cu与Cu之间的最近距离为pm。
②该晶体密度为(用含、a的式子表示)。
-
18、一种废旧磷酸铁锂正极片(主要成分为、、Al和石墨)的闭环回收工艺流程如图所示:

已知:①为抗坏血酸,具有较强的还原性。
②滤饼成分为。
回答下列问题:
(1)、碱溶前,可将废电池正极片进行机械活化处理,使颗粒直径减小,目的是。(2)、向滤液①中通入过量二氧化碳,可以回收铝,该反应的离子方程式为。(3)、酸浸过程中加入的目的是。(4)、将不同pH下得到的滤饼溶于盐酸,稀释至一定比例后测算Fe、P物质的量比 , 结果见下表,由此得出,沉淀的最佳pH为。pH
6.0
6.5
7.0
8.0
9.0
1.54
1.50
1.49
1.47
1.47
(5)、调节pH时,氨水不宜加入过量,原因是随着氨水浓度的增大,会产生杂质;若该步骤中Fe元素沉淀完全,滤液③中除H、O外,还大量含有的元素有。(6)、真空管烧结时,加入葡萄糖的作用是。 -
19、Haber法是工业上常使用的合成氨技术,对该技术的改进一直是科学家探索的重要课题,其反应原理为:。回答下列问题:(1)、已知:

1molN―H键断裂吸收的能量等于kJ(保留一位小数),合成氨反应在常温(T=298K)下(填“能”或“不能”)自发进行。
(2)、将1.00mol和3.00mol充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
①图甲中反应达到平衡时的平均反应速率。
②图乙的平衡体系中A、B、C三点的平衡常数、、间的大小关系是。
(3)、针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成 , 可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的的物质的量表示)如图所示:
①无LiH,催化效率最高的金属是。
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步:(在M表面解离)
第ⅱ步:
第ⅲ步:。
(4)、工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、、。 -
20、某化学兴趣小组探究与溶液的反应,装置如下图:
 (1)、该实验不用98%硫酸制取的原因为。(2)、【预测】与溶液反应可能出现的现象为溶液由黄色变成浅绿色,则浅绿色离子为。(3)、【实验探究】向装置B中溶液通入至饱和,溶液立即由黄色变成红色。
(1)、该实验不用98%硫酸制取的原因为。(2)、【预测】与溶液反应可能出现的现象为溶液由黄色变成浅绿色,则浅绿色离子为。(3)、【实验探究】向装置B中溶液通入至饱和,溶液立即由黄色变成红色。①甲同学认为溶液变红的原因是通入后,水解程度增大,形成胶体,乙同学进行了实验操作: , 否定了该推论。
②静置5min后,溶液从红色恢复黄色。丙同学取适量该溶液,滴加盐酸酸化的溶液,产生白色沉淀,则该同学认为与发生氧化还原反应,丁同学认为该操作不严谨,应把A装置换成如图装置,则通入氮气的目的为。
 (4)、【查阅资料】能与S(Ⅳ)微粒形成红色配合物。
(4)、【查阅资料】能与S(Ⅳ)微粒形成红色配合物。①分析的水溶液成分,猜想与形成配合物呈红色的含S(Ⅳ)微粒有:、、、 , 进行如下实验:
序号
实验
加入试剂
现象
I

2mL溶液,再滴加几滴盐酸
溶液变成红色,比(3)中溶液红色深;滴加盐酸后,溶液颜色由红色变成黄色
II
2mL溶液
溶液变成红色,比Ⅰ中溶液红色深
②根据实验I现象,可以推测红色物质与、无关 (填微粒化学式) 。
③对比实验I、II现象,pH越(填“大”或“小”),配位反应进行的程度越大。
【实验结论】的水溶液与溶液也可以发生配位反应。