-
1、用Na2CO3•10H2O晶体配制500mL0.100mol•L-1Na2CO3溶液。下列说法正确的是A、称取5.30gNa2CO3•10H2O晶体在烧杯中溶解 B、将溶解所得溶液转移至未经干燥的容量瓶中 C、溶解所用烧杯未洗涤会使所配溶液浓度偏大 D、定容后摇匀,液面低于刻度线,可以补加适量水
-
2、2024年我国新能源汽车销量预计达1300万辆,Li2CO3是制造汽车锂电池必不可少的原材料。以锂云母精矿的浸出液(主要含Li+、Al3+、Fe3+、F-、SO等)制取电池级Li2CO3的工艺流程如下图所示:

已知:①HR为酸性磷类有机萃取剂,难溶于水,易萃取Fe3+ , 可萃取少量Al3+ , 萃取Fe3+时发生反应:Fe3++3HRFeR3+3H+ , 生成的FeR3可溶解在HR中;碱性条件可促进萃取平衡向右移动,提高萃取率。
②部分物质溶解度(g/100gH2O)数据见表:
温度
0℃
20℃
80℃
Li2CO3
1.54
1.33
0.85
LiHCO3
11.6
7.82
高于50℃,开始分解
(1)、写出单质锂与水反应的化学方程式。(2)、使用HR萃取剂时,需用一定浓度的NaOH溶液进行处理的目的是。(3)、判断“沉锂”时Li+是否沉淀完全的操作方法是。过滤1后得到的固体进行洗涤,向过滤器中加入(填“冷水”或“热水”)至 , 待水流尽,重复2~3次。(4)、在上述工艺中,碳化反应的化学方程式为。(5)、Li2CO3受热分解可产生Li2O。Li2O晶胞具有反萤石(CaF2)结构,为立方晶系晶体,其晶胞结构示意图如下图。该晶胞中离子的分数坐标如下:氧离子:(0,0,0);( , , 0);( , 0,);(0, , );……
锂离子:( , , );( , , );( , , );( , , );……

①在下图中画出Li2O晶胞沿x轴投影的俯视图。

②Li2O晶体中O2-的配位数为。
③若Li2O晶体晶胞棱长为acm,阿伏加德罗常数的值为NA , 则Li2O晶体密度为g·cm-3(用含a、NA的代数式表示)。
-
3、
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。 制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是___________(填字母)。
A. ⅰ中,C做还原剂 B. 碳酸的酸性强于硅酸 C. 碳酸的热稳定性弱于硅酸 D. 元素的电负性C>Si (2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________,电负性Si________H(填“>”或“<”)。
②该反应的化学方程式为________。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
Si
Ga
As
Se
(4)写出基态Ga原子价层电子排布式________。
(5)As的第一电离能比Se大的主要原因是:________。
-
4、有机化合物H是一种新型天然皮肤美白剂,H的一种合成路线如下图所示:

已知:
 +R″CHO
+R″CHO +H2O
+H2O回答下列问题:
(1)、B中碳原子杂化方式有。(2)、E中官能团的名称为。(3)、由C生成D的反应类型为。(4)、F的结构简式为。(5)、写出一种满足下列条件的D同分异构体结构简式(不考虑立体异构)。①能发生银镜反应
②能发生水解反应,酸性条件下一种水解产物能与FeCl3溶液发生显色反应,且核磁共振氢谱有4组峰,峰面积之比为3∶2∶2∶1。
(6)、设计以2-氯丙烷和1,3-二氯丙烷为原料制备 的合成路线。(无机试剂及溶剂任选)
的合成路线。(无机试剂及溶剂任选) -
5、二氧化铈(CeO2)是一种重要的稀土化合物。实验室提纯二氧化铈一种方法如下图所示:
 (1)、X是一种气体单质,分子式为。(2)、写出反应①中稀硫酸、H2O2与CeO2反应的化学方程式。(3)、由反应②可知氧化性:XCe(OH)4(填“>”或“<”或“=”),反应②中的氧化剂与还原剂物质的量之比为 , 当消耗1molX转移电子物质的量为mol。(4)、CeO2是汽车尾气净化装置的重要组成材料,工作原理如下图所示,CeO2在汽车尾气净化过程中起作用。写出过程①发生反应的化学方程式。
(1)、X是一种气体单质,分子式为。(2)、写出反应①中稀硫酸、H2O2与CeO2反应的化学方程式。(3)、由反应②可知氧化性:XCe(OH)4(填“>”或“<”或“=”),反应②中的氧化剂与还原剂物质的量之比为 , 当消耗1molX转移电子物质的量为mol。(4)、CeO2是汽车尾气净化装置的重要组成材料,工作原理如下图所示,CeO2在汽车尾气净化过程中起作用。写出过程①发生反应的化学方程式。
-
6、为达成2060年碳中和的远景目标,一种能够捕捉CO2的电化学装置如下图所示,下列说法错误的是
 A、Al电极为电池的负极 B、石墨电极反应为2CO2+2e-= C、每生成1mol草酸铝,外电路中转移3mol电子 D、在捕捉CO2过程中,不断向Al电极移动
A、Al电极为电池的负极 B、石墨电极反应为2CO2+2e-= C、每生成1mol草酸铝,外电路中转移3mol电子 D、在捕捉CO2过程中,不断向Al电极移动 -
7、根据实验目的设计方案并进行实验,观察相关现象,其中方案设计或结论不正确的是
选项
实验目的
方案设计
现象
结论
A
比较乙醇和苯酚中羟基的活泼性
取相同物质的量的乙醇和苯酚分别溶于2mL乙醚,各加入一小块金属钠
苯酚溶液与金属钠反应较剧烈
羟基活泼性:苯酚>乙醇
B
检验苯中是否含有少量苯酚
向溶液中加入适量浓溴水
没有观察到白色沉淀
苯中不含苯酚
C
检验乙醇是否发生消去反应
将乙醇和浓硫酸共热产生的气体依次通入足量KOH溶液、酸性KMnO4溶液
KMnO4溶液紫红色褪去
乙醇发生了
消去反应
D
探究SO2的漂白原理
将SO2分别通入品红的水溶液和品红的乙醇溶液
品红的水溶液褪色,醇溶液不褪色
SO2与水反应的产物具有漂白作用
A、A B、B C、C D、D -
8、羟甲香豆素(丙)是一种治疗胆结石的药物,合成路线如下图。下列说法错误的是
 A、甲分子式为C12H16O5 B、乙生成丙的反应类型是消去反应,反应条件是浓硫酸、加热 C、常温下1mol乙最多与2molNaOH的水溶液完全反应 D、甲和乙分子中均存在手性碳原子,丙分子不存在手性碳原子
A、甲分子式为C12H16O5 B、乙生成丙的反应类型是消去反应,反应条件是浓硫酸、加热 C、常温下1mol乙最多与2molNaOH的水溶液完全反应 D、甲和乙分子中均存在手性碳原子,丙分子不存在手性碳原子 -
9、中国科学家在淀粉人工合成方面取得了重大突破性进展,该研究在国际上首次实现了二氧化碳到淀粉的合成(图示为局部合成路线),下列有关说法正确的是
 A、1mol甲醛分子含有3mol σ键 B、反应(1)既是氧化还原反应,又是化合反应 C、过氧化氢是含有非极性键的非极性分子 D、DHA易溶于有机溶剂,难溶于水
A、1mol甲醛分子含有3mol σ键 B、反应(1)既是氧化还原反应,又是化合反应 C、过氧化氢是含有非极性键的非极性分子 D、DHA易溶于有机溶剂,难溶于水 -
10、下列过程对应的化学方程式或离子方程式书写正确的是A、苯乙烯合成聚苯乙烯:nC6H5CH=CH2
 B、三氯化铁溶液刻制覆铜电路板:
C、乙醇用铜作催化剂进行催化氧化:CH3CH2OH + 3O22CO2 + 3H2O
D、海水提溴将溴吹入吸收塔:
B、三氯化铁溶液刻制覆铜电路板:
C、乙醇用铜作催化剂进行催化氧化:CH3CH2OH + 3O22CO2 + 3H2O
D、海水提溴将溴吹入吸收塔:
-
11、在给定条件下,下列选项所示的物质间转化不能实现的是A、CH3CH2BrCH2=CH2CH3CH2OH B、MgCl2(aq)Mg(OH)2(s)MgO (s) C、S(s)SO3(g)H2SO4(aq) D、N2(g)NH3(g)NaHCO3(s)
-
12、只用括号内指定试剂不能鉴别的一组试剂是A、乙酸、乙醛、甲酸 (新制Cu(OH)2悬浊液) B、甲苯、1-己烯、乙酸 (溴水) C、苯酚钠溶液、NaHCO3溶液、乙醇钠 (盐酸) D、甲苯、乙醇、苯酚溶液 (酸性溶液)
-
13、温室气体在催化剂作用下可分解为和 , 也可作为氧化剂氧化苯制苯酚。下列说法不正确的是A、原子半径: B、第一电离能: C、在水中的溶解度:苯<苯酚 D、与的空间构型相同
-
14、物质的性质决定用途,下列两者关系对应不正确的是A、Na2CO3溶液呈碱性,可用作治疗胃酸过多的抗酸药物 B、铝合金质量轻、强度大,可用作制造飞机和宇宙飞船的材料 C、CuS、HgS极难溶,可用Na2S作沉淀剂除去废水中的Cu2+和Hg2+ D、碳化硅硬度大,可用作砂纸、砂轮的磨料
-
15、下列仪器可用于熔融NaCl晶体的是A、
 B、
B、 C、
C、 D、
D、
-
16、下列化学用语表示不正确的是A、的电子式:
 B、SO2的价层电子对互斥模型:
B、SO2的价层电子对互斥模型: C、的空间填充模型:
C、的空间填充模型: D、3,3-二甲基戊烷的键线式:
D、3,3-二甲基戊烷的键线式:
-
17、以下为一种以含铅废料(、、、、及炭黑)制备纳米PbO和的工艺流程。
已知:①炭黑是一种碳单质,化学性质比较稳定。
②、均为难溶于水的固体。
③易溶于水,电离方程式为。
 (1)、PbO具有碱性氧化物的性质,请写出过程I中PbO与稀硫酸反应的离子方程式。(2)、①过程I中,在催化下,Pb和反应生成的化学方程式是:。
(1)、PbO具有碱性氧化物的性质,请写出过程I中PbO与稀硫酸反应的离子方程式。(2)、①过程I中,在催化下,Pb和反应生成的化学方程式是:。②过程I中,催化过程可表示为:
i:
ii:…
写出ii的离子方程式:。
(3)、过程I过滤除去的物质是。(4)、①写出过程II主要反应的离子方程式。②结合复分解型离子反应的反应规律,说明可能具有怎样的性质。
(5)、过程II过滤除去的物质是。(6)、过程III所得滤液中检出 , 请简述过程III通入的作用。(7)、①生成纳米的离子方程式是。②生成纳米PbO的化学方程式是。
-
18、某同学设计了如图所示装置(夹持装置已省略)进行乙醇的催化氧化实验。先按图示安装好实验装置,关闭活塞a、b,在铜丝的中间部分加热片刻,然后通过控制活塞a和b,有节奏(间歇性)地通入气体。已知:乙醛可被氧化为乙酸,乙醛的沸点为乙酸的沸点为
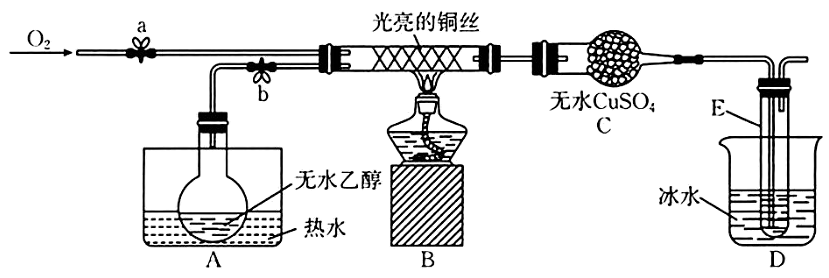
回答下列问题:
(1)、实验室常用快速制备氧气,写出的结构式:。(2)、从硬质玻璃管中可观察到受热的铜丝交替出现变黑、变红的现象,请写出实验过程中乙醇催化氧化的化学方程式:。实验开始后,实验小组将酒精灯去掉之后,依然能观察到铜丝交替出现变黑、变红的现象,试解释其原因:。(3)、实验中A和D均用到了水浴作用。A的作用是 , D的作用是。(4)、C中的实验现象是。(5)、经检测,实验小组发现E中收集到的液体除含有乙醛(易溶于水)外还含有杂质。要除去乙醛中的 , 可采取的方法为。(6)、该小组通过以上实验探究做出了如下猜想,你认为正确的是(填标号)。a.表面被氧化为黑色的铜丝在酒精灯焰心处灼烧,可闻到刺激性气味
b.乙醇催化氧化生成乙醛时,乙醇分子中只有O—H键发生断裂
c.利用金属钠能检验试管E中有没有未反应的乙醇
-
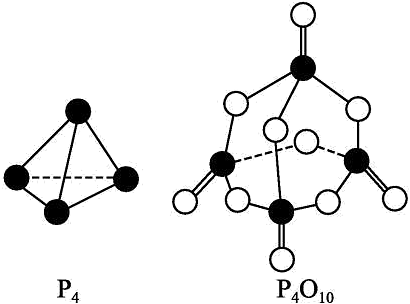
19、回答下列问题(1)、在25℃、101kPa下,1g甲醇()燃烧生成和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)、 ; , (填“>”、“<”或“=”),原因是(3)、已知拆开1molH-H键、1molN-H键、键分别需要的能量是436kJ、391kJ、946kJ,则与反应生成的热化学方程式为(4)、白磷与氧可发生如下反应:已知断裂下列化学键需要吸收的能量分别为如下:
化学键
P-P
P-O
P=O
O-O
O=O
键能(kJ/mol)
a
b
c
d
e
根据图示的分子结构和有关数据估算该反应的(用代数式表示)
 (5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。
(5)、肼可作为火箭发动机的燃料,与氧化剂反应生成和水蒸气。已知:①
②
写出肼和反应的热化学方程式
(6)、将0.3mol的气态高能燃料乙硼烷()在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 -
20、银锌纽扣电池是一种常见的化学电源,以Zn和Ag2O为电极,氢氧化钾溶液为电解质溶液,其电池反应为: , 装置示意图如下。
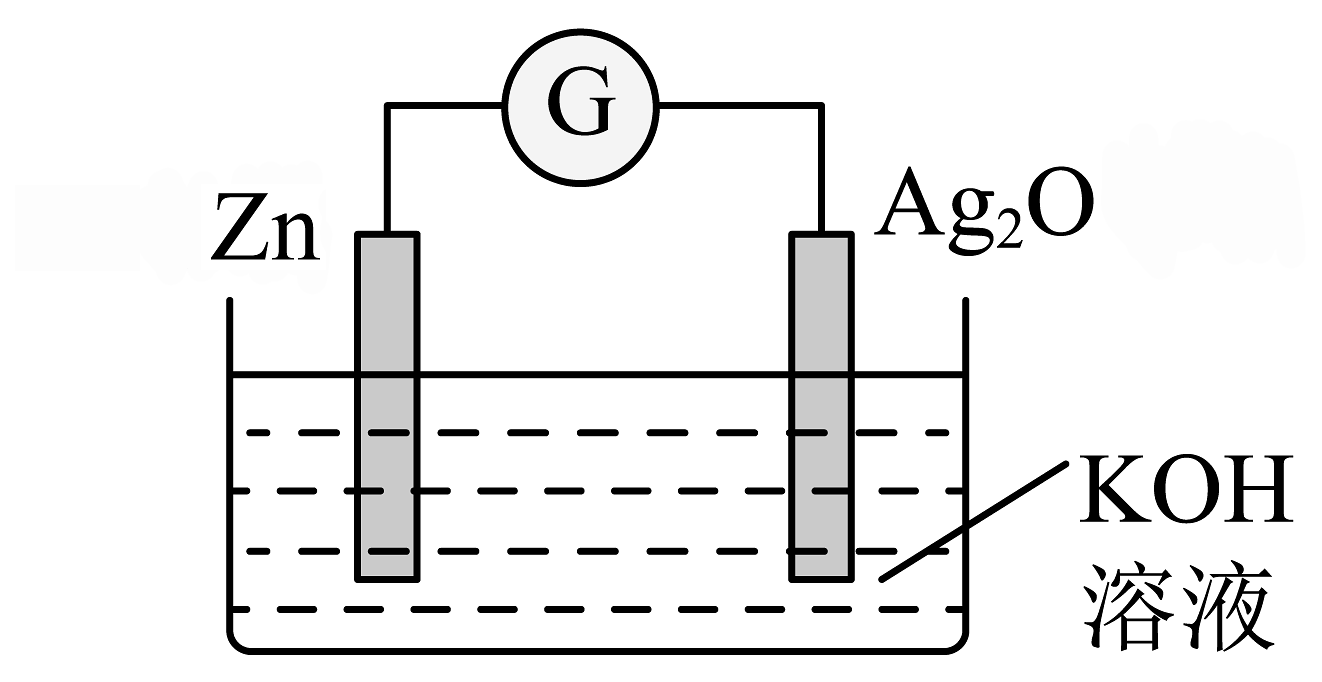
下列说法不正确的是
A、电池工作时化学能主要转化为电能 B、Zn电极是该电池的负极 C、Ag2O电极发生还原反应 D、电池工作时,电子从Zn经氢氧化钾溶液流向Ag2O