相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、
I、实验室制取氧气及性质检验
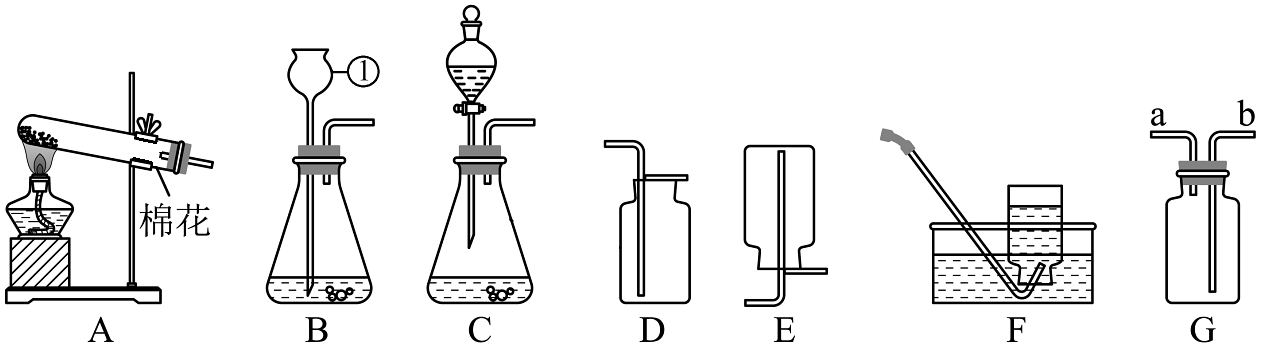 (1)写出装置中标号的仪器名称:①。(2)装置A可用于高锰酸钾制取氧气,反应的文字表达式是。(3)用排水法收集氧气时发现水槽中的水变为紫红色,可能的原因是。(4)若用D装置收集氧气,如何验满?。(5)乙炔是一种无色无味的气体,难溶于水,密度比空气小。实验室常用电石和饱和食盐水在常温下反应制得乙炔气体。为了控制反应速率和收集到较纯净的乙炔,可选用的发生和收集装置是(从A-F装置中选)。(6)G是一种可用于集气、检验、洗气等的多功能装置。若用G装置收集氢气,氢气应从(填“a”或“b”)进入G中;若将G装置内装满水,再连接量筒,就可以用于测定氢气的体积,则量筒与G装置(填“a”或“b”)连接。
(1)写出装置中标号的仪器名称:①。(2)装置A可用于高锰酸钾制取氧气,反应的文字表达式是。(3)用排水法收集氧气时发现水槽中的水变为紫红色,可能的原因是。(4)若用D装置收集氧气,如何验满?。(5)乙炔是一种无色无味的气体,难溶于水,密度比空气小。实验室常用电石和饱和食盐水在常温下反应制得乙炔气体。为了控制反应速率和收集到较纯净的乙炔,可选用的发生和收集装置是(从A-F装置中选)。(6)G是一种可用于集气、检验、洗气等的多功能装置。若用G装置收集氢气,氢气应从(填“a”或“b”)进入G中;若将G装置内装满水,再连接量筒,就可以用于测定氢气的体积,则量筒与G装置(填“a”或“b”)连接。II、自制简易制氧机
(7)原料选择:用过氧化氢溶液比高锰酸钾更合适的原因是(写一条)。(8)组装仪器:化学小组利用塑料瓶、注射器、吸管、输液管等设计并制作如图简易制氧机。下列说法错误的是(填序号)。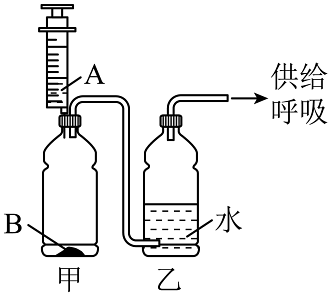
a.甲瓶是气体发生装置
b.试剂 B只能是二氧化锰
c.注射器可以控制滴加液体的速率
d.乙瓶可以使氧气湿润
-
2、在使用复印机和激光打印机时,你可能会闻到一股刺激性气味,这就是臭氧。这些设备工作时产生的高压静电可以将空气中的氧气转化为臭氧。臭氧常温常压下是淡蓝色的气体,少量臭氧具有消毒和净化空气的效果,这也是雨后空气清新的原因之一。臭氧层在高空能有效阻挡紫外线,保护生物。但在室内,高浓度的臭氧可能对呼吸道有刺激作用,长期接触高浓度的臭氧还可能造成人的神经中毒。常温常压下,臭氧的密度是空气的1.66倍,容易在办公室的下层空间聚集,因此,将打印机放在通风良好的地方很重要。(1)、臭氧的物理性质是(写出一条)。(2)、人们感觉雨后空气格外清新的原因可能是。(3)、氧气转变成臭氧的过程发生变化(填“物理”或“化学”),从物质的分类角度看,臭氧属于(填“单质”或“化合物”)。(4)、下列说法正确的是(填字母序号)。
a.臭氧会在办公室上层空间聚集
b.高空中的臭氧层能使地球上的生物免受紫外线危害
c.臭氧在少量时能用于消毒,在浓度较高时会使人致病
d.应尽量将激光打印机、复印机放在通风良好的地方使用
(5)、红磷在臭氧中燃烧与在氧气中燃烧相似,生成物相同,红磷在臭氧中燃烧的符号或文字表达式为。 -
3、“见著知微,见微知著”是化学思维方法。(1)、氯化钠是由(填写微粒的符号)构成。(2)、如图所示微粒A、B、C、D、E中,对应单质化学性质最稳定的是(填编号,下同),属于同一种元素的是 , 属于阳离子的是。
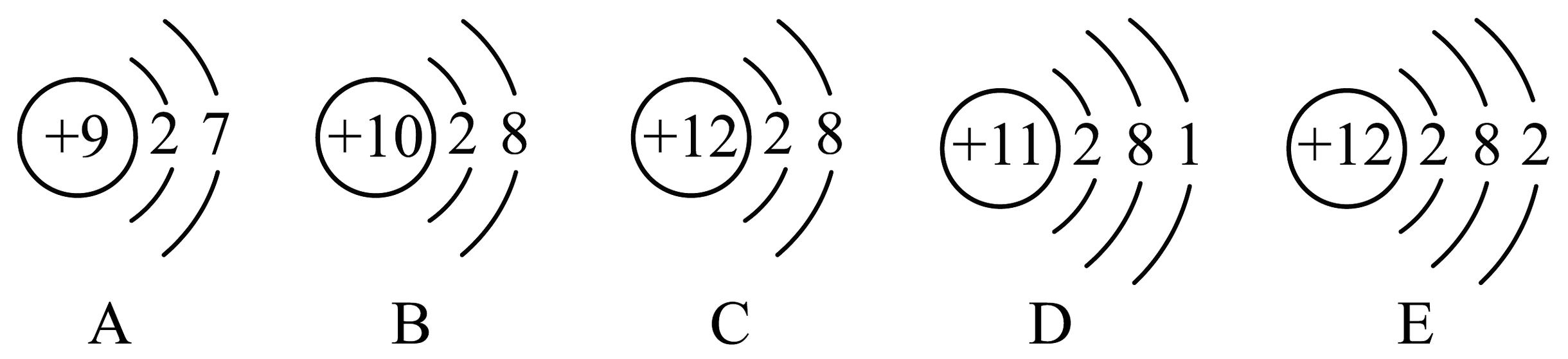 (3)、如下图所示,是某密闭容器中物质变化过程的微观示意图。
(3)、如下图所示,是某密闭容器中物质变化过程的微观示意图。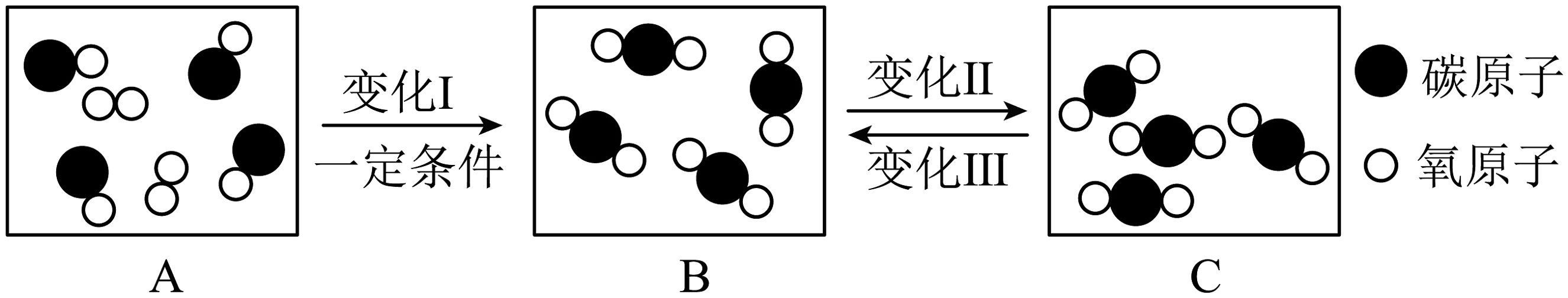
①A、B、C中表示混合物的是。
②变化I﹑II和Ⅲ中,属于化学变化的是 , 该反应属于(填基本反应类型)反应。
-
4、在实验室用高锰酸钾制取氧气的过程中,下列图像能正确表示对应变化关系的是A、
 B、
B、 C、
C、 D、
D、
-
5、逻辑推理是学习化学的一种方法,下列推理正确的是A、化合物中含有不同种元素,所以含不同种元素的物质都是化合物 B、具有相同质子数的微粒是同种元素 C、氧气是由氧元素组成的,所以制取氧气的物质一定含有氧元素 D、离子一定是带电的粒子,带电的粒子一定是离子
-
6、下列对某一主题知识归纳都正确的一组是
A.物质与微粒构成
B.物质鉴别
汞——由汞原子构成
氯化钠——由氯化钠分子构成
氮气和氧气——用燃着的木条
硬水和软水——观察是否澄清
C.化学与环境
D.实验安全
CO会引起全球气候变暖
SO2、NO2等气体会形成酸雨
酒精洒出在桌上燃烧——用湿布盖灭
药液溅入眼睛——立即用水冲洗
A、A B、B C、C D、D -
7、下列现象的微观解释中,不正确的是A、进入高原地区真空包装食品袋会鼓起,袋内的气体分子间隔增大 B、食物腐败过程中,分子本身发生变化 C、氢气和液氢都可做燃料,因为相同物质的分子,其化学性质相同 D、“热胀冷缩”现象说明分子的大小随温度的升降而变化
-
8、如图所示是小徐用手掌总结氧气化学性质的表示方法,手指上的物质能与手掌心的氧气反应。则下列说法正确的是
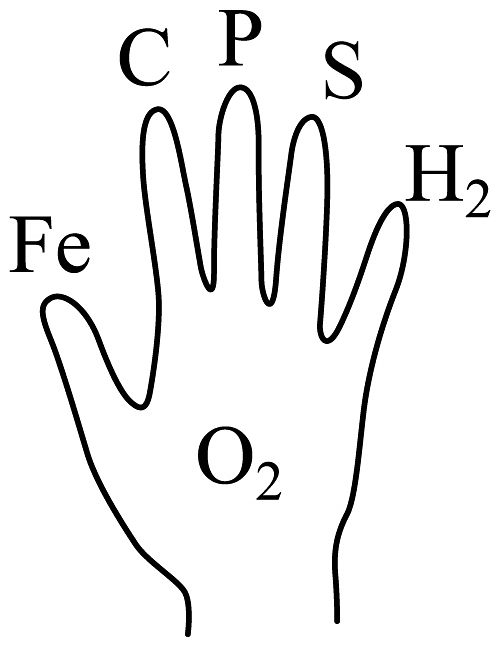 A、硫在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体 B、木炭燃烧生成的物质不能使澄清石灰水变浑浊 C、红磷燃烧产生大量的白雾 D、铁丝在空气中剧烈燃烧,火星四射
A、硫在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体 B、木炭燃烧生成的物质不能使澄清石灰水变浑浊 C、红磷燃烧产生大量的白雾 D、铁丝在空气中剧烈燃烧,火星四射 -
9、“劳动是幸福的源泉”。下列劳动实践与化学知识关联错误的是
选项
劳动实践
化学知识
A
用料包包裹佐料炖肉
利用了过滤的原理
B
用厨余垃圾自制花肥
物质发生缓慢氧化
C
用明矾净水
明矾的作用是消毒杀菌
D
氮气用于食品防腐
氮气的化学性质不活泼
A、A B、B C、C D、D -
10、化学是一门以实验为基础的学科。下列实验操作中,正确的是A、塞紧胶塞
 B、检查气密性
B、检查气密性 C、滴加液体
C、滴加液体 D、称量固体
D、称量固体
-
11、在测锑、铟等元素的相对原子质量方面做出卓越贡献的中国科学家是A、屠呦呦 B、张青莲 C、葛洪 D、侯德榜
-
12、下列标识与内容或相应位置、场所与标识不相符的是A、存放NaCl的试剂柜
 B、加油站
B、加油站 C、氢气储气罐
C、氢气储气罐 D、城市居民楼道
D、城市居民楼道
-
13、2024年六五环境日的主题为“全面推进美丽中国建设”,以下做法不符合这一主题的是A、生活垃圾分类处理 B、车辆尾气净化后排放 C、工业废气排放到高空 D、乘坐公交车绿色出行
-
14、俗语中常常蕴含着丰富的化学知识。下列俗语涉及化学变化的是A、铁杵磨成针 B、众人拾柴火焰高 C、摸着石头过河 D、秋风扫落叶
-
15、氢能源是最理想的“绿色能源”之一。我国氢能源的发展规划分为“灰氢”、“蓝氢”和“绿氢”三个阶段,具体如下图所示。

回答下列问题:
(1)、煤炭生成“灰氢”属于(填“物理变化”或“化学变化”)。(2)、在制备“绿氢”中,利用风力发电电解水制备氢气,其化学方程式为 , 若产生1000L氢气,能同时得到L的氧气。(3)、通过反应制备“蓝氢”,若制取4t氢气,理论上需要的质量为多少?(写出计算过程)(4)、是一种储氢材料,完全吸氢后得到和 , 单位质量的分解释放出氢气的质量随时间的变化如图2所示,其中温度、、由小到大的顺序是。
-
16、氨气是合成氮肥的重要原料,如图1所示是合成氨的新方法。
 (1)、i、传统方法是利用氮气和氢气在高温高压条件下生成氨气,该反应的化学方程式为。
(1)、i、传统方法是利用氮气和氢气在高温高压条件下生成氨气,该反应的化学方程式为。ii.反应器2:常温下,与发生的化学方程式为 , 反应前后氮元素的化合价(填“升高”“降低”或“不变”)。
iii.反应器3:一定条件下,可与发生反应产生和氢氧化锂,其中与的分子个数比为。
iv.氨气产率随反应所用电压的变化如图2所示,电压为V氨气产率最高。
(2)、流程中可循环利用的物质是 , 与传统方法相比,新方法的优点有(写一条)。 -
17、
为验证质量守恒定律,某兴趣小组做了以下实验进行探究。
【实验一】将水加入酒精中,一段时间后,称量混合液,质量仍为。
(1)该实验________(填“能”或“不能”)验证质量守恒定律,原因是________。
【实验二】如图1,用细铜丝吊着一根长玻璃棒,两端分别绕上粗铜丝,并使玻璃棒保持水平,然后用酒精灯给a端铜丝加热1~2分钟。

(2)冷却后,观察到铜丝变黑、玻璃棒________(填“a”或“b”)端下沉。
【实验三】称取镁条和陶土网的质量为(如图2所示),然后在空气中点燃镁条;反应结束后将所得物质与陶土网一起再次称量,质量为。
(3)写出镁条燃烧的化学方程式________。
(4)根据质量守恒定律可知:生成氧化镁的质量大于参加反应的镁条的质量;而实验事实是 , 可能原因是________。
【分析与总结】
(5)根据以上实验可知,验证质量守恒定律时对于有气体参加的反应,应在________容器中进行实验。
【拓展实验】
兴趣小组按如图3装置改进实验,验证了质量守恒定律,却发现产物白色固体中还有少量黄色固体。查阅资料得知:镁能与氮气剧烈反应生成黄色的氮化镁固体。
【反思与交流】
(6)空气中的含量远大于的含量,而镁条在空气中燃烧生成的却远多于 , 原因是________。
(7)图3实验中气球的作用有_____(填字母)。
A. 使装置密闭 B. 可缓冲气压 C. 防止橡皮塞被弹飞 -
18、下图是实验室常用的实验仪器与装置,回答下列问题。
 (1)、写出图中仪器I的名称:。(2)、实验室用高锰酸钾制取较纯净的氧气,应选择的发生和收集装置为 , 该反应的化学方程式为 , 最终收集到的氧气不纯的原因可能是;如用F装置来收集,氧气应从(填“a”或“b”)管通入。(3)、收集一瓶并进行性质检验。
(1)、写出图中仪器I的名称:。(2)、实验室用高锰酸钾制取较纯净的氧气,应选择的发生和收集装置为 , 该反应的化学方程式为 , 最终收集到的氧气不纯的原因可能是;如用F装置来收集,氧气应从(填“a”或“b”)管通入。(3)、收集一瓶并进行性质检验。操作
现象
结论

硫燃烧时,(填字母),生成刺激性气味的气体
a.产生大量白烟
b.发出淡蓝色火焰
c.发出蓝紫色火焰
具有氧化性
集气瓶中水的作用是。
(4)、我国新型战略核潜艇具备相当强的水下续航和高速航行能力,为了探究潜艇用制氧器,小亮以爆炸盐(溶于水会产生和)和为原料设计了以右图所示简易装置: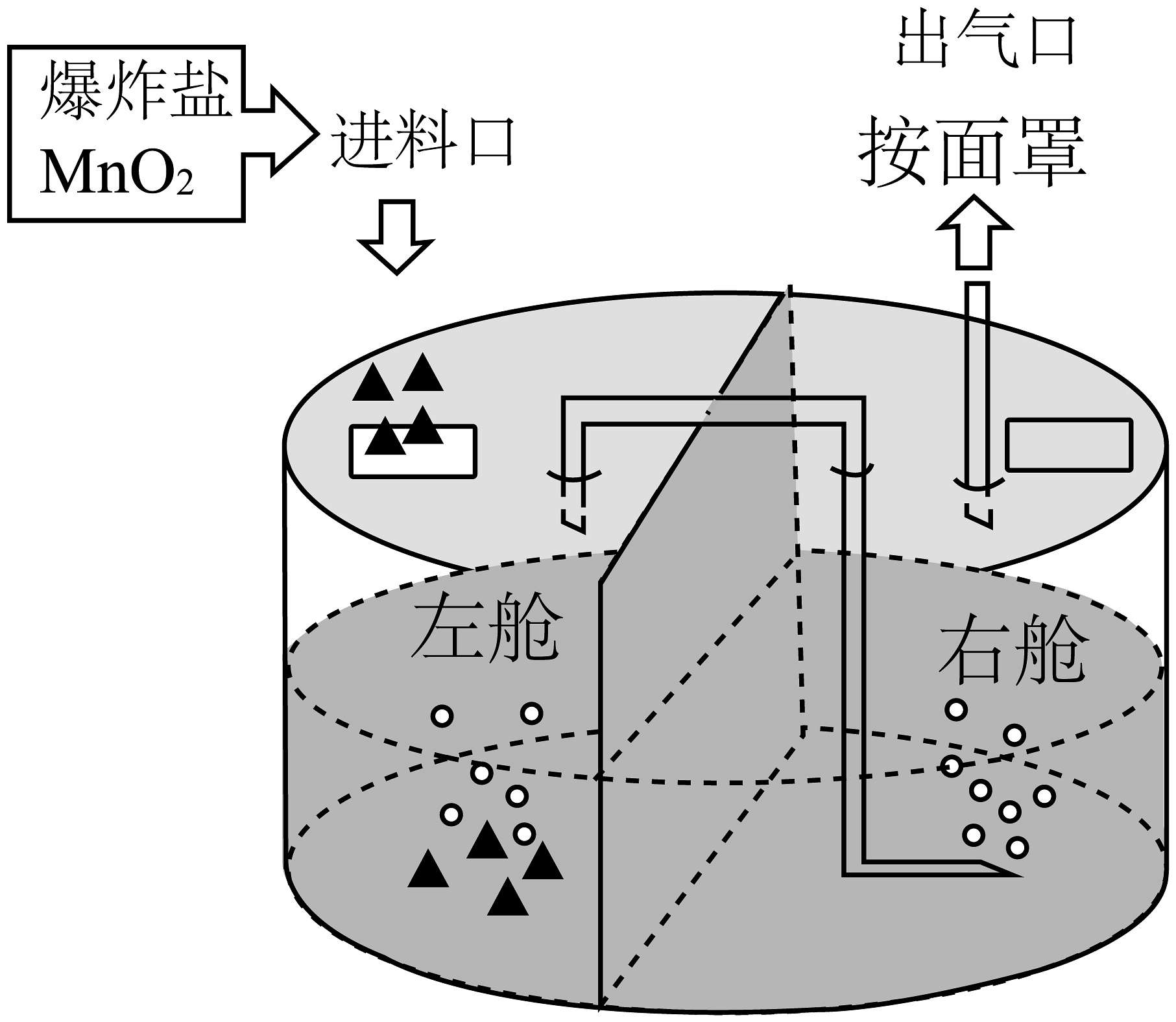
加料后,在反应中起作用。右舱中水的作用是(答出一个即可)。
-
19、二氧化氯是一种广谱、高效、无毒的杀菌剂,在污水处理、水产、食品加工等行业广泛应用。
工业生产中一般是用还原剂将氯酸钠等还原成 , 常见的还原剂有二氧化硫、盐酸、氯化钠、甲醇等,但均需在高酸度条件下反应,对设备要求较高,同时副产大量 , 产品纯度不高,后续处理费用较大。

用过氧化氢作还原剂,产品纯度高、反应速率快,并且副产氧气。现今正研究温度、压力、酸度以及和氯酸钠的质量比等对作还原剂生产的影响。其中温度对氯酸钠转化率和二氧化氯收率的影响如图所示。
实验表明,用作还原剂,在一定条件下能保证纯度100%的同时,氯酸钠的转化率大于88%,的收率在90%以上,解决以往各种方法中纯度、氯酸钠的转化率和收率不可兼得的问题。
依据文章内容回答下列问题:
(1)、二氧化氯()中氯元素的化合价为。(2)、现有的生产方法存在的问题有(写一条)。(3)、甲醇()中碳元素和氢元素的质量比为。(4)、用过氧化氢还原氯酸钠发生的反应,其化学方程式如下: , 由此推测X的化学式为;过氧化氢可用于实验室制取氧气,其化学方程式是。(5)、实验数据表明,温度对氯酸钠转化率的影响是。(6)、依据图像综合考虑,用过氧化氢作还原剂制备应选择的温度是。 -
20、鉴照古今变化,传承奋进力量。
 (1)、出行——明朝末年从南昌到北京约需半年时间,如今乘坐高铁几小时便可到达,制造高铁使用的铝合金中的铝由(选填“分子”、“原子”或“离子”)构成。(2)、记录——古代用墨书写的典籍保存至今也不变色,如今可将信息存储在芯片上,芯片中含有的某元素在元素周期表中的部分信息如图1所示,该元素的名称是 , 其相对原子质量为。(3)、净水——明代《天工开物》一书记载了明矾净水,钾原子的结构示意图如图2所示,钾原子易(填“得到”或“失去”)电子,写出明矾中钾离子的符号是;如今使用高铁酸钾()不仅能净水,还能消毒,其中高铁酸钾由种金属元素组成。(4)、工具:“一尺之棰,日取其半,万世不竭”是古代人对物质构成奥秘的表达;如今可以借助各种精密仪器探索,通过微观图示更清晰地表示物质的构成。提起压在容器中水面上方的活塞,容器中的水发生汽化(从液态变为气态),如图所示。
(1)、出行——明朝末年从南昌到北京约需半年时间,如今乘坐高铁几小时便可到达,制造高铁使用的铝合金中的铝由(选填“分子”、“原子”或“离子”)构成。(2)、记录——古代用墨书写的典籍保存至今也不变色,如今可将信息存储在芯片上,芯片中含有的某元素在元素周期表中的部分信息如图1所示,该元素的名称是 , 其相对原子质量为。(3)、净水——明代《天工开物》一书记载了明矾净水,钾原子的结构示意图如图2所示,钾原子易(填“得到”或“失去”)电子,写出明矾中钾离子的符号是;如今使用高铁酸钾()不仅能净水,还能消毒,其中高铁酸钾由种金属元素组成。(4)、工具:“一尺之棰,日取其半,万世不竭”是古代人对物质构成奥秘的表达;如今可以借助各种精密仪器探索,通过微观图示更清晰地表示物质的构成。提起压在容器中水面上方的活塞,容器中的水发生汽化(从液态变为气态),如图所示。
最能表示水汽化后相同空间内粒子分布的是_____(填字母)
A、 B、
B、 C、
C、 D、
D、