相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、2024年7月至8月巴黎奥运会召开。(1)、奥运村实现了5G网络的全覆盖。制造5G芯片的氮化镓(GaN)材料可由氯化镓(GaCl3)制取,两种物质中Ga的化合价相同,则其中N的化合价为。(2)、在乒乓球男单夺冠后,樊振东笑得十分开心,露出一口白牙。小苏打牙膏中含有单氟磷酸钠(Na3PO3F),单氟磷酸钠在口腔唾液的作用下产生氟离子,从而对牙齿起防龋作用,氟是人体所需的(填“常量”“微量”或“非必需")元素。(3)、奥运会对水能源。材料需求量很大,下列有关说法正确的是___________ (填字母序号)。A、硬水含较多可溶性钙、镁化合物,易导致锅炉管道变形或损坏 B、含碳燃料不完全燃烧会产生有毒的CO,CO转化为CO2只能通过和氧气反应 C、建设场馆用到的水泥,属于无机非金属材料(4)、场馆的建设使用了大量的铝、铁铜等金属材料,铝作为生活中使用量较多的金属,除建筑中用到铝外。铝还可能的用途有。将过量Fe粉加Al(NO3)3和Cu(NO3)2的混合溶液中。充分反应后溶液颜色变化情况为反应结束后过滤。滤渣中一定有。
-
2、钻(Co)的金属活动性与铁相似,钴的化合物相关性质如下表。下列预测合理的是
物质
CoO
Co(OH)2
CoCl2
CoCO3
溶解性
难溶,灰绿色固体
难溶,粉红色固体
易溶,溶液呈粉红色
难溶,粉红色固体
A、Co能从AgCl中置换出Ag B、CoO能与盐酸发生复分解反应得到浅绿色溶液 C、Co(OH)2能使酚酞试液变红 D、CoCO3与盐酸混合产生气泡,溶液变为粉红色 -
3、过氧乙酸(CH3COOOH)可以用于杀灭病毒。下列关于过氧乙酸的说法,正确的是A、过氧乙酸由三个元素组成 B、过氧乙酸中碳、氢、氧元素的质量比为2:4:3 C、过氧乙酸相对分子质量为76 D、过氧乙酸属于无机化合物
-
4、一种纳米纤维催化剂可将CO2转化成液体燃料甲醇(CH3OH),有利于实现政府工作报告中提出的“碳达峰”“碳中和”。其微观示意图如下(图中微粒恰好完全反应)。下列说法错误的是
 A、丙、丁的分子个数比1:2 B、丁的化学式为H2O C、反应中每消耗22 g二氧化碳,同时生成16g甲醇 D、反应的实质是分子分解为原子,原子重新组合为新分子
A、丙、丁的分子个数比1:2 B、丁的化学式为H2O C、反应中每消耗22 g二氧化碳,同时生成16g甲醇 D、反应的实质是分子分解为原子,原子重新组合为新分子 -
5、为助力实现“碳达峰”碳中和"。工业生产中可用NaOH吸收CO2生成Na2CO3.NaOH和Na2CO3的溶解度如下表:
温度/℃
0
20
40
60
80
100
溶解度/g
NaOH
40
109
129
174
314
347
Na2CO3
7
21.5
49
46
43.5
45.5
根据表中数据判断,下列说法正确的是
A、Na2CO3溶解度随温度升高而增大 B、40时,向100 g水中加入135 g NaOH可能全部溶解 C、NaOH和Na2CO3溶解度曲线在0~100℃范围内没有交点 D、0℃时,向140 g NaOH饱和溶液中通入CO2使其全部转化为Na2CO3 , 析出固体为46 g -
6、生活中处处有化学。下列说法错误的是A、为节约粮食,发霉的大米经过浸泡、淘洗后可以食用 B、为使发面食品松软可口,制作时可添加适量的小苏打 C、锌是人体中必需的微量元素,缺锌会食欲不振 D、用灼烧法可以区分棉纤维与羊毛纤维
-
7、碳酸锶(SrCO3)可用于制造红色焰火、荧屏玻璃等,其化学性质与CaCO3相似。化学兴趣小组为测定某SrCO3固体样品中SrCO3的质量分数,先将10g样品放入质量为50g的锥形瓶中,再逐滴加入稀盐酸充分反应(如图所示)。反应过程中测得滴加稀盐酸的总质量与充分反应后锥形瓶及瓶内剩余物质总质量的数据如下表所示(该样品中杂质不溶于水,也不与酸反应)。回答下列问题。
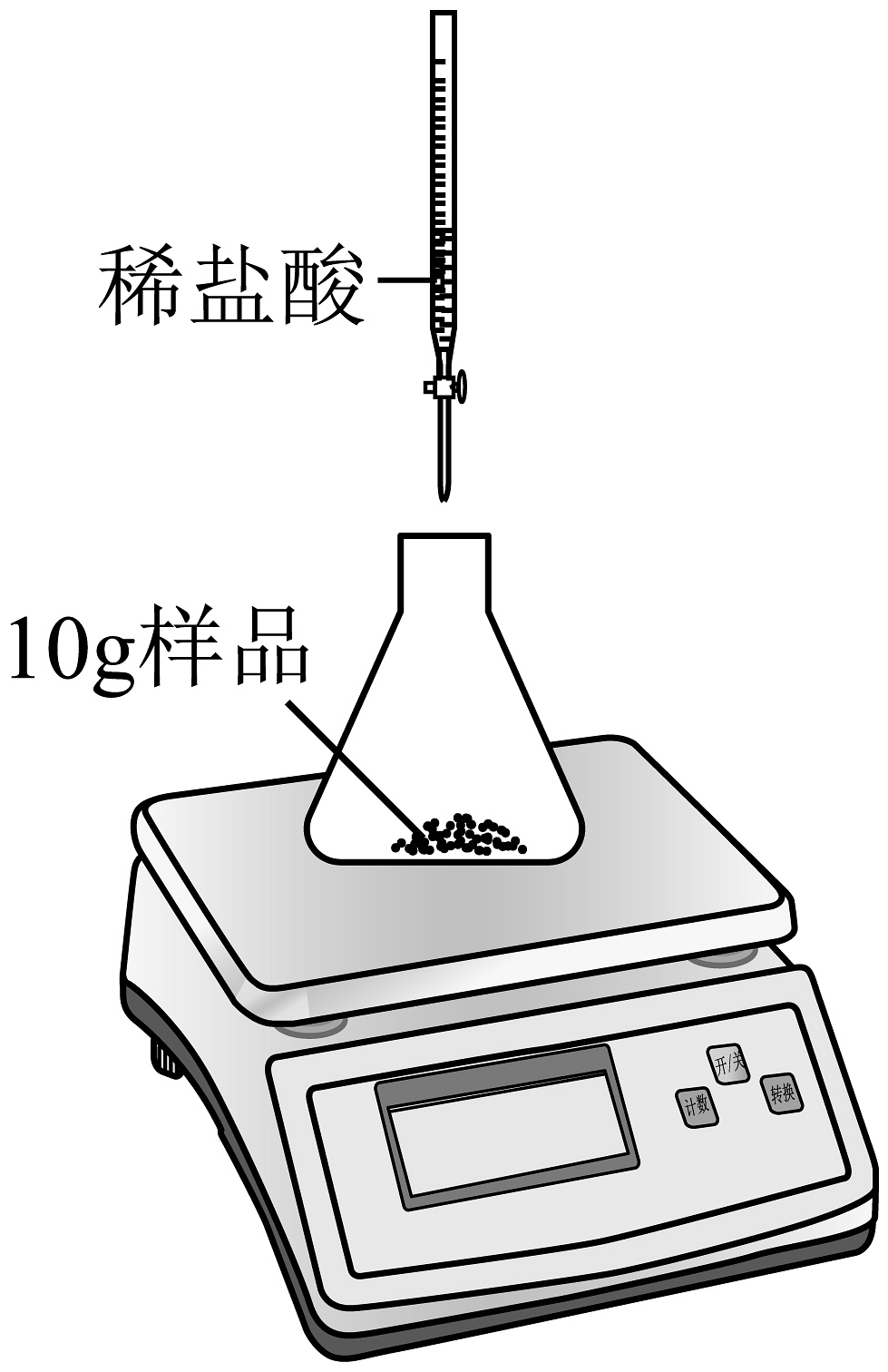
加入稀盐酸的总质量/g
0
10
25
35
锥形瓶及瓶内剩余物质总质量/g
60.00
69.12
82.80
92.36
(1)、10g该SrCO3样品与稀盐酸恰好完全反应时,消耗的稀盐酸的总质量是产生二氧化碳的总质量是。(2)、该样品中碳酸锶的质量分数为多少(写出具体计算过程)?(3)、这种测定方法产生误差的原因可能是(任写1条)。 -
8、
“回南天”是南方独特的气候现象。“回南天”出现时,空气湿度接近饱和,家用除湿盒可以除湿防霉。某兴趣小组对家用除湿盒(如图1)产生兴趣,于是进行如下探究。

[查阅资料]①吸湿区内黑色颗粒是活性炭,白色颗粒是初中化学常见的一种物质,具有很强的吸水性;②CaCl2溶液呈中性。使用一段时间后,集水区内有大量液体和少量固体,且气温越低固体越多。
(1)除湿盒内活性炭的作用是除去空气中的异味,利用了其。
[提出问题]除湿盒中的白色颗粒是什么?
[作出猜想]在老师的提示下,同学们猜测吸湿区内的白色颗粒可能是氯化钙、氧化钙、氢氧化钠中的一种。
[交流讨论]
(2)同学们从安全角度考虑,一致认为白色颗粒不可能是NaOH,原因是。
[进行实验]
(3)为确定该白色颗粒的成分,同学们进行如下实验:
实验操作
实验现象
实验结论
①取少量白色颗粒于试管中,加足量水溶解,向溶液中滴加紫色石蕊溶液
该白色颗粒为氯化钙
②另取少量白色颗粒于试管中,加足量水溶解,向溶液中滴加
有白色沉淀产生
[实验分析]
(4)步骤②中发生反应的化学方程式为:。
[实验反思]
(5)由集水区的固体会随温度降低而越来越多可知:CaCl2的溶解度会随温度升高而(选填“增大”或“减小"”)。
[继续探究]生石灰也有吸水性,能否代替氯化钙作除湿剂?为探究这个问题,小组同学分别称取5.0g氯化钙和生石灰进行吸湿率测定实验,氯化钙与生石灰在吸湿实验中的数据记录如图2所示。

已知:吸湿率=×100%
(6)最终氯化钙的吸湿率为。结合以上探究结果,能得出的结论是的吸湿效果好,不能用生石灰代替(写一个即可)。
-
9、实验中常见气体制备、净化、干燥、收集的部分仪器如图所示,请回答下列问题。
 (1)、在装置A中使用仪器①时的注意事项是。(2)、实验室制取二氧化碳的化学方程式为:。如果要用装置E收集二氧化碳,则气体应从导管口(选填“a”或“b")通入。(3)、若用锌粒和稀盐酸反应制取氢气,收集到的氢气往往不纯,其中含有的杂质是(填物质名称),若想要得到纯净的氢气,则仪器连接的顺序是A→→→C。(4)、用装置A、D制取氧气,由于试剂不足,没有收集满一瓶氧气,在不拆解装置、不添加反应物的情况下,想要多收集一些氧气,接下来应进行的操作是。
(1)、在装置A中使用仪器①时的注意事项是。(2)、实验室制取二氧化碳的化学方程式为:。如果要用装置E收集二氧化碳,则气体应从导管口(选填“a”或“b")通入。(3)、若用锌粒和稀盐酸反应制取氢气,收集到的氢气往往不纯,其中含有的杂质是(填物质名称),若想要得到纯净的氢气,则仪器连接的顺序是A→→→C。(4)、用装置A、D制取氧气,由于试剂不足,没有收集满一瓶氧气,在不拆解装置、不添加反应物的情况下,想要多收集一些氧气,接下来应进行的操作是。 -
10、用预处理后的硫铁矿烧渣(主要成分为Fe2O3 , 含少量不溶性杂质)制备碳酸亚铁的流程如图。

已知:Na2CO3溶液呈碱性。
(1)、“酸浸”时,为提高铁元素的浸出率,可采取的措施是(任写一条)。(2)、“还原”时,加入铁粉,溶液由黄色变为浅绿色,同时有无色气体生成。该过程发生的两个化学方程式为:、。由上述方程式可知,“酸浸”所得溶液中含有的阳离子是(填离子符号)。(3)、“操作1”是为了除去过量的铁粉和不溶性杂质。“操作1”是(填操作名称)。(4)、“沉铁”时,反应原理为该反应的基本类型为。待FeSO4完全反应后,过滤,洗涤。洗涤前,FeCO3沉淀表面吸附的主要杂质是(填化学式)。 -
11、I、新能源车因污染小而被大力推广,请你参加社会性议题“汽车能源的变迁”的项目式学习。(1)、传统汽车能源主要来自石油,从物质类别的角度来看,石油属于(选填“纯净物”或“混合物”)。(2)、天然气和乙醇可替代传统汽车能源。乙醇充分燃烧的化学方程式为:。(3)、电池可给新能源汽车提供动力。
①电动汽车的电池放电时,其能量转化为能转化为电能。
②新能源汽车常使用含磷酸亚铁锂(LiFePO4)的锂电池为汽车提供动力。LiFePO4中Li的化合价为。某种锂原子的质量为1.165×10-26kg,碳12原子质量的为1.66×10-27kg,则该锂原子的相对原子质量是(计算结果精 确到0.1)。
③磷酸亚铁锂可用磷酸铁、氢氧化锂和草酸为原料合成,请完成下列化学方程式:2FePO4+6H2C2O4+ 2LiOH=2LiFePO4+ 7CO2↑+5CO↑+7。
(4)、II、同学们利用如图1所示的装置探究水的组成。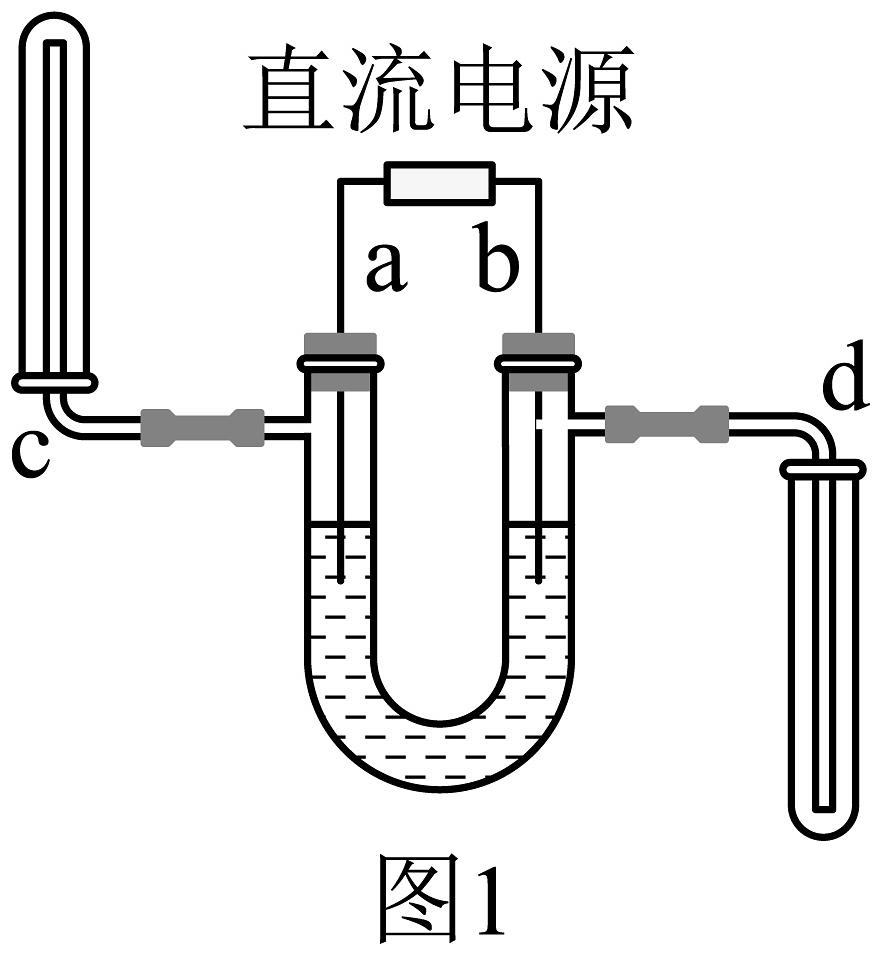
①电源正极为(选填“a” 或“b”)端,电解水发生反应的化学方程式为:。
②c、d管中收集到的气体的质量比为
(5)、在不同温度下,向盛有50g水的烧杯中缓慢加入硫酸铜固体,测得溶液质量与加入硫酸铜质量的变化关系如图2所示。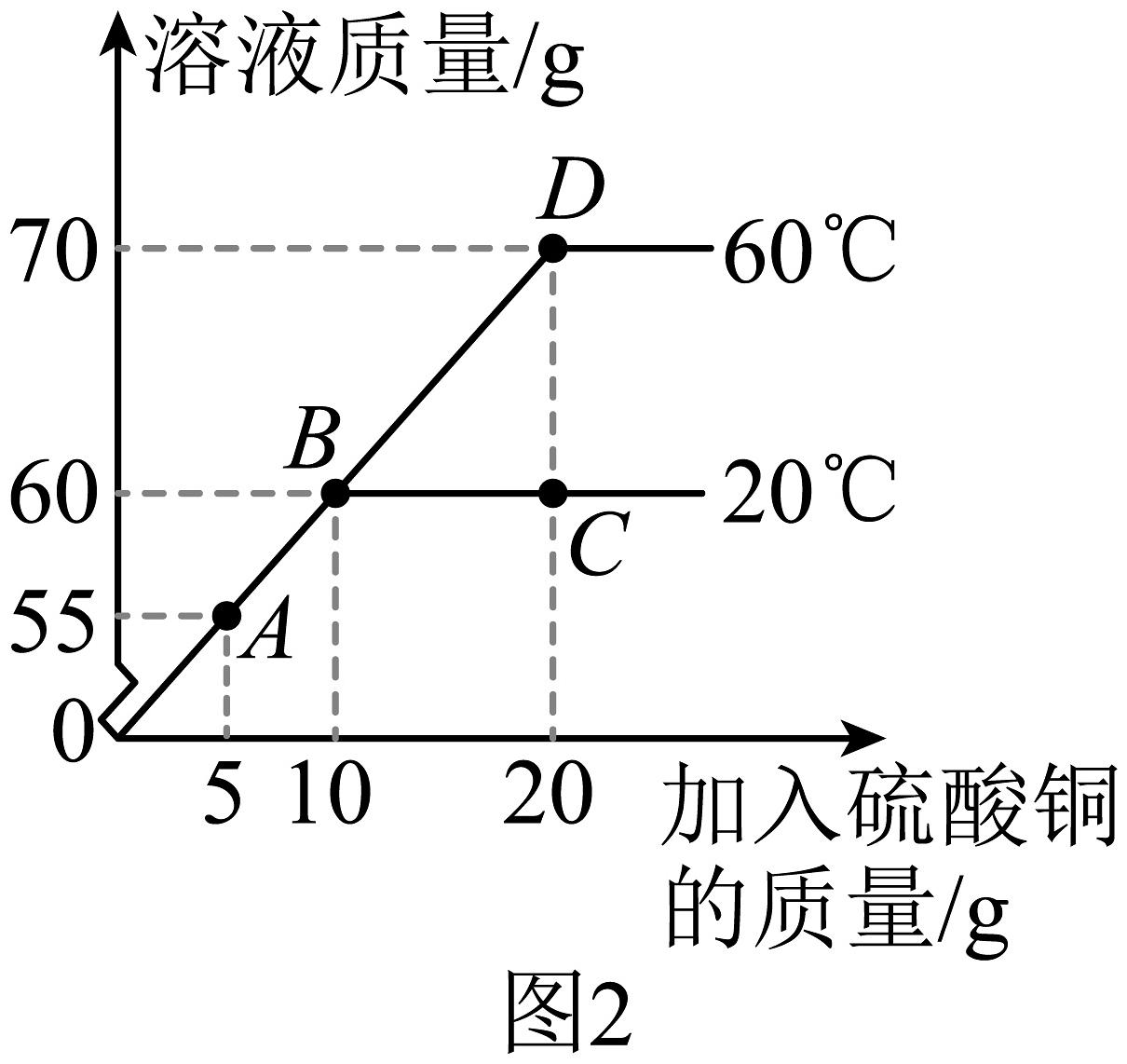
①20℃时硫酸铜的溶解度为
②20℃时,A、B、C三点对应的溶液中属于饱和溶液的是
③C、D两点对应溶液中溶质质量分数的大小关系为。
-
12、工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
①
②
③
④
下列说法不正确的是
A、反应①②③均有元素化合价发生变化 B、反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应 C、将5g SO2溶于95g水形成溶液,其溶液的质量分数大于5% D、将100g蒸馏水加入100g 98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸 -
13、同学们设计的下列实验方案(夹持装置已略去),能达到实验目的的是
选项
A
B
C
D
实验目的
探究空气中氧气的含量和铁生锈的条件
比较合金与其成分金属的硬度
验证质量守恒定律
探究CO2与水反应
实验方案



 A、A B、B C、C D、D
A、A B、B C、C D、D -
14、我国研发出一项将甲烷(CH4)转化成乙烷的新技术,涉及的物质种类变化示意图如图所示。下列说法正确的是
 A、该反应的化学方程式为 B、甲烷、乙烷都是最简单的有机化合物 C、该反应中的最小粒子是分子 D、反应前后,催化剂的质量和性质不变
A、该反应的化学方程式为 B、甲烷、乙烷都是最简单的有机化合物 C、该反应中的最小粒子是分子 D、反应前后,催化剂的质量和性质不变 -
15、幸福需要辛勤的劳动来创造。下列劳动项目与涉及的化学知识不相符的是
选项
劳动项目
化学知识
A
冬季向路上的积雪撒盐
盐水使雪的熔点降低
B
用食醋洗去水壶中的水垢
醋可与碳酸钙等发生反应
C
用明矾处理较浑浊的天然水
明矾主要起杀菌消毒的作用
D
用石灰浆粉刷墙壁
石灰浆与CO2反应
A、A B、B C、C D、D -
16、搭载天舟七号货运飞船的长征七号遥八运载火箭在我国文昌航天发射场点火发射。下列火箭发射流程中主要涉及化学变化的是A、关闭舱门 B、燃料注入 C、点火发射 D、瞄准定位
-
17、实验室有一瓶已经部分变质的固体,现向锥形瓶中加入10g这种部分变质的样品,再加入溶质质量分数为的稀盐酸溶液,产生气体的质量与加入砸盐酸溶液的质量关系如图所示:
 (1)、与反应消耗的稀盐酸的质量为g。(2)、b点溶液中的溶质是(填化学式)。(3)、求原样品中的质量分数(写出计算过程)。
(1)、与反应消耗的稀盐酸的质量为g。(2)、b点溶液中的溶质是(填化学式)。(3)、求原样品中的质量分数(写出计算过程)。 -
18、海水中含有丰富的化学资源,可提取食盐等一系列化工产品。

已知:粗盐中的杂质有泥沙、氯化钙、氯化镁
(1)、溶解池中搅拌器的作用是____,为了除去杂质,需要加入过量除杂试剂。下列可以作为除杂试剂的是____。A、溶液 B、NaOH溶液 C、溶液 D、溶液(2)、盐泥的主要成分泥沙、CaCO3和(填化学式)(3)、在滤液中加入调节pH,直到可以开始蒸发,用pH试纸测滤液pH的操作是。在调节pH过程中,滤液中有气泡产生,写出产生气泡的化学方程式。(4)、蒸发结晶时,当滤液中出现时即停止加热。(5)、在粗盐提纯过程中,得到氯化钠晶体质量(填“大于”、“等于”或“小于”)粗盐中氯化钠的质量。 -
19、【科学探究】
食品包装袋中的脱氧剂可以起到吸氧防腐的作用。其主要成分包括活性炭、铁粉和氯化钠。某兴趣小组对脱氧剂的成分进行探究。
(1)、分离、提取氯化钠分离、验证铁粉。用磁铁靠近干燥的黑色滤渣,一部分固体被吸引,取少量被磁铁吸引的固体于试管中,加入足量的硫酸铜溶液,观察到的现象,证明固体为铁粉,试管中反应的化学方程式为。
(2)、分离、验证活性炭。取少量末被磁铁吸引的固体进行如图所示实验,观察到的现象,证明固体为活性炭。澄清石灰水中所发生反应的化学方程式为。 (3)、深入探究脱氧剂。
(3)、深入探究脱氧剂。①失效后的脱氧剂中存在红棕色固体,该固体易溶于盐酸,反应的化学方程式是。
②已知:Fe粉易溶于FeCl3溶液,发生反应。将部分失效的脱氧剂加入到过量的盐酸中充分反应后,溶液中一定存在的盐为 , 可能存在的盐为.
-
20、如图是实验室常用的部分实验装置,请回答下列问题:
 (1)、写出仪器b的名称。(2)、实验室制取二氧化碳,想要随时控制反应的发生和停止,应该选择的发生装置是。(3)、使用A装置加热高锰酸钾制取氧气时,还需要添加的实验用品是。想要测量生成氧气的体积,应该先将F装置 , 然后在(填“c”或“d”)端接一个量筒。
(1)、写出仪器b的名称。(2)、实验室制取二氧化碳,想要随时控制反应的发生和停止,应该选择的发生装置是。(3)、使用A装置加热高锰酸钾制取氧气时,还需要添加的实验用品是。想要测量生成氧气的体积,应该先将F装置 , 然后在(填“c”或“d”)端接一个量筒。为践行“碳中和”理念,同学们组织了关于的捕集、封存与利用的研讨会
(4)、捕集:吸附法是利用固态吸附剂对气体进行可逆吸附来分离回收 , 该吸附剂具有结构。(5)、利用:与工业生成过程中,可将二氧化碳和氨气在一定条件下合成尿素【】和水,写出该反应的化学方程式。(6)、封存:与天然矿石中MgO反应,生成能长期稳定存在的碳酸镁,从而储存 , 该反应属于(填基本反应类型)。(7)、低碳行动:低碳生活,从你我做起。请说出一条低碳行动措施:。