相关试卷
- 江苏省扬州市江都区2016-2017学年九年级上学期化学期末考试试卷
- 江苏省苏州市高新区2016-2017学年九年级上学期化学期末考试试卷
- 江苏省常州市2016-2017学年九年级上学期化学期末考试试卷
- 江苏省苏州市工业园区2017-2018学年九年级上学期化学12月调研考试试卷
- 江苏省扬州市江都区五校2017-2018学年九年级上学期化学期中考试试卷
- 江苏省扬州市邗江区2017-2018学年九年级上学期化学期中考试试卷
- 江苏省泰州市医药高新区2017-2018学年九年级上学期化学期中考试试卷
- 江苏省常州市金坛区2017-2018学年九年级上学期化学期中质量调研考试试卷
- 江苏省扬州实验学校2017-2018学年九年级上学期化学期中考试试卷
- 江苏省苏州市相城区2015-2016学年九年级化学一模考试试卷(4月)
-
1、人类发展离不开化学家的贡献,下列有关化学发展简史说法不正确的是A、拉瓦锡发现了酸碱指示剂 B、屠呦呦因研究青蒿素获诺贝尔奖 C、侯德榜是我国制碱工业的先驱 D、张青莲为相对原子质量的测定作出了卓越贡献
-
2、地球表面约有71%被水覆盖,但可供人类使用的淡水总量却不足总水量的1%。下列有关说法正确的是A、水变成水蒸气的过程中水分子体积变大 B、活性炭能吸附水中的杂质,降低水的硬度 C、地球上水资源极其丰富,不存在水危机 D、自来水厂通常对天然水进行沉降、过滤、灭菌等净化操作生产自来水
-
3、下列方程式的书写及基本反应类型都正确的是A、用铁丝测量空气中氧气的含量:化合反应 B、电解水研究水的组成:分解反应 C、赤铁矿石冶炼成铁的主要原理:置换反应 D、熟石灰作建筑材料:复分解反应
-
4、2024年2月23号南京市雨花台区发生火灾,起火原因是架空层电动自行车起火引发所致,该事故已经造成15人死亡,44人受伤。该事件再次敲响了安全警钟,消防安全,人人有责。下列有关消防安全做法正确的是A、高层住宅一旦发生火灾,立即乘坐电梯逃离 B、规范电动车停放,不在小区内私接电线充电 C、电线老化短路起火,用水浇灭 D、遇到室内起火,迅速打开门窗通风
-
5、化学是一门以实验为基础的学科。下列实验操作中正确的是A、气密性检验
 B、验满
B、验满 C、蒸发
C、蒸发 D、测pH
D、测pH
-
6、端午节是中华传统节日,下列活动属于化学变化的是A、包粽子 B、赛龙舟 C、挂菖蒲 D、熏艾草
-
7、造纸术是我国四大发明之一。北宋诗人曾对“敲冰纸”写下“寒溪浸楮舂夜月,敲冰举帘匀割脂”的赞美诗句。该造纸的部分生产情景如图所示。
 (1)、“寒溪浸楮”意思为“在寒冷的 ( 表面结冰 ) 溪水中浸泡楮树皮”。用纯度较高的水浸泡有利于制得质量上佳的纸张,说明冬天气温低,水中可溶性杂质溶解度(选填“大”或“小”)。(2)、“楮”指树皮,树皮属于(选填“天然”或“合成”)有机高分子材料,“舂捣”的过程属于(选填“物理”或“化学”)变化。(3)、纸浆在竹帘中均匀铺开,水从竹帘缝隙流出,纸浆留在竹帘上。据此推测竹帘的缝隙应(选填“大于”或“小于”)纸浆大小。(4)、现代工业造纸会用到元明粉(主要成分为 Na2SO4)。现获得一定量的该样品,加水使其完全溶解,利用下述反应测定 Na2SO4的质量:Na2SO4 + BaCl2= BaSO4 ↓+ 2NaCl。样品充分反应后得到沉淀 23.3 g,请计算该样品中 Na2SO4的质量。(写出计算过程)
(1)、“寒溪浸楮”意思为“在寒冷的 ( 表面结冰 ) 溪水中浸泡楮树皮”。用纯度较高的水浸泡有利于制得质量上佳的纸张,说明冬天气温低,水中可溶性杂质溶解度(选填“大”或“小”)。(2)、“楮”指树皮,树皮属于(选填“天然”或“合成”)有机高分子材料,“舂捣”的过程属于(选填“物理”或“化学”)变化。(3)、纸浆在竹帘中均匀铺开,水从竹帘缝隙流出,纸浆留在竹帘上。据此推测竹帘的缝隙应(选填“大于”或“小于”)纸浆大小。(4)、现代工业造纸会用到元明粉(主要成分为 Na2SO4)。现获得一定量的该样品,加水使其完全溶解,利用下述反应测定 Na2SO4的质量:Na2SO4 + BaCl2= BaSO4 ↓+ 2NaCl。样品充分反应后得到沉淀 23.3 g,请计算该样品中 Na2SO4的质量。(写出计算过程) -
8、碳酸钙是常见的补钙剂之一。小圳查阅资料发现鸡蛋壳中含有碳酸钙,于是尝试通过利用生活中常见的鸡蛋壳自制碳酸钙“钙片”,实现蛋壳中钙源的回收利用,达到变废为宝的目的。
经研究,目前存在家庭、实验室及工业场景下利用蛋壳制备碳酸钙的四种实验方案,具体如下图所示。

查阅资料:鸡蛋壳中含有碳酸钙及其他杂质,其他杂质不溶于水且不参与反应。
(1)、蛋壳要进行粉碎操作的目的是。(2)、操作③中反应的化学方程式为。(3)、操作 1 的名称是。(4)、蛋壳粉在高温条件下分解为氧化钙及另一种氧化物,该反应的化学方程式为。(5)、要检验燃气灶高温煅烧鸡蛋壳得到的粉末中是否含有氧化钙,请填写如下表格:操作
将高温煅烧后的粉末溶解于水中,静置,取上层清液于试管中,
现象
结论
燃气灶高温煅烧鸡蛋壳得到的粉末中含有氧化钙
-
9、深圳积极探索破解“垃圾问题”,走出了一条“无害化、减量化、资源化”的垃圾处理之路。
为深入了解垃圾处理流程与环保理念,某学校组织同学们参观深圳某垃圾分类处理厂,并完成以下任务。
任务一:认识垃圾的分类
(1)、同学们参观深圳某垃圾分类处理厂,获悉城市生活垃圾可分为可回收物、有害垃圾、厨余垃圾和其他垃圾。下列垃圾属于可回收物的是____。(填字母序号)A、塑料 B、果皮 C、旧电池(2)、任务二:了解垃圾处理方式小深同学在参观完垃圾分类处理厂后,绘制了各类垃圾处理方式的流程图(如图 1 所示):

生锈铁制品是最常见的可回收物,可通过与稀盐酸反应除锈,其反应的化学方程式为。
(3)、厨余垃圾堆肥有助于提高土壤肥力。学习小组设计的小型堆肥桶如图 2 所示,堆肥桶加盖是提供(选填“有氧”或“无氧”)环境,有利于发酵。查阅资料,不同温度和发酵液浓度对厨余垃圾发酵产生沼气性能的影响如图 3 所示。分析图中数据可知发酵液浓度与池溶产气率的关系:。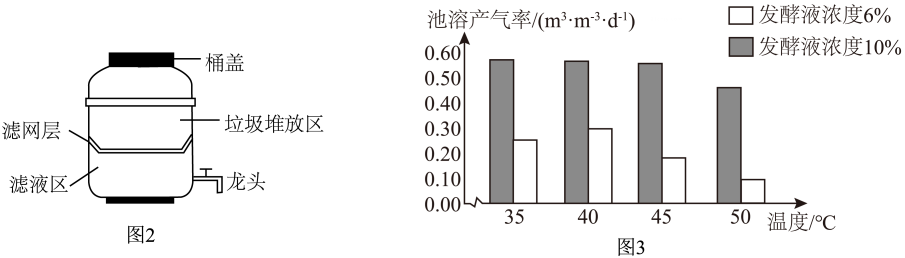 (4)、部分垃圾中存在有害物质,如破损的体温计里有重金属(填化学式),会通过水、土、空气进入人体,引起各种疾病。(5)、任务三:探究塑料垃圾焚烧后所产生气体的成分组成
(4)、部分垃圾中存在有害物质,如破损的体温计里有重金属(填化学式),会通过水、土、空气进入人体,引起各种疾病。(5)、任务三:探究塑料垃圾焚烧后所产生气体的成分组成【查阅资料】 a. 塑料焚烧时会产生多种有害气体,其中含氯元素的塑料焚烧后会产生HCl 气体;
b. 若往溶液中滴加硝酸银溶液和稀硝酸,产生白色沉淀,说明该溶液含有 Cl-。
【提出问题】某塑料垃圾焚烧后产生的气体中是否含有 HCl?
【实验验证】
实验步骤
实验现象
实验结论
①取少量该垃圾置于焚烧炉中进行焚烧,将焚烧产生的气体通入水中
该垃圾焚烧产生的
气体中含有HCl
②取步骤①所得溶液于试管中,向其中滴加紫色石蕊溶液
紫色石蕊溶液变为红色
③另取步骤①所得溶液于试管中,向其中滴加适量硝酸银溶液和稀硝酸
(6)、【交流探讨】结合日常生活经验进行交流,写出一条防止塑料污染的措施:。
-
10、为应对 CO2 等温室气体引起的气候变化问题,我国提出争取 2030 年前达到碳达峰,2060年前实现碳中和的目标。碳替代、碳减排、碳封存、碳循环是实现碳中和的 4 种主要途径。科学家预测,到 2050 年,4 种途径对全球碳中和的贡献率如图 1。

在工业领域,CO2 资源化利用备受关注,其中将 CO2 转化为甲醇 (CH3OH) 是重要方向之一。
CO2 和氢气在一定条件下发生反应,生成甲醇和一种常见的液体氧化物;为探究不同条件对该反应的影响,科研人员研究了在有分子筛膜和无分子筛膜两种情况下、反应温度对甲醇产率的影响,相关数据变化趋势如图 2 所示。
深圳,作为科技之城、创新之城、生态之城,更是一座用新能源重构发展逻辑的“减碳”先锋城市。2024 年末,深圳港大铲湾码头首座重卡充换电站建成投产,其具有全自动快速换电、智能交互、灵活投建、多重消防等优点,并预计 2025 年底前将现有柴油拖车全部更换为电动拖车,届时港区每年减少柴油消耗 150 万升,相当于为深圳种下 3.6 万棵树的固碳量。
(1)、实现碳中和的 4 种主要途径中,到 2050 年,对全球碳中和贡献率最大的途径是 ,深圳港大铲湾码头首座重卡充换电站的优点有(写出一点即可)。(2)、写出利用 CO2生成甲醇的化学方程式:;由图 2 可知,为提高甲醇的产率,合成甲醇应选择的最佳条件为 。(3)、海洋封存是碳封存的一种重要方式,但 CO2 会引起海水酸化,其原因是(用化学方程式表示)。(4)、请写出一个你在生活中能助力深圳“减碳”先锋城市的措施:。 -
11、 利用数字化手持技术探究金属铝和稀盐酸反应,其容器内的压强和温度随时间变化的关系如下图所示,下列说法不正确的是( )
 A、0~50s 内 AB 段压强变化不明显,原因可能是铝表面的金属氧化物与酸发生反应 B、由温度变化曲线可知,该反应属于放热反应 C、BC 段压强上升只是因为反应生成气体 D、CD 段压强下降是因为反应结束,温度下降
A、0~50s 内 AB 段压强变化不明显,原因可能是铝表面的金属氧化物与酸发生反应 B、由温度变化曲线可知,该反应属于放热反应 C、BC 段压强上升只是因为反应生成气体 D、CD 段压强下降是因为反应结束,温度下降 -
12、 下列实验方案不能达到实验目的的是( )
选项
实验目的
实验方案
A
生活中鉴别白醋和酒
闻气味
B
除去 ZnSO4 溶液中少量的 CuSO4
加入过量的铁粉,过滤
C
检验肥皂水具有碱性
取样,滴加酚酞溶液
D
鉴别固体氢氧化钠和硝酸铵
加水溶解,比较温度变化
A、A B、B C、C D、D -
13、 小深用碳酸钠、水和紫罗兰花(变色规律与紫色石蕊溶液类似)进行了如图 1 所示的实验,并连续观察几天。碳酸钠的溶解度曲线如图 2 所示,下列说法错误的是( )
 A、Ⅰ中 21.8g 碳酸钠能全部溶解 B、碳酸钠的溶解度随着温度的上升不断增大 C、Ⅲ中有碳酸钠晶体析出 D、紫罗兰花放在Ⅲ中,一段时间后变为蓝色
A、Ⅰ中 21.8g 碳酸钠能全部溶解 B、碳酸钠的溶解度随着温度的上升不断增大 C、Ⅲ中有碳酸钠晶体析出 D、紫罗兰花放在Ⅲ中,一段时间后变为蓝色 -
14、 下列跨学科实践活动涉及的化学知识解释正确的是( )
选项
实践活动
化学知识
A
调查家用燃料的变迁与合理使用
未来的家用燃料要清洁、易调控、热值高
B
改良土壤的酸碱性
农业上使用氢氧化钠改良酸性土壤
C
用橡皮泥制作氢原子的原子模型
氢原子的原子核都由质子和中子构成
D
微型空气质量“监测站”的使用
测定空气中 SO2、CO2、NO2等污染性气体的含量
A、A B、B C、C D、D -
15、 天然气是重要的化石燃料和能源,主要成分为甲烷(CH4),还含有少量硫化氢(H2S)等气体。硫化氢可在催化剂作用下与甲烷反应而除去,其反应微观示意图如下图所示。下列说法正确的是( )
 A、该反应的化学方程式为:2H2S+ CH4CS2+4H2↑ B、反应前后催化剂的质量和性质都不变 C、天然气属于纯净物 D、反应前后元素种类和原子种类不变
A、该反应的化学方程式为:2H2S+ CH4CS2+4H2↑ B、反应前后催化剂的质量和性质都不变 C、天然气属于纯净物 D、反应前后元素种类和原子种类不变 -
16、每年春天是槐花盛开的季节。槐花花朵淡雅,散发着怡人的清香,而且还能食用。槐花不仅口感甘甜,营养也颇为丰富。回答问题。
 (1)、槐花中铁元素含量较高,约是菠菜的 1.2 倍,适量食用槐花可预防缺铁性贫血。如图是铁元素在元素周期表中的部分信息,下列说法正确的是( )A、铁是由铁原子构成的 B、铁原子的中子数为 26 C、铁原子的相对原子质量为 55.85 g D、铁丝在氧气中燃烧生成氧化铁(2)、槐花中富含维生素 C,约是苹果的 10 倍。维生素 C 的化学式为 C6H8O6 , 下列关于维生素 C 的说法正确的是( )A、维生素C 属于氧化物 B、维生素 C、由碳原子构成C. 维生素C 中氢元素的质量分数最小 D、维生素C 中碳元素和氧元素的质量比为1∶1
(1)、槐花中铁元素含量较高,约是菠菜的 1.2 倍,适量食用槐花可预防缺铁性贫血。如图是铁元素在元素周期表中的部分信息,下列说法正确的是( )A、铁是由铁原子构成的 B、铁原子的中子数为 26 C、铁原子的相对原子质量为 55.85 g D、铁丝在氧气中燃烧生成氧化铁(2)、槐花中富含维生素 C,约是苹果的 10 倍。维生素 C 的化学式为 C6H8O6 , 下列关于维生素 C 的说法正确的是( )A、维生素C 属于氧化物 B、维生素 C、由碳原子构成C. 维生素C 中氢元素的质量分数最小 D、维生素C 中碳元素和氧元素的质量比为1∶1 -
17、氢能作为最清洁的能源,近年来在我国的重视下得到突破性进展,现有“光伏制氢”、“生物质制氢”以及“海水制氢”等技术。回答 问题。(1)、全球首台单机规模最大的海水制氢装置在深圳妈湾电厂成功投入运营,该装置最大的亮点在于无需对海水进行淡化处理,直接利用海水制氢。下列关于“无淡化海水直接电解制氢”技术的说法不正确的是( )A、制氢过程发生了化学反应 B、该技术不需要淡化海水,大大降低了能耗和成本 C、制氢技术的发展可缓解化石燃料短缺 D、该技术在电源负极得到的是氧气(2)、下列与氢元素有关的化学用语正确的是( )A、氢气中氢元素的化合价: B、碳酸氢钠:Na2HCO3 C、氢离子: D、2 个氢分子:2H2(3)、用浓硫酸配制一定浓度的稀硫酸并制取干燥氢气。下列操作规范的是( )A、稀释浓硫酸
 B、干燥H2
B、干燥H2 C、制取H2
C、制取H2 D、收集H2
D、收集H2
-
18、下列有关水和溶液的说法错误的是A、水的天然循环是通过其三态变化实现的 B、某物质的饱和溶液是不能再溶解任何物质的溶液 C、自来水厂通常对天然水进行沉降、过滤、灭菌等净化操作,使之达到饮用水标准 D、溶液是溶质的粒子分散在溶剂中形成的均一、稳定的混合物
-
19、为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动.
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)、用化学方程式表示氢氧化钙变质的原因: .(2)、检验氢氧化钙样品是否完全变质,进行如下实验:实验步骤
实验现象
实验结论
取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置
该样品还含有氢氧化钙
(3)、【探究活动二】测定样品中含有的变质固体(以下用R 表示)的质量分数取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中 R的质量,便可求出样品中 R 的质量分数.实验装置(气密性良好)如图1所示.

将稀盐酸滴入样品中,产生气体的化学方程式为 , 反应一段时间后,当观察到(填实验现象),才停止滴加稀盐酸.
(4)、实验中量筒的作用是.(5)、实验结束后,量筒内进入水的体积如图2所示,其读数为mL.已知在该实验条件下,生成气体的密度为2g· L-¹,通过计算,样品中 R 的质量分数为.(6)、上述图1所示实验装置和相关试剂,用来测定实验样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因:(写一个). -
20、在各种金属材料中,铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案:(1)、实验步骤:①连接好装置;②;③装入药品;④打开分液漏斗活塞向锥形瓶中滴加稀盐酸;⑤一段时间后点燃酒精灯;⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室湿,关闭分液漏斗活塞;⑦数据处理.
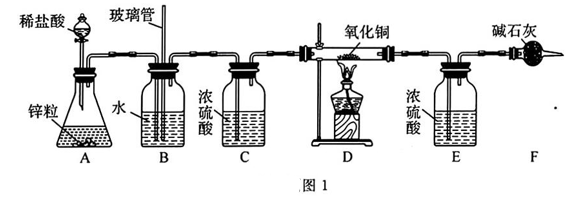
请回答下列问题:
补全实验步骤②.
(2)、若欲使制取氢气的装置随开随用、随关随停,下列装置可选用的是(填字母).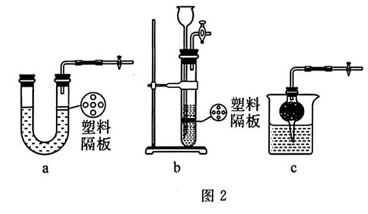 (3)、B装置中水的作用是 , 长玻璃管的作用是 , C装置的作用是.(4)、已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应的氢气的质量为m4克,试用m1 , m2列出铜的相对原子质量的表达式.若无 F装置,则对测定结果的影响(填“偏大”“偏小”或“无影响”),以下数据还能测定铜的相对原子质量的是.
(3)、B装置中水的作用是 , 长玻璃管的作用是 , C装置的作用是.(4)、已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应的氢气的质量为m4克,试用m1 , m2列出铜的相对原子质量的表达式.若无 F装置,则对测定结果的影响(填“偏大”“偏小”或“无影响”),以下数据还能测定铜的相对原子质量的是.A. m2 m3 B. m3 m4 C. m1 m4 D. m2 m4
(5)、请你评价该实验有什么不妥之处,并说明原因:.