相关试卷
-
1、明胶可以再次用于食品工业中使用。明胶里含有多种蛋白质,其中某蛋白质在人体内水解产物之一为苯丙氨酸(化学式为C9H11O2N)。下列对相关物质的说法正确的是( )A、苯丙氨酸有23个原子构成 B、苯丙氨酸分子由碳、氢、氧、氮四种元素组成 C、苯丙氨酸为化合物,明胶为混合物 D、苯丙氨酸中氢元素的质量分数最大
-
2、化学变化绚丽多彩,下列变化中的颜色不会出现的是A、镁在空气中燃烧生成白色固体 B、硫在空气中燃烧产生淡蓝色火焰 C、铜与硝酸银溶液反应得到蓝色溶液 D、二氧化碳使干燥石蕊试纸变为红色
-
3、下列化学方程式书写正确且属于置换反应的是A、 B、 C、 D、
-
4、下列物质分类正确的是A、单质:冰、煤气 B、氧化物:磁铁矿、干冰 C、纯净物:硫磺、乙醇 D、混合物:活性炭、蒸馏水
-
5、水是生命之源,下列有关水的叙述正确的是A、为了节约用水,直接用工业污水灌溉农田 B、用肥皂水可以鉴别硬水和软水 C、河水经过过滤后就可以直接饮用了 D、电解水实验中正极和负极产生的气体体积比为2:1
-
6、下列物质中,属于氧化物的是A、氢氧化铜 B、冰 C、红磷 D、氯酸钾
-
7、下列物质中,属于纯净物的是A、空气 B、盐酸 C、石灰石 D、干冰
-
8、下列选用的相关仪器或操作符合实验要求的是A、检验二氧化碳
 B、滴入液体药品
B、滴入液体药品 C、称量干燥的固体药品
C、称量干燥的固体药品 D、铁在氧气中燃烧
D、铁在氧气中燃烧
-
9、碳元素和氮元素的本质区别是A、电子数不同 B、中子数不同 C、质子数不同 D、最外层电子数不同
-
10、下列属于化学变化的是A、切割玻璃 B、面粉爆炸 C、工业制氧气 D、木炭吸附
-
11、中国提出2060年前实现“碳中和”。碳中和是指国家、个人等在一定时间内排放的二氧化碳与通过各种方式吸收的二氧化碳相互抵消,实现二氧化碳“零排放”。下列行为不符合该理念的是A、植树造林 B、步行上学 C、节约粮食 D、使用一次性筷子
-
12、化学是一门以实验为基础的学科,下面是实验室制取气体、验证气体性质的常见实验装置图,请你结合下列图形回答相关问题。
 (1)、图中编号为a的仪器名称;A装置是制取气体的一种发生装置,请写出用A装置制氧气的化学方程式;若用G装置收集O2 , O2气体从c导管进入,请将下图方框中G装置的导管补画完整。
(1)、图中编号为a的仪器名称;A装置是制取气体的一种发生装置,请写出用A装置制氧气的化学方程式;若用G装置收集O2 , O2气体从c导管进入,请将下图方框中G装置的导管补画完整。 (2)、C装置与B装置都可以作为制取CO2的发生装置,C装置与B装置相比,C装置的优点是;图中C、D、E和F是实验室制CO2并探究CO2性质的实验装置图,实验进行一段时间后,可以观察到D装置中的现象是;一段时间后E装置中紫色石蕊溶液变成红色,请分析溶液变红的原因(请用化学方程式表示);F装置中蜡烛最终由低向高依次熄灭,说明二氧化碳具有的化学性质是;(3)、兴趣小组称取一定质量的石灰石样品(主要成分为碳酸钙)放入烧杯中,加入足量的稀盐酸(石灰石中杂质不参加反应),待完全反应后,得到4.4g二氧化碳。请计算石灰石样品中参加反应的碳酸钙的质量。
(2)、C装置与B装置都可以作为制取CO2的发生装置,C装置与B装置相比,C装置的优点是;图中C、D、E和F是实验室制CO2并探究CO2性质的实验装置图,实验进行一段时间后,可以观察到D装置中的现象是;一段时间后E装置中紫色石蕊溶液变成红色,请分析溶液变红的原因(请用化学方程式表示);F装置中蜡烛最终由低向高依次熄灭,说明二氧化碳具有的化学性质是;(3)、兴趣小组称取一定质量的石灰石样品(主要成分为碳酸钙)放入烧杯中,加入足量的稀盐酸(石灰石中杂质不参加反应),待完全反应后,得到4.4g二氧化碳。请计算石灰石样品中参加反应的碳酸钙的质量。 -
13、实验室用如图装置进行碳还原氧化铜实验。请回答:
 (1)、写出碳与氯化铜反应的化学方程式。(2)、实验现象是什么?(3)、实验结束时,为什么要先将导管从澄清石灰水中撤出,再熄灭酒精灯?
(1)、写出碳与氯化铜反应的化学方程式。(2)、实验现象是什么?(3)、实验结束时,为什么要先将导管从澄清石灰水中撤出,再熄灭酒精灯? -
14、指出下列错误操作可能造成的不良后果:(1)、倾倒液体时,标签没向着手心。(2)、做铁丝在氧气中燃烧实验时,没有铺一层细沙。
-
15、请用分子、原子的观点解释下列事实。(1)、酒香不怕巷子深。(2)、金刚石和石墨都是碳的单质,但物理性质差异很大。(3)、水汽化时体积增大。
-
16、为了减少污染,通常在汽车的排气管上装一个“催化转换器”。装置中发生反应的微观示意图如图所示:

请写出反应的化学方程式;在反应前后化合价没有发生变化的元素是。
-
17、下图是四种粒子的结构示意图,回答下列问题:
 (1)、属于同种元素的粒子是(填序号),化学性质相似的粒子的是(填序号)。(2)、②所示粒子的化学符号为。
(1)、属于同种元素的粒子是(填序号),化学性质相似的粒子的是(填序号)。(2)、②所示粒子的化学符号为。 -
18、下图为元素周期表中的一格。氩的相对原子质量为;氩元素属于(填“金属”、“非金属”或“稀有气体”)元素;氩元素位于元素周期表的第周期。
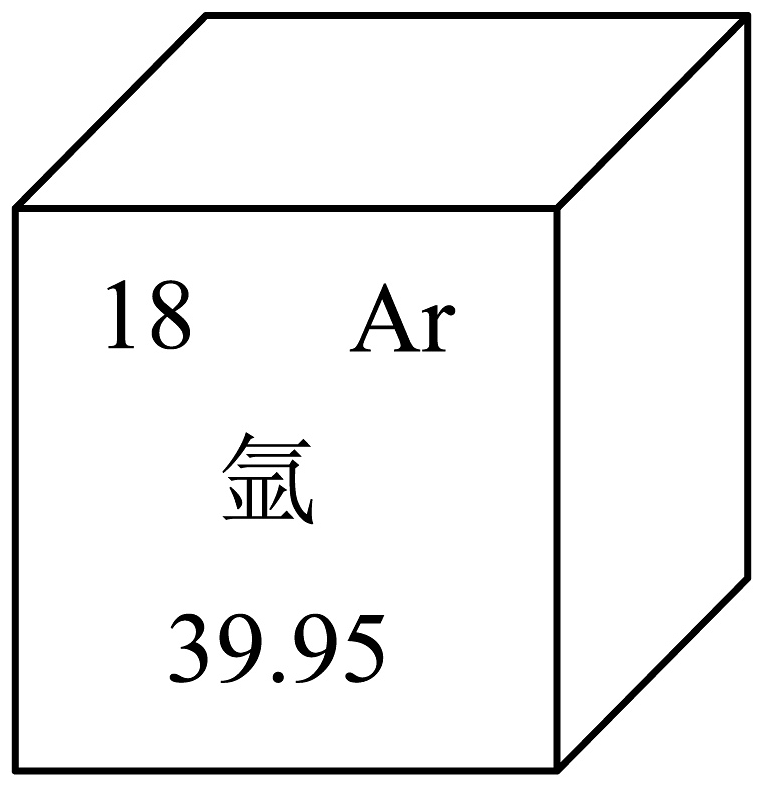
-
19、水是生产生活中最常用的物质之一。检验水样是硬水还是软水,常用的试剂是;生活中常用的方法给水消毒;电解水的实验告诉我们:水是由组成的。
-
20、空气中体积分数约为78%的气体是;人体中含量最多的金属元素与地壳中含量最多的元素所形成化合物的化学式为。