相关试卷
-
1、光伏发电驱动电解水制氢是目前最为可行的大规模制氢技术之一。(1)、发展光伏发电能大幅减少的排放,助力我国实现“双碳”目标。(2)、电解水制氢的化学反应方程式为.(3)、科研人员发现,γ-MnO2可作为酸性条件下电解水的催化剂,则反应前后γ-MnO2的质量和没有发生变化。
-
2、常州非遗“金坛蛋雕”(如图所示)制作过程包括清空蛋体、清洁风干、定标绘图、精细雕刻、清理装饰。请用以下相关制作用品的序号填空。
①清水 ②尼龙刷 ③石墨铅笔 ④合金刻刀
 (1)、属于合成材料的是。(2)、属于金属材料的是。(3)、用于定标绘图的是。(4)、经常作为溶剂的是.
(1)、属于合成材料的是。(2)、属于金属材料的是。(3)、用于定标绘图的是。(4)、经常作为溶剂的是. -
3、兴趣小组做了以下实验(已知相同条件下,同浓度溶液中水的挥发能力近似相等),根据实验事实判断下列说法正确的是( )
序号
实验装置
容器内物质初始质量
操作1
两天后容器内物质质量
操作2
实验结果
①
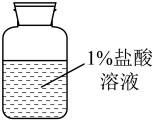
10.00g
放置两天
10.00g
取2份少许等量的③溶液,向其中分别滴加①和②中溶液至中性
消耗溶液质量:
①>②
②
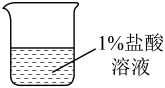
10.00g
6.69g
③

10.00g
8.47g
A、两天后①中溶液的pH小于②中溶液的pH B、两天内②中溶液挥发出的水一定大于3.2lg C、③中溶液减少量比②中少只因NaOH不挥发 D、可推理得出③中原溶液溶质质量分数为1% -
4、以如下思维模型进行“垃圾的分类与回收利用”跨学科实践活动,下列说法正确的是( )
 A、废旧塑料不能作为思维模型中的原料 B、废旧书刊和报纸的预处理方式是焚烧 C、用废铁炼钢过程中的核心反应是除锈 D、厨余垃圾处理的目标产物可以是肥料
A、废旧塑料不能作为思维模型中的原料 B、废旧书刊和报纸的预处理方式是焚烧 C、用废铁炼钢过程中的核心反应是除锈 D、厨余垃圾处理的目标产物可以是肥料 -
5、如图所示进行对比实验(装置气密性良好),两侧均加入5g质量分数为7.3%的稀盐酸。下列说法正确的是( )
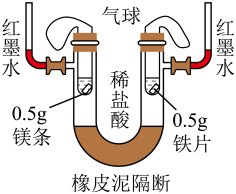 A、反应过程中右侧小试管内更剧烈 B、恢复至室温后左侧气球体积较大 C、反应过程中左侧红墨水上升更快 D、反应结束后两边金属均完全消失
A、反应过程中右侧小试管内更剧烈 B、恢复至室温后左侧气球体积较大 C、反应过程中左侧红墨水上升更快 D、反应结束后两边金属均完全消失 -
6、天然气入户是城镇老旧小区改造的一项民生工程。下列说法正确的是( )A、天然气燃烧反应: B、天然气燃烧时能量转化关系:热能转化为化学能 C、燃气热水器要安装在浴室外以防洗澡时CO中毒 D、家用燃料变迁到天然气源于天然气是可再生能源
-
7、用含质量分数为10%的KNO3(密度为1.2g/mL)浓溶液,加水稀释为含KNO30.03%(密度约为1g/mL)的水培生菜营养液。下列说法正确的是( )A、配制过程需要用到托盘天平、药匙等 B、浓溶液和稀释用水的体积比约为1:400 C、稀释时玻璃棒的作用是加速固体溶解 D、量取浓溶液后在量筒中完成配制过程
-
8、我国科研人员用纳米级氢氧化钙颗粒加固壁画取得成功。下列说法不正确的是( )A、加固过程主要与二氧化碳反应 B、氢氧化钙生成碳酸钙粘合壁画 C、水分蒸发有助于壁画加固过程 D、澄清石灰水加固壁画效果更好
-
9、乙醇酸(C2H4O3)是制备生物降解材料聚乙醇酸的原料,其在自然环境中降解的微观示意图如下(相同小球表示同种原子),下列说法正确的是( )
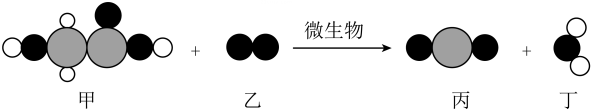 A、参与反应的甲、乙分子个数比为1:1 B、乙在空气中体积分数最大 C、反应过程中生成的丙属于有机化合物 D、生成物丁的化学式为H2O
A、参与反应的甲、乙分子个数比为1:1 B、乙在空气中体积分数最大 C、反应过程中生成的丙属于有机化合物 D、生成物丁的化学式为H2O -
10、在给定条件下,下列物质间的转化能实现的是( )A、 B、 C、 D、
-
11、二氧化氯(ClO2)是游泳池高效、安全的消毒剂,可由以下反应制得: , 可推测X为( )A、NaCl B、Na2SO3 C、Na2O D、SO2
-
12、漂漆扇上的漆液主要成分为漆酚下列关于漆酚的说法正确的是( )A、漆酚中含有两个H2O分子 B、漆酚由C、H、O原子构成 C、所含碳元素质量分数最高 D、氢、氧元素质量比为15:1
-
13、下列粗盐提纯的相关操作中正确的是( )A、
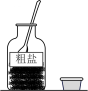 取用药品
B、
取用药品
B、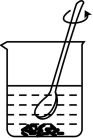 溶解药品
C、
溶解药品
C、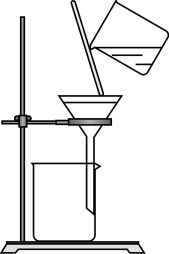 过滤操作
D、
过滤操作
D、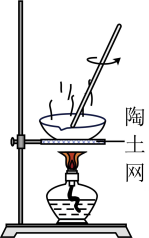 蒸发结晶
蒸发结晶
-
14、蚊虫可通过触角检测人体呼吸产生的CO2定位吸血目标。下列家庭用品可用于自制蚊虫诱捕剂的是( )A、面粉和矿泉水 B、白糖和柠檬酸 C、纯碱和食盐水 D、小苏打和食醋
-
15、将自制的紫薯汁滴入NaOH溶液、稀盐酸、蒸馏水中,分别呈现绿色、红色、紫色,则紫薯汁滴入石灰水中最可能呈现的颜色是( )A、红色 B、绿色 C、紫色 D、无色
-
16、人体必需元素碘在元素周期表中的部分信息如图所示,下列说法正确的是( )
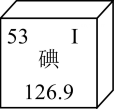 A、碘原子的质子数为53 B、碘原子质量为126.9g C、碘元素属于金属元素 D、缺碘会导致骨质疏松
A、碘原子的质子数为53 B、碘原子质量为126.9g C、碘元素属于金属元素 D、缺碘会导致骨质疏松 -
17、常州特色小吃豆腐汤的下列配料中富含蛋白质的是( )A、豆腐 B、食盐 C、葱花 D、淀粉
-
18、下列秦代陶俑彩绘上的颜料中属于氧化物的是( )A、朱砂(HgS) B、铅丹(Pb2O4) C、炭黑(C) D、孔雀石[Cu2(OH)2CO3]
-
19、下列人物中长期从事中西药结合研究的是( )A、屠呦呦 B、闵恩泽 C、徐光宪 D、徐寿
-
20、自制净水器过程中主要利用其吸附性的材料是( )A、小卵石 B、石英砂 C、活性炭 D、棉纱布