相关试卷
-
1、龙是中华民族的图腾。石器时代的“玉龙”、秦代的“青铜龙”、唐代的“鎏金铁芯铜龙”(如图)文物的制造体现了古人的智慧。
 (1)、三件文物中,所含主要材质不属于金属材料的是。(2)、铁芯外表包铜可耐腐蚀,原因是铜的活动性比铁(填“强”或“弱”)。(3)、“取炉甘石,研之细末,和以赤铜,置炭火中煅烧。……熄火取铜,其色如金。”赤铜为Cu2O,其铜、氧元素的质量比为。炉甘石主要成分是ZnCO3 , 煅烧反应生成两种氧化物的化学方程式为 , “熄火取铜”中所得“铜”与纯铜相比,硬度(填“更大”“更小”或“相等”)。(4)、鎏金工艺是指在器物表面涂抹金汞齐(金汞合金),加热祛汞,冷却,器物表面形成金膜。鎏金工艺利用的知识有(多选)。
(1)、三件文物中,所含主要材质不属于金属材料的是。(2)、铁芯外表包铜可耐腐蚀,原因是铜的活动性比铁(填“强”或“弱”)。(3)、“取炉甘石,研之细末,和以赤铜,置炭火中煅烧。……熄火取铜,其色如金。”赤铜为Cu2O,其铜、氧元素的质量比为。炉甘石主要成分是ZnCO3 , 煅烧反应生成两种氧化物的化学方程式为 , “熄火取铜”中所得“铜”与纯铜相比,硬度(填“更大”“更小”或“相等”)。(4)、鎏金工艺是指在器物表面涂抹金汞齐(金汞合金),加热祛汞,冷却,器物表面形成金膜。鎏金工艺利用的知识有(多选)。a.汞的沸点低 b.汞被氧化变成氧化汞 c.金汞合金熔点比组分纯金属低
-
2、已知甲、乙、丙、丁是初中化学常见的四种物质,甲能使澄清石灰石变浑浊,乙能使带火星的木条复燃,丙是人体中含量最多的物质,(“→”表示物质之间的转化,反应条件、部分反应物和生成物已省略)。下列说法不正确的是
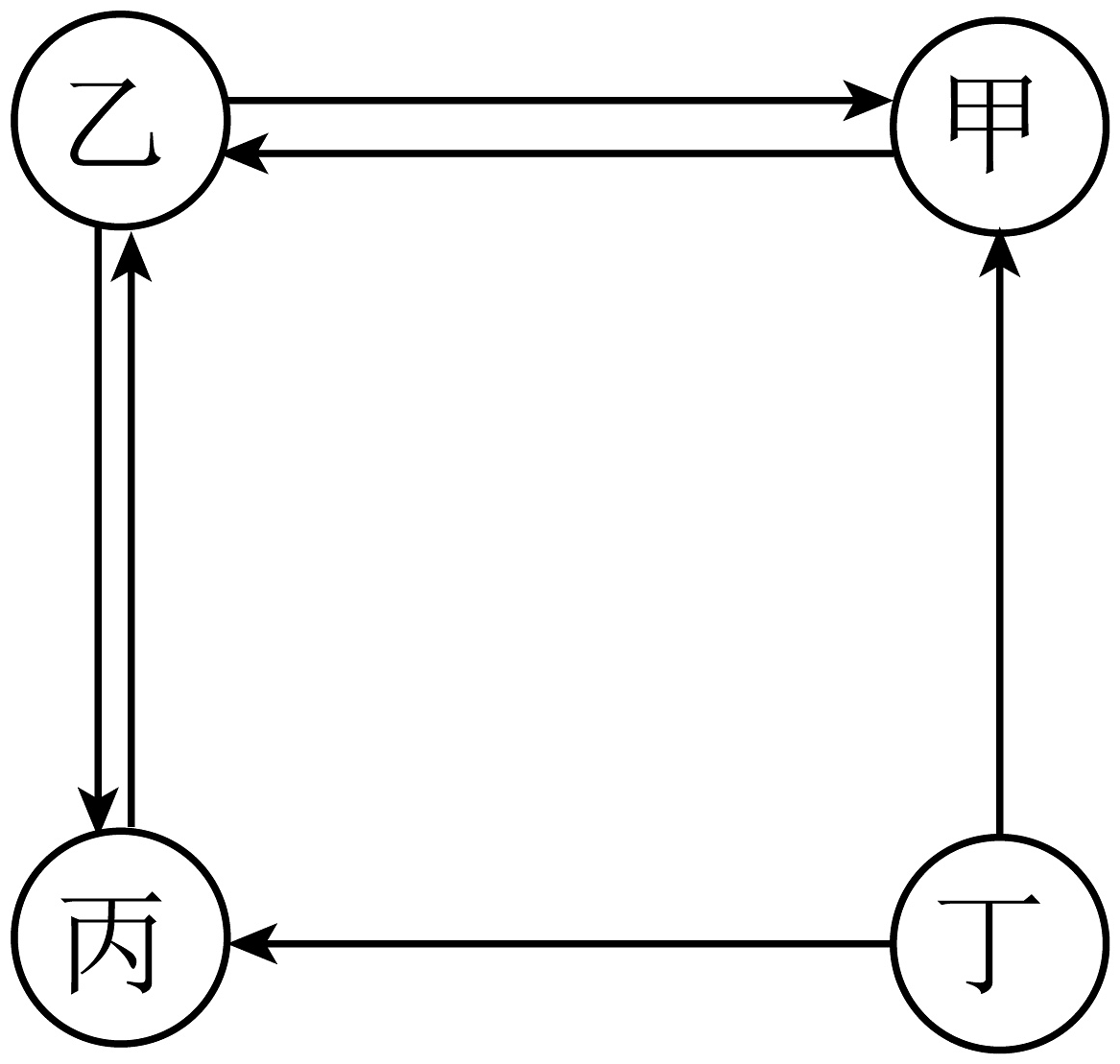 A、甲→乙能通过植物的光合作用来实现 B、若丁是酒精,则甲、乙、丙、丁中可能含有一种相同的元素 C、乙→丙一定是氢气燃烧 D、乙一定是由地壳中含量最多的元素组成的
A、甲→乙能通过植物的光合作用来实现 B、若丁是酒精,则甲、乙、丙、丁中可能含有一种相同的元素 C、乙→丙一定是氢气燃烧 D、乙一定是由地壳中含量最多的元素组成的 -
3、下列实验设计不能达到实验目的的是
选项
实验目的
实验设计
A
除去K2MnO4中的KMnO4
在试管中充分加热
B
除去CuO中少量的C
在空气中充分灼烧
C
鉴别氧气与氮气
将带火星木条分别放入气体中,观察现象
D
鉴别过氧化氢溶液和水
分别加少量二氧化锰粉末,观察现象
A、A B、B C、C D、D -
4、用下图所示四个实验探究二氧化碳能否与水反应,实验中所用的纸花均用石蕊染成紫色并干燥下列说法错误的是
 A、①和④的紫色纸花会变红 B、对比①③,推断④有酸性物质生成 C、对比④纸花放入集气瓶前后的现象,省略②也能得出同样的实验结论 D、综合①②③④可得出的结论是:二氧化碳能与水反应生成碳酸,且碳酸很稳定
A、①和④的紫色纸花会变红 B、对比①③,推断④有酸性物质生成 C、对比④纸花放入集气瓶前后的现象,省略②也能得出同样的实验结论 D、综合①②③④可得出的结论是:二氧化碳能与水反应生成碳酸,且碳酸很稳定 -
5、氘和氚是制造氢弹的原料。氘核和氚核在超高温的条件下会聚合成一个氦核,如图所示,下列说法正确的是
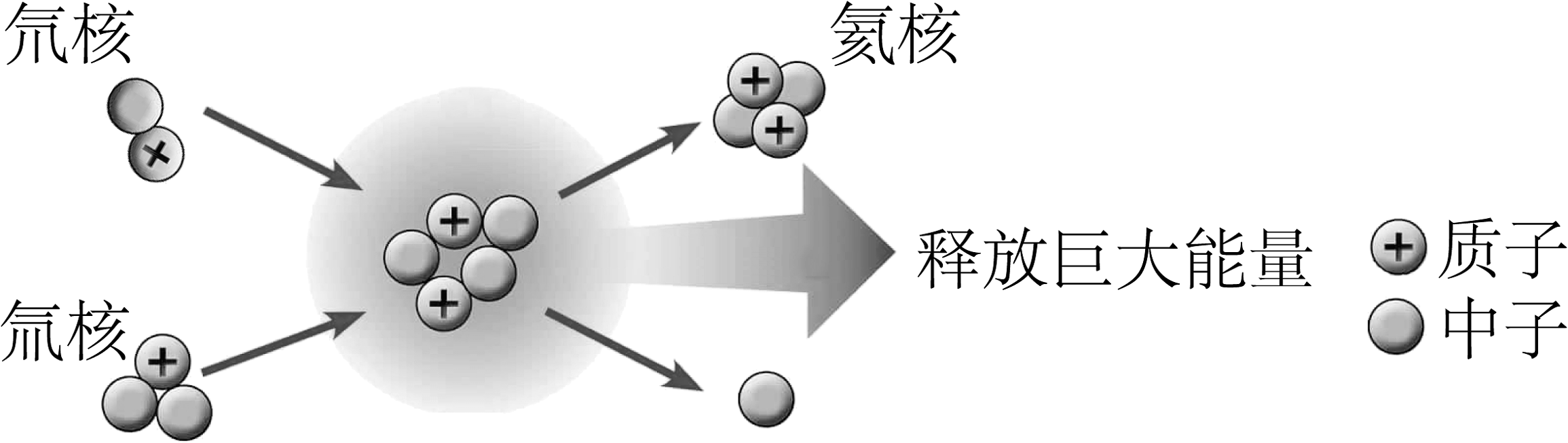 A、该变化属于化学变化 B、氚、氦两种原子的质子数相同 C、该变化涉及的元素有二种 D、氘原子和氚原子的相对原子质量相等
A、该变化属于化学变化 B、氚、氦两种原子的质子数相同 C、该变化涉及的元素有二种 D、氘原子和氚原子的相对原子质量相等 -
6、华为新款智能手机采用“中国芯”。制造芯片的重要材料是硅,如图是工业制取高纯硅部分反应原理的微观示意图。下列说法错误的是
 A、一个甲分子由五个原子构成 B、该反应中乙具有还原性,发生还原反应 C、参加反应的乙和生成的丁的体积比是1∶2 D、该反应的化学方程式为:SiCl4+2H2Si+4HCl
A、一个甲分子由五个原子构成 B、该反应中乙具有还原性,发生还原反应 C、参加反应的乙和生成的丁的体积比是1∶2 D、该反应的化学方程式为:SiCl4+2H2Si+4HCl -
7、下列有关燃烧与灭火的说法错误的是A、物质燃烧时一定伴随着发光、放热 B、吹灭蜡烛的灭火原理是隔绝氧气 C、精密仪器着火可用液态二氧化碳灭火 D、煤气泄漏应先关闭阀门,再开窗通风
-
8、下列化学用语的意义描述正确的是A、2N2:2个氮原子 B、Ba2+:1个钡离子带2个单位正电荷 C、2H:2个氢元素 D、Na+:钠元素的化合价为+1
-
9、变瘪的气球充入氦气,气球鼓胀起来。从分子角度描述球内发生的变化正确的是A、氦气分子的体积变大 B、氦气分子间的间隔变大 C、氦气分子个数增多 D、氦气分子分裂生成了新的分子
-
10、诺贝尔化学奖获得者List曾用有机催化剂脯氨酸(C5H9NO2)研究催化反应,其结构模型如图,有关脯氨酸的说法正确的是
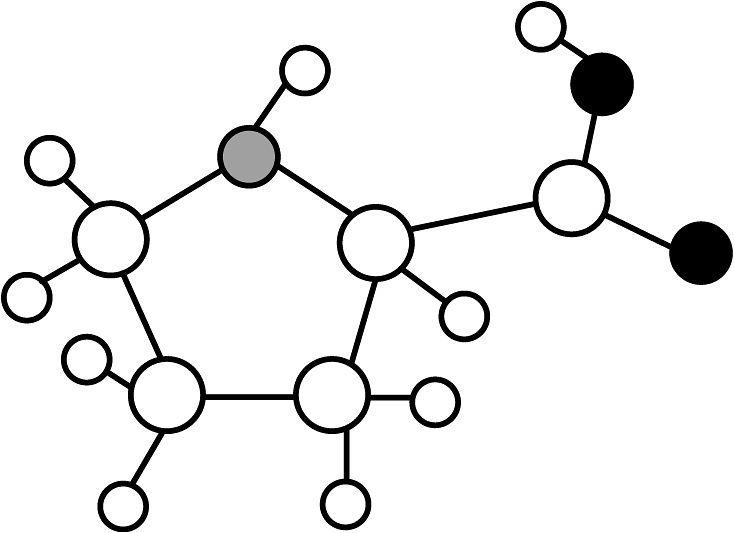 A、脯氨酸由17个原子构成 B、脯氨酸结构中含有NO2分子 C、氢元素的质量分数最小 D、催化剂反应后其化学性质发生改变
A、脯氨酸由17个原子构成 B、脯氨酸结构中含有NO2分子 C、氢元素的质量分数最小 D、催化剂反应后其化学性质发生改变 -
11、空气和水是一切生命体生存所必需的物质。下列关于空气和水的说法,正确的是A、空气中氮气的质量分数约为78% B、氧气可以用于卫星发射的助燃剂 C、为节约用水,直接用工业废水灌溉农田 D、电解水实验中,正极与负极产生气体的质量比约为1:2
-
12、高锰酸钾( KMnO4)常用于实验室制取氧气。高锰酸钾属于A、化合物 B、氧化物 C、单质 D、混合物
-
13、能造成酸雨的气体是A、二氧化碳 B、一氧化碳 C、氮气 D、二氧化硫
-
14、中华文明源远流长,以下我国古代发明或技术应用的原理中发生化学变化的是A、木器涂漆 B、烧制陶瓷 C、炭黑制墨 D、竹编花篮
-
15、测定硫酸钠溶液的溶质质量分数
实验室有一瓶标签被腐蚀的Na2SO4溶液。某化学兴趣小组的同学为测定该Na2SO4溶液的溶质质量分数,取10gNa2SO4溶液于烧杯中,然后加入BaCl2溶液。生成沉淀的质量与加入BaCl2溶液的质量关系如图所示,试计算该Na2SO4溶液的溶质质量分数。

-
16、
探究镁条变黑的条件
镁条在空气中久置表面会变黑,对镁条变黑的条件及黑色物质成分作如下探究。
【查阅资料】①氮化镁(Mg3N2)是黄色固体。②常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
(1)同学们认为镁条变黑与N2无关,其理由是。
【实验】先将镁条用砂纸打磨光亮,用如图所示装置(镁条长度均为3cm,试管容积均为20mL。)分别进行下列实验。(B、C、D中通入CO2体积均为4mL。)

(2)试管C中,Na2SO3溶液的作用是(用化学方程式表示)。
(3)对照实验指除了自变量以外,其它的量都保持不变的实验。该实验方案中采用了对照实验的方法。请指出其中的对照实验(填ABCD实验代号)和自变量。
第①组对照实验 , 自变量。
第②组对照实验 , 自变量。
第③组对照实验 , 自变量。
(4)实验现象:试管A、B、C中的镁条始终无明显变化,试管D中镁条第3天开始变黑,至第20天全部变黑。以实验现象为证据推理可以获得的结论是。镁条变黑后的生成物中一定含有元素。
(5)小林同学猜想镁条表面的黑色物质中含有碳酸盐,检验的方法是:取变黑后的镁条于试管内,。
-
17、物质的制备(1)、氢氧化锂(LiOH)在航天器中可用于吸收CO2。工业上用电解法制得的LiOH溶液中含有NaOH。在N2保护下将混合溶液蒸发结晶,可得到LiOH晶体。有关物质的溶解度如表:
电解法制得的1000g溶液中,LiOH的质量分数为10%、NaOH的质量分数为5%。
物质
溶解度/g
20℃
30℃
40℃
50℃
60℃
LiOH
12.8
12.9
13.0
13.3
13.8
NaOH
109
118
129
146
177
①该溶液中LiOH的质量为g。
②将该溶液蒸发溶剂并降低温度到20℃时,当剩余溶液中水的质量为100g时,有gLiOH析出。氢氧化钠能不能析出?理由是。
③结晶过程中,若没有N2保护,LiOH晶体中会混有Li2CO3。其原因是(用化学方程式表示)。
(2)、《天工开物》记载了锡的冶炼方法:入砂(指锡砂)数百斤,架木炭亦数百斤,鼓鞲(指鼓入空气)熔化,用铅少许,(锡)沛然流注。①高温下木炭还原锡砂(SnO2)的化学方程式为。
②炼锡时加入少许铅形成合金,产物更易熔化流出,原因是。
(3)、《周礼•考工记》中记载,古人利用贝壳和草木灰为原料制备物质洗涤丝帛。某兴趣小组的同学仿照古法,在老师的指导下按以下流程来制备去污液。
①上述流程中发生分解反应的化学方程式为。
②请你根据流程推测,该去污液中所含溶质的组成有哪几种可能?(用化学式表示)。
-
18、物质的组成结构与性质(1)、溴化氢(HBr)是一种易溶于水的气体,其溶液呈无色,被叫作氢溴酸。
①氢溴酸是由(填微观粒子符号)构成的,小林同学分析其构成后,认为它与盐酸有相似的性质。为探究其性质,进行如图实验:

②由上述实验可知,氢溴酸与盐酸有相似的性质,试分析④中产生红色喷泉的原因。
(2)、科学写作列举稀盐酸和稀硫酸的共性和差异性(各举一条即可),并分析该共性或差异性与其构成的关系,以此说明“物质的性质与其构成有关”。要求:语言简洁,逻辑性强,字数在150字以内。。
-
19、金属蚀刻(1)、精细化工中常对金属进行雕琢,化学蚀刻是常用的方法之一。其原理是通过溶液与金属的化学反应,从而形成凹凸。某车间以含盐酸的溶液为蚀刻液,生产金属雕花外墙装饰板的工艺流程如图所示。请分析流程,回答下列问题。

①胶膜应具有的性质是(写一种)。
②蚀刻步骤中发生反应的化学方程式为。
③喷漆可防止工艺品锈蚀,其防锈原理是。
(2)、化学兴趣小组的同学根据制作金属雕花外墙装饰板的工艺流程,制作一幅金属蚀刻画,两个小组的同学分别以铝板和银板为板材,涂胶后滴加蚀刻液进行蚀刻。
①为保证蚀刻成功,在蚀刻前需对铝板进行打磨,理由是。
②两组同学中不能成功得到蚀刻画的是 , 原因是。
能成功的小组中应用的蚀刻原理是(用化学方程式表示)。其基本反应类型为。
(3)、某加工厂进行金属蚀刻后得到的废液中含有Cu(NO3)2、Zn(NO3)2和AgNO3 , 取一定量废液,进行如图所示操作,并记录相关现象。
①滤液A中的金属阳离子有(写离子符号)。
②滤渣B中的金属有(写化学式)。
-
20、物质的性质与应用(1)、小林在学习氢氧化钙的性质与用途时进行了如图整理,并用化学用语表征相应用途中的反应原理或反应实质,请帮助他补充完整。① , ② , ③ , ④ , ⑤ , ⑥。
 (2)、某兴趣小组在完成了用石灰石和稀盐酸制取二氧化碳的实验后,欲运用数字化实验对反应后所得废液的组成进行定量探究,取一定量的废液,用图1装置进行实验:将80mL一定质量分数的碳酸钠溶液逐滴加入废液中,测得数据如图2。(CaCl2溶液呈中性)
(2)、某兴趣小组在完成了用石灰石和稀盐酸制取二氧化碳的实验后,欲运用数字化实验对反应后所得废液的组成进行定量探究,取一定量的废液,用图1装置进行实验:将80mL一定质量分数的碳酸钠溶液逐滴加入废液中,测得数据如图2。(CaCl2溶液呈中性)
①制取二氧化碳时发生反应的化学方程式为。
②分析图2数据可知废液中溶质的成分为(写化学式)。b点发生反应的化学方程式为。利用实验数据进行定量计算即可确定废液中溶质的含量。
③小林同学提出,不用数字化实验也可以定性检验废液中溶质的成分,请写出实验步骤、可能的现象及相关推理。