-
1、兴趣小组同学开展自制“苏打水”的课外实践活动,并绘制了部分标签内容。请完成下面小题。
 (1)、下列关于自制“苏打水”的说法错误的是A、配料中水是人体所需营养物质 B、配料中碳酸氢钠的俗称是苏打 C、可以缓解胃酸过多症状 D、可选用干净的矿泉水瓶盛装(2)、配料选用食品级三氯蔗糖(C12H19Cl3O8)。下列关于三氯蔗糖的说法正确的是A、属于氧化物 B、氯元素的质量分数最大 C、碳元素与氢元素质量比为144:19 D、由12个碳原子、19个氢原子、3个氯原子和8个氧原子构成(3)、碳酸氢钠的溶解度曲线如图所示,下列说法正确的是
(1)、下列关于自制“苏打水”的说法错误的是A、配料中水是人体所需营养物质 B、配料中碳酸氢钠的俗称是苏打 C、可以缓解胃酸过多症状 D、可选用干净的矿泉水瓶盛装(2)、配料选用食品级三氯蔗糖(C12H19Cl3O8)。下列关于三氯蔗糖的说法正确的是A、属于氧化物 B、氯元素的质量分数最大 C、碳元素与氢元素质量比为144:19 D、由12个碳原子、19个氢原子、3个氯原子和8个氧原子构成(3)、碳酸氢钠的溶解度曲线如图所示,下列说法正确的是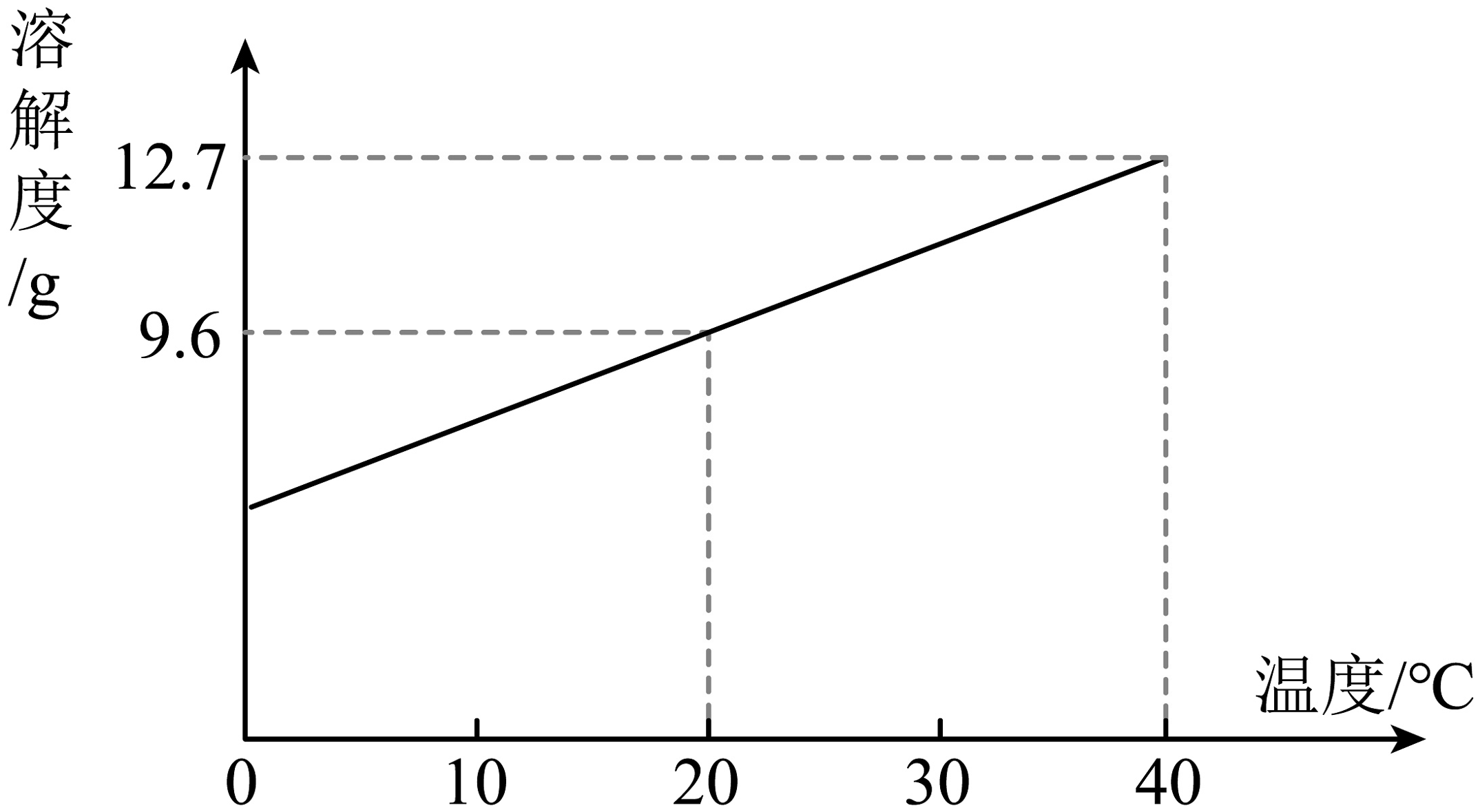 A、搅拌可以加速碳酸氢钠在水中的溶解 B、将碳酸氢钠饱和溶液从10℃升温至30℃,仍是饱和溶液 C、20℃时,碳酸氢钠饱和溶液的溶质质量分数是9.6% D、40℃时,将10g碳酸氢钠加入到50g水中充分搅拌,所得溶液质量为60g
A、搅拌可以加速碳酸氢钠在水中的溶解 B、将碳酸氢钠饱和溶液从10℃升温至30℃,仍是饱和溶液 C、20℃时,碳酸氢钠饱和溶液的溶质质量分数是9.6% D、40℃时,将10g碳酸氢钠加入到50g水中充分搅拌,所得溶液质量为60g -
2、钙是人体中含量最多的金属元素。请利用下图信息,判断有关钙的说法正确的是
 A、钙原子的质子数为20 B、钙原子容易得到2个电子 C、钙原子的核外电子数为22 D、钙的相对原子质量为40.08g
A、钙原子的质子数为20 B、钙原子容易得到2个电子 C、钙原子的核外电子数为22 D、钙的相对原子质量为40.08g -
3、下列化学用语表述正确的是A、2个氧原子:O2 B、1个二氧化硫分子:SO2 C、氯离子:Cl+ D、KMnO4中锰元素的化合价:
-
4、2025年“世界环境日”主题为“生态修复”。下列做法与该主题不相符的是A、推广使用清洁能源公交车 B、废旧电池集中回收 C、提倡使用可降解塑料制品 D、工厂废气直接排放
-
5、我国是世界上首个成功试采可燃冰的国家。可燃冰的主要成分为甲烷水合物,如图是甲烷在空气中充分燃烧的微观反应示意图。
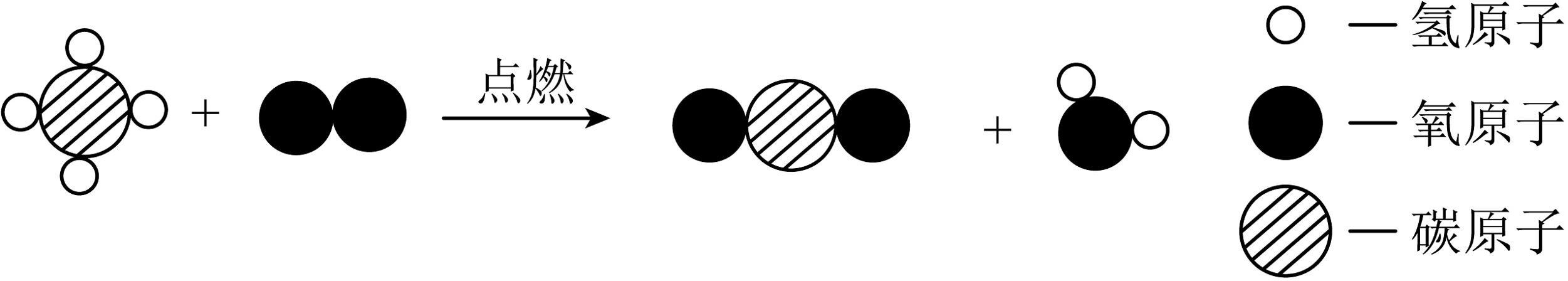 (1)、该反应的化学方程式为 , 保持甲烷化学性质的最小粒子是。(2)、计算80g甲烷完全燃烧生成二氧化碳的质量(写出计算过程)。
(1)、该反应的化学方程式为 , 保持甲烷化学性质的最小粒子是。(2)、计算80g甲烷完全燃烧生成二氧化碳的质量(写出计算过程)。 -
6、
绣球花在pH=4.5-6.0的酸性土壤中能开出蓝色的花,在弱碱性土壤中能开出粉红色的花。化学小组计划在学校甲、乙两个园圃种植不同颜色的绣球花。
任务一 测定土壤及化肥的酸碱性
(1)园圃使用的化肥有氯化铵、硫酸铵、草木灰(主要成分为碳酸钾)、硝酸钾,其中属于复合肥料的是。
(2)分别取甲、乙两园圃的土壤样品,获取浸出液;然后各取上述化肥样品配制成一定浓度的溶液,测定pH,记录如表:
样品
甲
乙
氯化铵
硫酸铵
草木灰
硝酸钾
pH
5.6
2.8
5.1
5.5
11.0
7.0
结论:园圃可直接培植蓝色绣球花。
任务二 探寻甲园圃土壤酸化成因
(3)【调查走访】甲园圃常施加氯化铵、硫酸铵中的一种或两种。
【提出问题】甲园圃土壤浸出液含哪种铵盐?
【作出猜想】猜想1:NH4Cl 猜想2:(NH4)2SO4 猜想3:两种都有
【实验探究】同学们进行以下探究:
操作
现象
推测
结论
I.取样,滴加足量Ba(NO3)2溶液
含(NH4)2SO4
猜想3正确
II.再滴加溶液
产生白色沉淀
含NH4Cl
操作I中发生反应的化学方程式为。
任务三 调节乙园圃土壤至弱碱性
(4)经检测乙园圃的土壤浸出液中含稀盐酸,同学们选用稀盐酸模拟土壤浸出液进行调节,实验装置及相关数据如图:
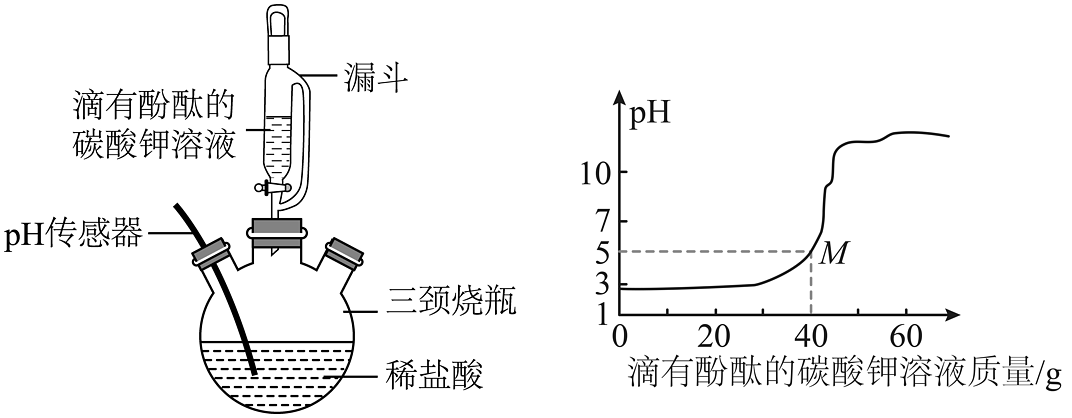
①M点时溶液中的溶质除了酚酞,还有。
②当观察到时停止滴加,此时溶液呈弱碱性。
-
7、实验室制取气体常用到以下装置,回答下列问题。
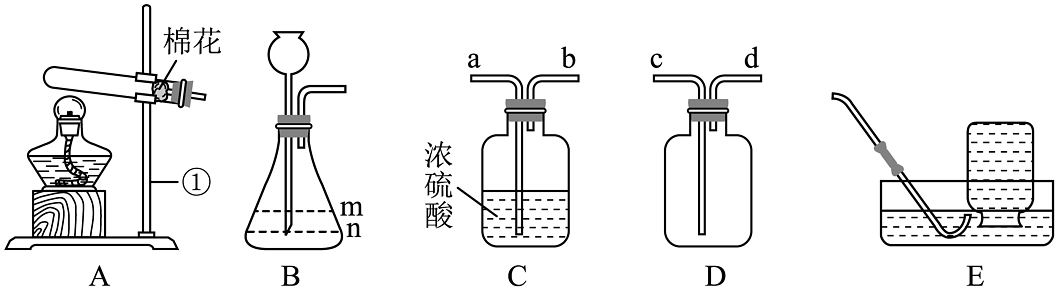 (1)、写出仪器①的名称:。(2)、实验室用装置A、E制取氧气,实验结束时应先(填“将导管移出水槽”或“熄灭酒精灯”)。若发现收集到的氧气不纯,原因可能是(写一条)。(3)、实验室用装置B制取二氧化碳的化学方程式为 , 长颈漏斗中加入的试剂是 , 所加试剂的液面最好应到(填“m”“n”或“任意”)处。(4)、利用装置C、D收集一瓶干燥的氢气,气体通入导管口的顺序为(填序号)。
(1)、写出仪器①的名称:。(2)、实验室用装置A、E制取氧气,实验结束时应先(填“将导管移出水槽”或“熄灭酒精灯”)。若发现收集到的氧气不纯,原因可能是(写一条)。(3)、实验室用装置B制取二氧化碳的化学方程式为 , 长颈漏斗中加入的试剂是 , 所加试剂的液面最好应到(填“m”“n”或“任意”)处。(4)、利用装置C、D收集一瓶干燥的氢气,气体通入导管口的顺序为(填序号)。 -
8、工业上以菱铁矿石(主要成分为FeCO3 , 含少量SiO2)为原料,通过图1所示流程可制取铁粉。
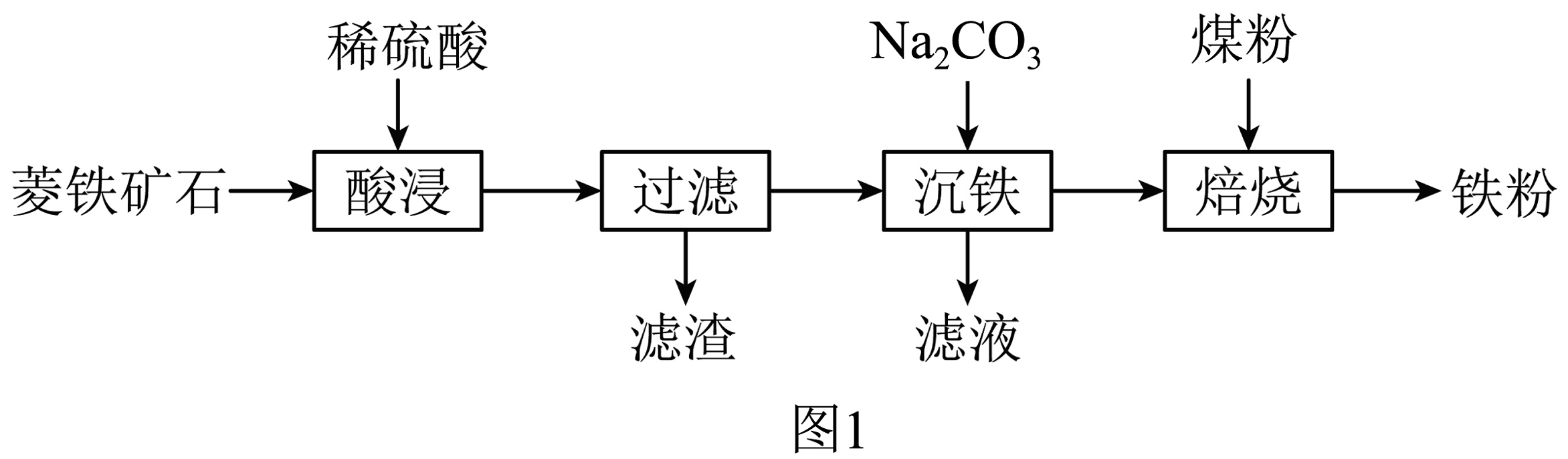
已知:SiO2不溶于水,也不与稀硫酸反应。
(1)、过滤时所得滤渣的主要成分是。(2)、“沉铁”时发生反应Na2CO3+FeSO4=X+FeCO3↓,的化学式为 , 该反应的基本反应类型是。(3)、“沉铁”后需对滤渣进行洗涤。判断滤渣洗涤干净的方法是:向最后一次洗涤液中滴加溶液,若无沉淀生成,则表示滤渣已洗涤干净。(4)、“焙烧”过程中主要发生以下3个反应:I.4FeCO3+O22Fe2O3+4CO2;II.C+CO22CO;III.。
(5)、“焙烧”过程中还需要加入CaCO3进行脱硫处理。CaCO3的加入对还原铁粉产率的影响如图2,据图分析所加CaCO3的另一作用是。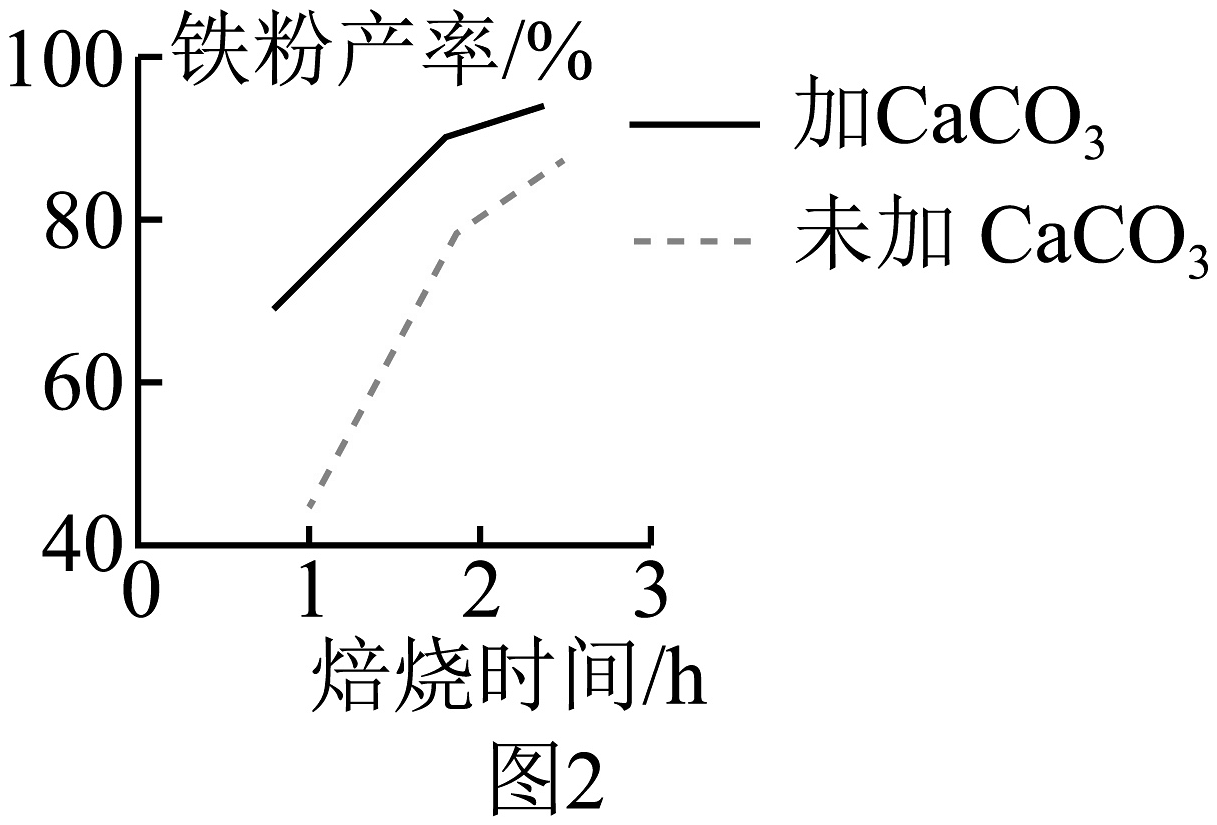
-
9、阅读下列科普短文,回答问题。
天然纤维你不陌生,高性能纤维你了解吗?
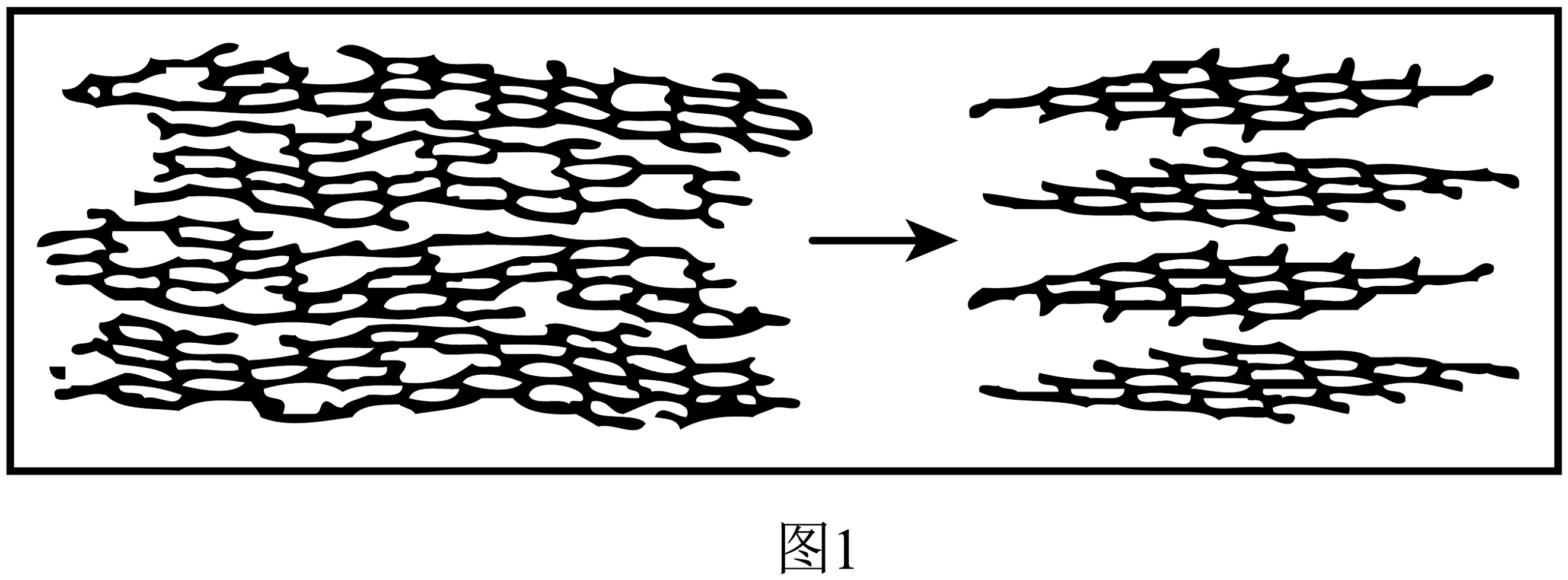
碳纤维,主要成分是碳。利用煤焦油或煤沥青等,经过“调制熔融纺丝→预氧化→碳化及石墨化”等工序可制得碳纤维。碳化反应能排出非碳原子,生成碳,石墨化反应前后的结构变化如图1。碳纤维强度大,密度小,但在温差变化大时容易变形。
芳纶纤维,主要成分是有机高分子聚合物,其强度特别高,经得起高速子弹的冲击。
玄武岩纤维,主要成分是二氧化硅、氧化铝和铁的氧化物等,其制备方法如图2。制备成本相对较低,耐高温、耐腐蚀,在-273.15~760℃条件下性质稳定且不发生形变,废弃后可在环境中生物降解,被誉为“21世纪绿色环保高性能基础材料”。
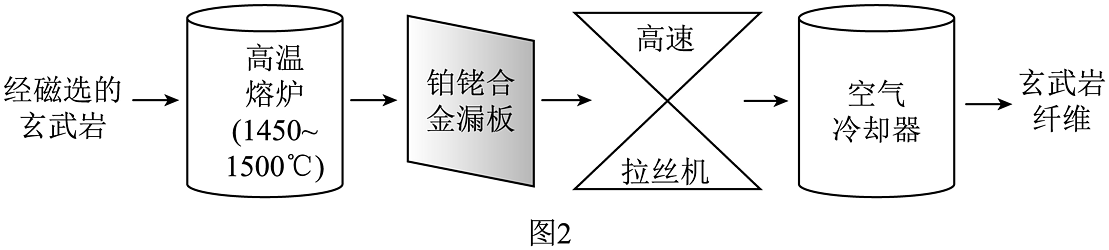 (1)、生活中的天然纤维有(写一种)。(2)、煤焦油和煤沥青是煤综合利用的产物,煤属于能源(填“可再生”或“不可再生”)。(3)、煤焦油石墨化前后物质的物理性质发生改变的本质原因是。(4)、加入高温熔炉前的玄武岩需要经过磁选,目的可能是除去含量较高的矿物,降低原料中的铁含量。铂铑合金的熔点1500℃(填“>”“=”或“<”)。(5)、下列有关高性能纤维的说法正确的是(双选,填序号)。
(1)、生活中的天然纤维有(写一种)。(2)、煤焦油和煤沥青是煤综合利用的产物,煤属于能源(填“可再生”或“不可再生”)。(3)、煤焦油石墨化前后物质的物理性质发生改变的本质原因是。(4)、加入高温熔炉前的玄武岩需要经过磁选,目的可能是除去含量较高的矿物,降低原料中的铁含量。铂铑合金的熔点1500℃(填“>”“=”或“<”)。(5)、下列有关高性能纤维的说法正确的是(双选,填序号)。a.碳纤维在空气中不能燃烧
b.芳纶纤维在军事上可用于制作防弹衣
c.月球上昼夜温差极大,悬挂的五星红旗优选玄武岩纤维
(6)、玄武岩纤维被誉为“21世纪绿色环保高性能基础材料”的原因是。 -
10、水乃万物之源。化学小组到自来水厂进行参观学习,并开展相关探究活动。(1)、自来水厂沉淀池中加入明矾的作用是。(2)、小组同学对水厂中净化过的水进行取样检测,发现水中含有较多钙、镁离子,说明该水为(填“硬水”或“软水”);实验室可以通过的方法得到净化程度较高的水。(3)、同学们从取水口取了一些没有净化的河水,分别设计并制作了如图1所示的简易净水器对其进行净化处理,其中较合理的是(填“A”或“B”)。
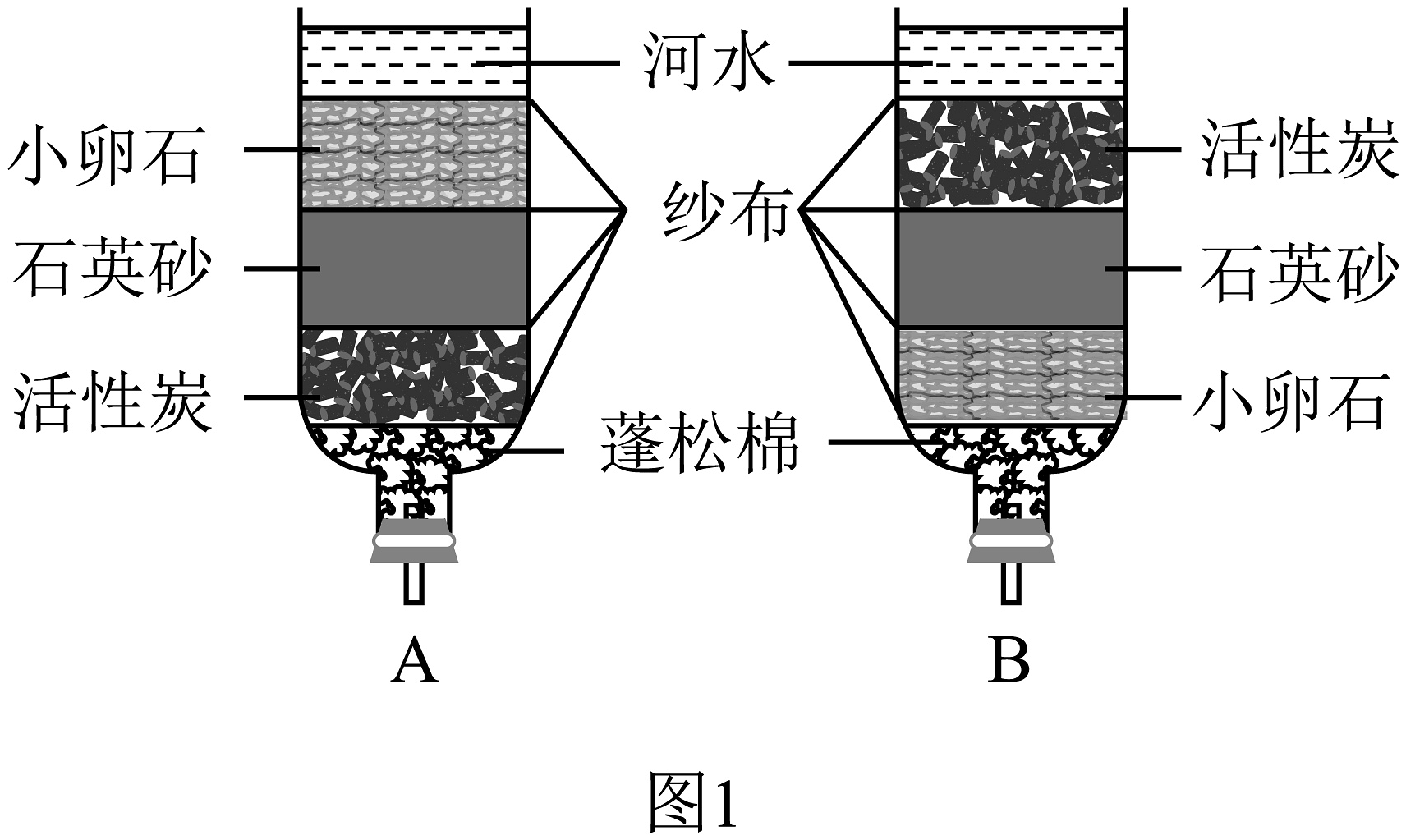 (4)、小组同学继续利用图2装置探究水的组成。该装置中,玻璃管b连接是的电源的极(填“正”或“负”),装置内发生反应的化学方程式为。
(4)、小组同学继续利用图2装置探究水的组成。该装置中,玻璃管b连接是的电源的极(填“正”或“负”),装置内发生反应的化学方程式为。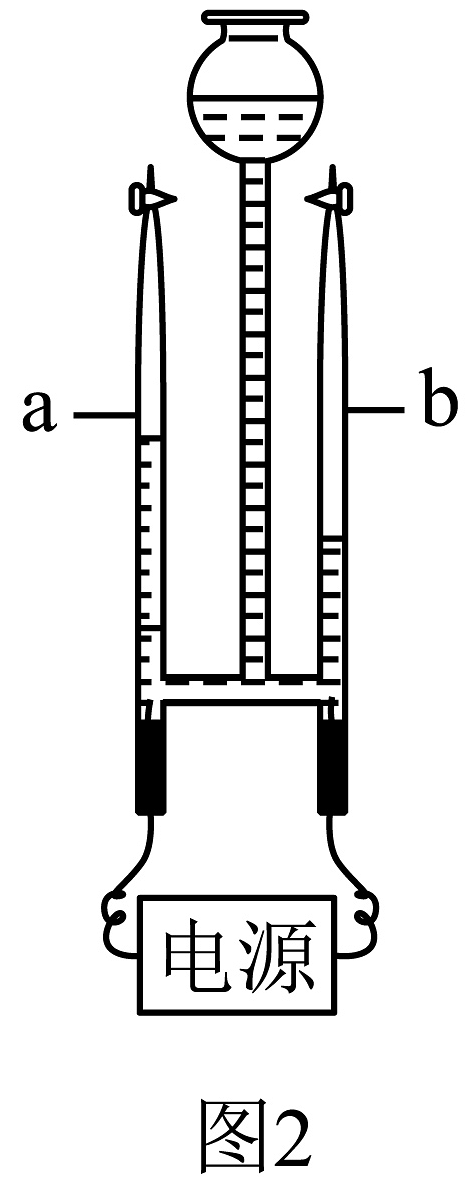
-
11、广西酸嘢由木瓜、芒果、菠萝等新鲜果蔬腌制而成,通常使用白米醋、白糖等作为腌制调料,口感脆爽,生津开胃。(1)、酸嘢中的水果含有丰富的水、糖类和等营养物质。(2)、用铁质刀具切完水果后,为防止其生锈,你的建议是。(3)、一些人在吃酸嘢时喜欢加入辣椒粉丰富口感,辣椒中最主要的辣味物质是辣椒素(C18H27NO3),其中碳、氧元素的质量比为。(4)、胃酸过多患者不宜食用太多酸嘢,否则会导致病情加重。下列物质可用于治疗胃酸过多的药物是(填序号),其与胃酸发生反应的化学方程式为。
a.氢氧化钾 b.氢氧化铝 c.氧化铜
-
12、中国酿酒历史源远流长。《礼记》记载了酿酒的“六必”原则,其中包含“秫稻必齐”“火齐必得”“陶器必良”等。请回答下列问题:(1)、“秫稻必齐”:用谷筛筛去小颗粒的秫和稻,从而获得颗粒饱满、均匀的高粱和稻米,该法与实验室操作的原理类似。(2)、“火齐必得”:酿酒过程中必须调控好温度。30℃时,葡萄糖(C6H12O6)在酶的作用下发酵产生酒精和二氧化碳。
①写出葡萄糖发酵的化学方程式:。
②为防止发酵过程中产生的二氧化碳过多积聚导致酿酒的容器爆炸,可采取的一种有效措施是。
(3)、“陶器必良”:打开盛放白酒的陶瓷瓶,闻到一股酒香,原因是。 -
13、用合适的化学用语填空。(1)、镁元素。(2)、5个磷原子。(3)、二氧化锰。(4)、1个硫离子。(5)、氖气。(6)、硫酸铝中的阳离子。
-
14、下列实验设计能达到实验目的的是
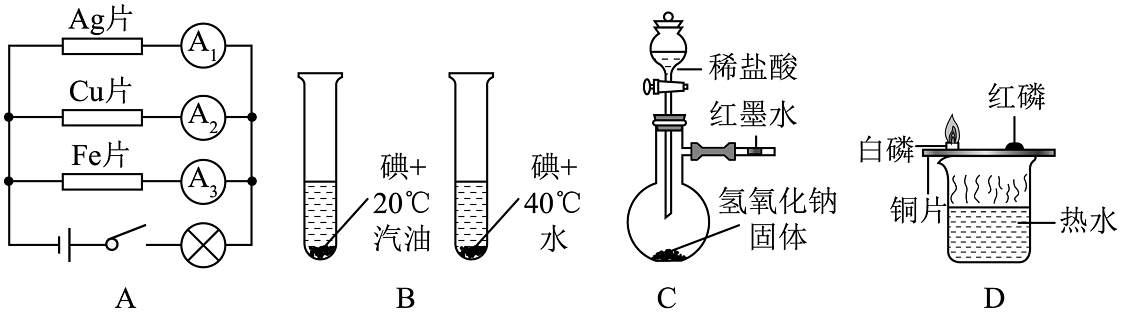 A、比较银、铜、铁的导电性 B、探究温度对物质溶解性的影响 C、验证中和反应放出热量 D、验证燃烧需要可燃物
A、比较银、铜、铁的导电性 B、探究温度对物质溶解性的影响 C、验证中和反应放出热量 D、验证燃烧需要可燃物 -
15、“劳动创造美好生活”。下列劳动实践与对应的化学知识没有直接关联的是
选项
劳动实践
化学知识
A
用炉具清洁剂去除油污
炉具清洁剂中的氢氧化钠能与油脂反应
B
燃气灶火焰呈黄色,调大进风口
提供充足的空气,使燃料充分燃烧
C
用氯化钠腌渍食物,延长保质期
氯化钠易溶于水
D
在面粉厂安装防静电装置
防止发生粉尘爆炸
A、A B、B C、C D、D -
16、碳酸钠和碳酸钾的溶解度曲线如图。下列说法正确的是
 A、碳酸钠的溶解度随温度升高而增大 B、碳酸钾溶液降温后一定有晶体析出 C、30℃时,碳酸钠饱和溶液的溶质质量分数为40% D、30℃时,等质量的碳酸钠和碳酸钾的饱和溶液中溶质质量:碳酸钾>碳酸钠
A、碳酸钠的溶解度随温度升高而增大 B、碳酸钾溶液降温后一定有晶体析出 C、30℃时,碳酸钠饱和溶液的溶质质量分数为40% D、30℃时,等质量的碳酸钠和碳酸钾的饱和溶液中溶质质量:碳酸钾>碳酸钠 -
17、核心素养是学科育人价值的集中体现。下列说法正确的是A、化学观念:原子不显电性是因为原子中没有带电荷的粒子 B、科学思维:水是常见的溶剂,所以水可以溶解所有物质 C、科学探究与实践:用带有火星的木条可比较呼出气体和空气中的氧气含量 D、科学态度与责任:将生活垃圾分类回收,实现资源的回收再利用
-
18、下列物质间的转化不能通过一步反应实现的是A、H2SO4→Na2SO4→NaCl B、Ba(NO3)2→KNO3→NaNO3 C、Mg→MgO→MgCl2 D、CaO→Ca(OH)2→CaCO3
-
19、近日,美国加州南部爆发大规模山火,当地消防部门采取多种措施进行扑救。下列说法错误的是A、长期堆积的桉树叶可能因缓慢氧化自燃而起火 B、在火灾现象喷洒阻燃剂的目的是降低植被的着火点 C、砍掉部分林木形成隔离带灭火,原理是隔离可燃物 D、预防山火需要加强宣传教育,严禁任何火种进山
-
20、下列有关碳和碳的氧化物的说法正确的是A、常温下碳单质的化学性质比较活泼 B、木炭和一氧化碳都能用于冶炼金属 C、二氧化碳能使干燥的紫色石蕊纸条变红 D、一氧化碳和二氧化碳都有毒