-
1、生产印刷电路板时,把预先设计好的电路用耐腐油墨印刷在敷铜板上,然后将敷铜板浸入氯化铁溶液中,未被油墨覆盖的铜箔被腐蚀掉,最后将油墨清洗即可得到电路板。废液处理的工艺流程图如“图1”所示。
 (1)、操作a的名称是。(2)、写出FeCl3溶液与敷铜板反应生成FeCl2和CuCl2的化学方程式:。(3)、从节能角度看,(填“途径Ⅰ”或“途径Ⅱ”)更优越。(4)、途径Ⅱ中FeCl3溶液循环利用的优点:。(5)、“图2”表示铁元素的化合价与物质类别的关系,“→”表示物质之间可以转化。
(1)、操作a的名称是。(2)、写出FeCl3溶液与敷铜板反应生成FeCl2和CuCl2的化学方程式:。(3)、从节能角度看,(填“途径Ⅰ”或“途径Ⅱ”)更优越。(4)、途径Ⅱ中FeCl3溶液循环利用的优点:。(5)、“图2”表示铁元素的化合价与物质类别的关系,“→”表示物质之间可以转化。①氯化铁是图2中的(填字母)物质。
②反应B→C中的现象为;铁元素属于人体中的(填“常量”或“微量”)元素。
③B→A反应的化学方程式为。
-
2、广东省湛江市是甘蔗的主要产区之一,化学兴趣小组想在校内农场种植甘蔗,围绕学校周边农田进行了项目式探究活动。(1)、与甘蔗初相识
ⅰ.《齐民要术》云:“斩而食之,既甘;迮取汁为饴饧,名之曰糖”,描述了古人砍甘蔗、榨汁喝(如图1)的场景,其中榨汁过筛的过程与下列哪项实验基本操作类似?(填字母)。
A.过滤 B.溶解 C.加热
ⅱ.9月8日广东新闻报道,湛江遂溪县几千亩甘蔗出现倒伏现象(如图2)。种植甘蔗时为防止出现倒伏情况应该适当施用肥(填“氮”、“磷”或“钾”)。
 (2)、为甘蔗择良田
(2)、为甘蔗择良田任务一测定土壤的酸碱性
【查阅资料】最适宜种植甘蔗的土壤酸碱度为5.5~7.5.
【实地探究】小华同学用pH计分别测定了学校周围三处农田的酸碱度,记录如下:
农田编号
A
B
C
测得的pH值
8.5
6.8
5.1
【数据分析】学校周围编号(填“A”、“B”或“C”)处农田最适宜种植甘蔗。
任务二查明土壤pH偏高/低的原因
【走访调查】经调查,学校周边农田曾施用了大量铵态氮肥——(NH4)2SO4和(NH4)2CO3(前者水溶液呈酸性,后者水溶液呈碱性)。
【提出问题】土壤样品中的铵态氮肥是什么?
【作出猜想】
猜想1:(NH4)2CO3猜想2:(填化学式)猜想3:(NH4)2CO3和(NH4)2SO4
【实验探究】分别取少量A、C土壤浸出液于试管中:
样品序号
操作
现象
结论
A
分别加入足量稀硝酸,再滴入硝酸钡溶液。
有气泡产生
含
C
含(NH4)2CO3和(NH4)2SO4
【分析讨论】操作中加入足量稀硝酸的作用。
(3)、为甘蔗护环境任务三处理实验后废液
【学以致用】
小华同学用熟石灰处理了样品A实验后所得溶液,并用pH传感器测定了该过程中溶液pH的变化情况,结果如图3所示,你认为哪一点的废液可以直接排放,并给出理由。

我认为(填“a”、“b”或“c”)点废液可以直接排放,因为。
-
3、
Ⅰ.气体的制取和性质
如图1为实验室常用的制取气体的仪器,据此回答下列问题。

(1)仪器④的名称________;
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为________;若要用高锰酸钾制取较为纯净的氧气,可选择的发生和收集装置为________。
(3)同学们做实验时发现产生氧气的速率太快,为获得平稳的气流,于是对实验装置进行了如图改进,如图2发生装置中能达到最佳效果的是________(填序号)。

Ⅱ.跨学科实践
为模拟火箭的设计与发射,兴趣小组组建“气火箭队”和“水火箭队”。

火箭类型
氢气“气火箭”
二氧化碳“气火箭”
试剂选择
锌粒和稀硫酸
小苏打和食醋
(4)从安全角度分析,模拟火箭不选择氢气“气火箭”的原因可能是________。
(5)兴趣小组最终选择小苏打和食醋作“气火箭”,如图3为“气火箭”的实验步骤:组装好后设备后,应先________,再添加试剂。
(6)请写出小苏打和食醋(主要成分醋酸化学式CH3COOH)反应的方程式________。
(7)利用物理方法推动火箭如图4所示,用打气筒向高压仓内打气,打开线闸开关进行发射。在此过程中,仓内气体不会改变的有_____(填字母)
A. 分子的数目 B. 原子的种类 C. 元素的种类 D. 分子的间隔 -
4、风电制氢:绿色能源的新希望
随着全球对清洁能源需求的攀升,风电制氢技术成为解决能源问题的关键路径。这项技术将风能先转化为电能,再用电解水的方式产生氢气,实现清洁能源的深度转化。
这项技术对能源领域意义重大。风力发电存在输出不均衡、风电输送和消纳困难等缺陷。风电制氢能将过剩电能转化为氢能储存,在需要时通过燃料电池发电重回电网,解决了风电消纳难题。同时,氢气作为清洁能源,燃烧产物仅为水,可替代传统化石能源用于工业生产、钢铁冶炼,还能为氢燃料电池汽车提供动力,推动工业与交通领域的绿色转型。
不过,风电制氢目前仍面临成本高、设备贵、储运难等挑战。但随着技术进步,这些问题正逐步得到改善。未来,风电制氢有望构建清洁、高效、可持续的能源体系,成为能源转型的重要支柱,为绿色生活提供有力支撑。
根据上文,回答问题:
(1)、风电制氢的化学方程式 , 该反应属于(填反应类型)。(2)、风点电存在的缺陷 , 风电制氢将能转化为化学能;风电制氢技术投入生产的意义 , 目前面临的挑战。(3)、下列属于清洁能源的是(多选,填字母)。a.风能 b.氢能 c.石油 d.生物质能
-
5、芜湖铁画——“以铁为墨”的非遗艺术
将铁片和铁丝加热软化后,使用锤子、钳子等工具不断地进行锻打焊接,造出铁画的整体造型。
铁片烧红后沾水淬火,能提升铁器的硬度,高温下铁和水蒸气会反应生成四氧化三铁和氢气。
用热烘松香柏油当漆,涂在铁画上防止锈蚀,同时增加光泽度和显出黑色。



①锻铁
②淬火
③上漆
(1)、铁合金的硬度比铁的硬度(填“大”或“小”);“锻铁”是指通过炼制和锻打,调节铁合金中(填名称)元素的含量,以改变铁合金的性能。(2)、铁合金属于(填“合成材料”或“金属材料”)。(3)、“淬火”时发生的化学反应方程式。(4)、“上漆”可以防止铁画锈蚀,铁锈蚀的原理是铁和(填名称)共同反应。 -
6、物质的鉴别、检验、除杂和分离是重要的实验技能。下列实验方案设计正确的是
选项
实验目的
实验设计
A
鉴别氢气、甲烷
分别点燃,在火焰上方罩一个用澄清石灰水润湿内壁的烧杯
B
检验溶液中是否含氯化钠
取样,滴加几滴硝酸银溶液,观察现象
C
除去CuSO4溶液中混有的H2SO4
加入足量铜充分反应,过滤
D
分离CaO与CaCO3固体混合物
加水充分溶解后,过滤
A、A B、B C、C D、D -
7、结合NaCl和MgSO4的溶解度曲线分析,下列说法正确的是
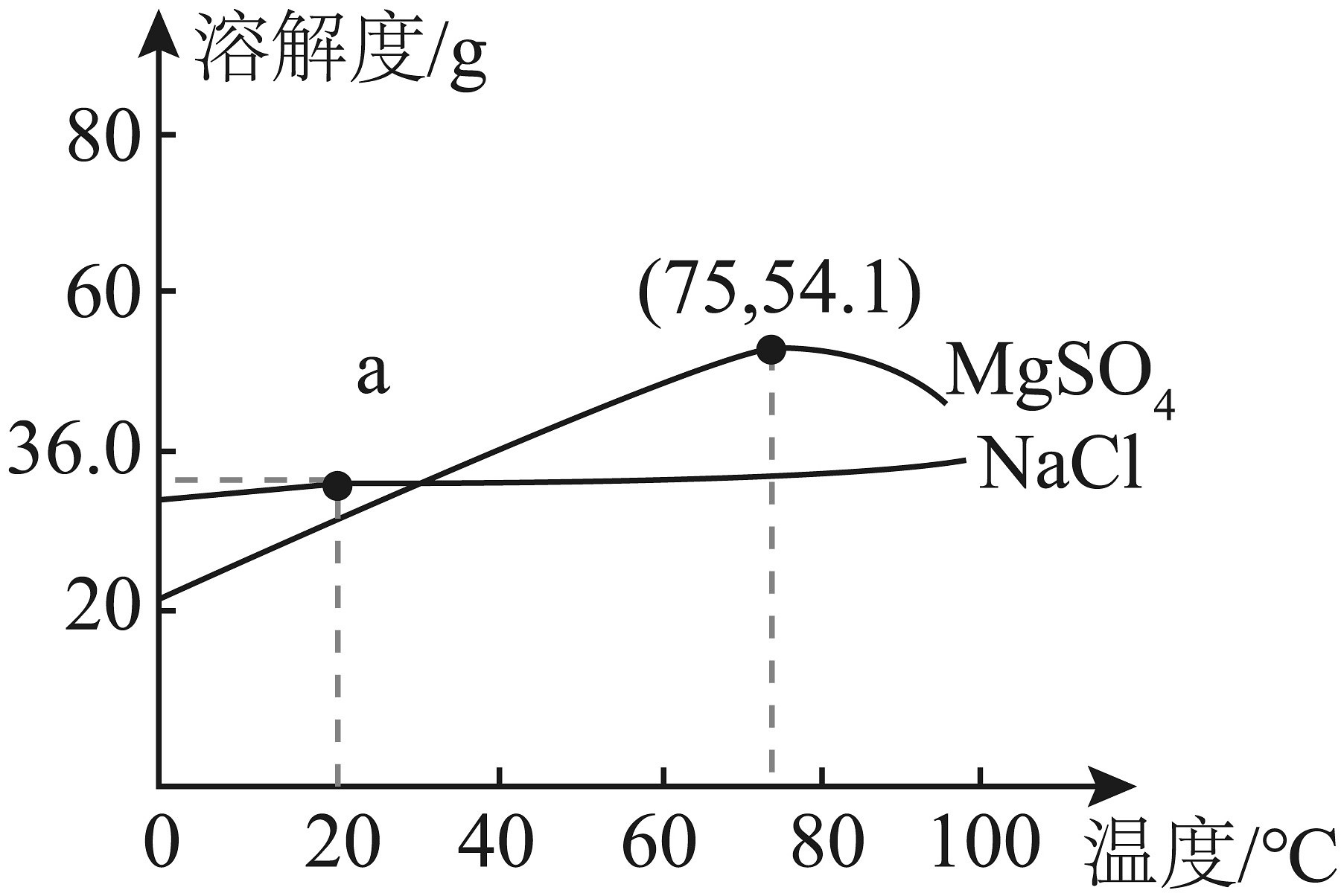 A、NaCl的溶解度为36g B、75℃时,MgSO4饱和溶液的溶质质量分数为54.1% C、两种饱和溶液由75℃降至20℃时,NaCl析出晶体更多 D、可以通过蒸发结晶的方式从混合溶液中提取氯化钠
A、NaCl的溶解度为36g B、75℃时,MgSO4饱和溶液的溶质质量分数为54.1% C、两种饱和溶液由75℃降至20℃时,NaCl析出晶体更多 D、可以通过蒸发结晶的方式从混合溶液中提取氯化钠 -
8、金属蚀刻画能呈现凹版画特有的艺术魅力。如图1是蚀刻模型,胶膜不与蚀刻液反应。某蚀刻废液的溶质主要是FeCl2、CuCl2 , 还有少量FeCl3、HCl。有研究组将铁粉加入此废液中进行探究,得到盐的转化率、酸的浓度与铁粉用量(理论用量的倍数)的关系如图2.请结合图1图2完成下列小题。
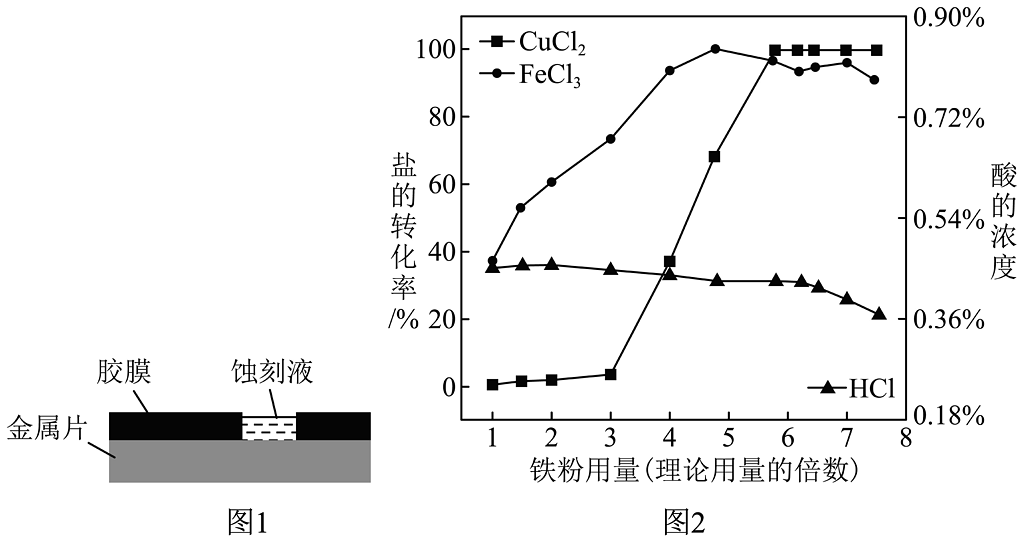 (1)、若要用铜片制作蚀刻画,下列试剂可用作蚀刻液的是A、石灰水 B、NaOH溶液 C、AgNO3溶液 D、FeSO4溶液(2)、为高效回收铜,生产中铁粉用量(理论用量的倍数)应选择A、1 B、3 C、5 D、7
(1)、若要用铜片制作蚀刻画,下列试剂可用作蚀刻液的是A、石灰水 B、NaOH溶液 C、AgNO3溶液 D、FeSO4溶液(2)、为高效回收铜,生产中铁粉用量(理论用量的倍数)应选择A、1 B、3 C、5 D、7 -
9、如图是钠元素在元素周期表中的信息和钠原子结构示意图。下列说法正确的是
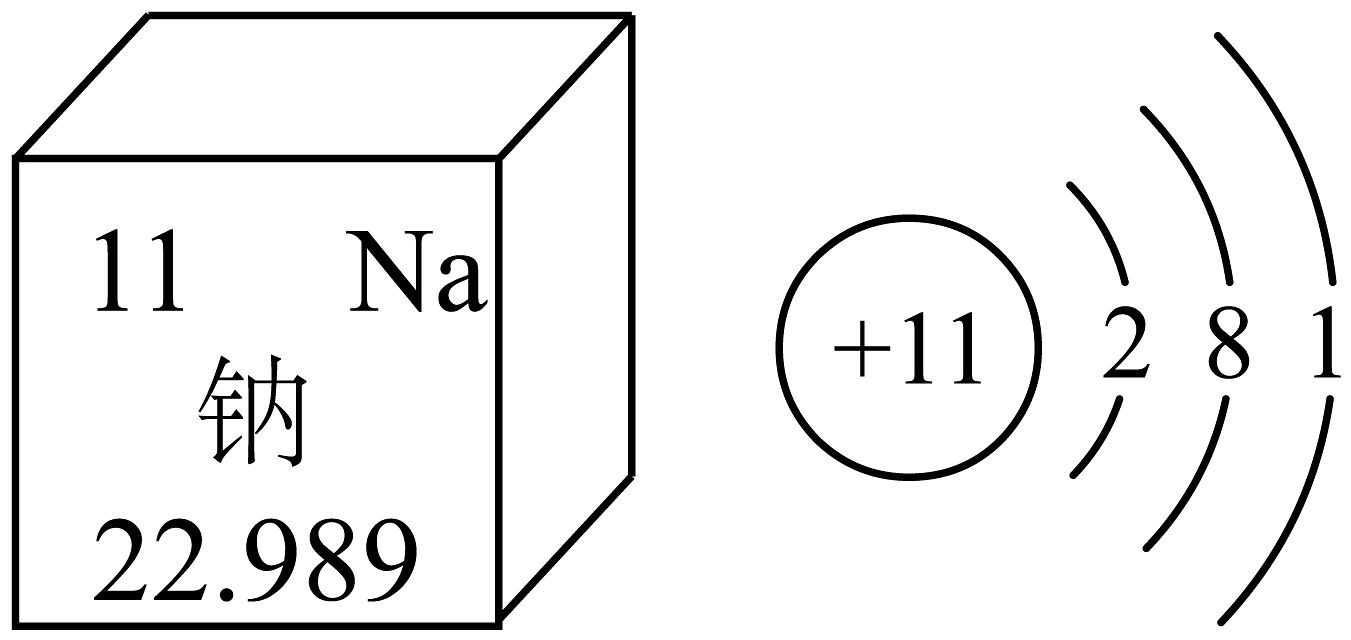 A、钠元素为非金属元素 B、钠原子的相对原子质量是22.989g C、钠原子的核外电子数为11 D、化学反应中,钠原子易得到电子变为钠离子
A、钠元素为非金属元素 B、钠原子的相对原子质量是22.989g C、钠原子的核外电子数为11 D、化学反应中,钠原子易得到电子变为钠离子 -
10、劳动教育是中小学生的必修课程。下列劳动方法或解释不合理的是
序号
劳动内容
劳动方法
化学知识解释
A
洗有涂层的锅
不能用钢刷刷洗
钢刷会破坏涂层,加快锅体腐蚀
B
生火做饭
燃烧木柴
木柴燃烧属于放热反应
C
清洗炉具
加炉具清洁剂
氢氧化钠能和油脂反应
D
消除水壶水垢
添加食盐
食盐可与水垢反应
A、A B、B C、C D、D -
11、2025年春晚,一款高科技人形机器人因其灵活的动作引发关注,其外壳采用了PEEK材料[物质化学式为(C19H12O3)n]。该种材料在医疗器械、汽车工业、航空航天等领域被广泛应用。下列有关该物质的说法中,不正确的是A、该物质属于有机高分子化合物 B、该物质中含有O3分子 C、该物质中含碳、氢、氧元素 D、该物质中氢元素的质量分数最小
-
12、下列科学家与其取得的重大化学成就不相符的是A、范旭东研究出制精盐技术 B、张青莲教授研发了石油化工生产催化剂 C、侯德榜发明了联合制碱法 D、屠呦呦用乙醚冷萃提高了青蒿素的提取率
-
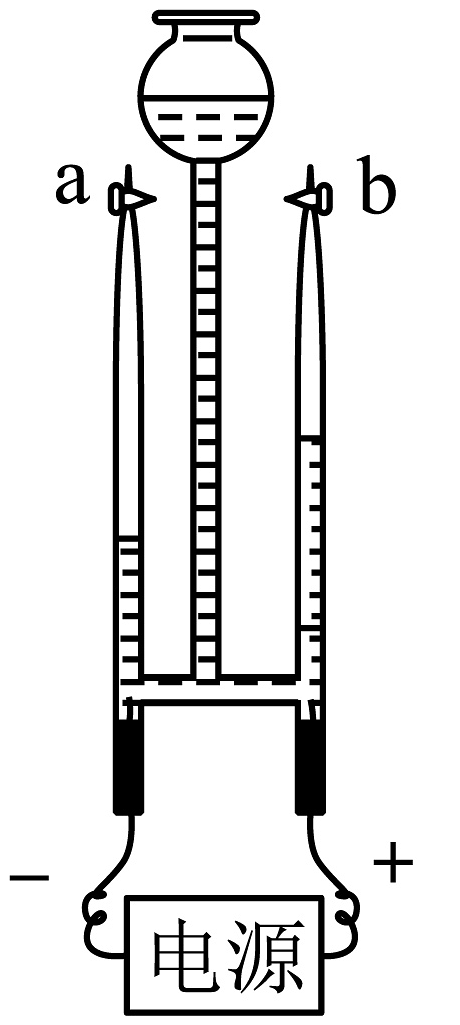
13、水是一切生命赖以生存的重要物质基础。天然水一般要经过自来水厂净化处理后才能变成生活用水。(1)、认识水
电解水实验如图所示,a、b玻璃管上方生成的气体体积比约为。
 (2)、净化水
(2)、净化水自来水厂净水过程如下图所示,其中主要发生化学变化的是步骤(填序号)。
 (3)、使用水
(3)、使用水煮沸是一种有效的杀菌方法。为求证“喝反复煮沸的饮用水会造成亚硝酸盐中毒”的真伪,学习小组以煮沸52次的桶装水为水样,利用下述反应测定亚硝酸盐的含量(以NaNO2计):2NaNO2+2KI+2HSO4=2NO↑+I2+2H2O+K2SO4+Na2SO4。结果表明,1L水样反应时产生了5.08×10-3mg的I2。
①计算1L水样中NaNO2的质量。
②查阅《食品安全国家标准(GB2762-2022)》,经换算,合格饮用水中NaNO2的含量应低于7.50×10-3mg。结合计算结果,得出的结论是:喝反复煮沸的饮用水(填“会”或“不会”)造成亚硝酸盐中毒。
(4)、爱护水为了人类社会的可持续发展,我们必须保护水资源。请例举一项保护水资源的措施。
-
14、碳酸亚铁(FeCO3)可用于制作补铁药剂。用赤铁矿烧渣(主要成分为Fe2O3、SiO2等)和煤粉为原料,制备碳酸亚铁的生产工艺示意图如下图所示:
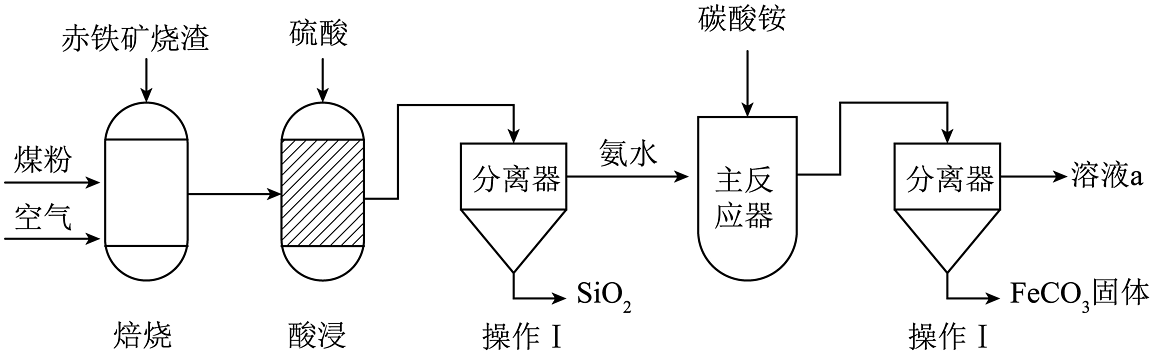
【资料】40℃以上时,(NH4)2CO3易分解。
(1)、“焙烧”前,粉碎处理赤铁矿烧渣的目的是。(2)、“焙烧”中,存在Fe2O3被CO还原为单质铁的反应,该反应的化学方程式为。(3)、“酸浸”中,要注意通风并避免明火,原因是。(4)、“操作Ⅰ”的名称为。加入氨水的目的是调节溶液的pH,加入碳酸铵后还需要的调控的条件是。(5)、“主反应器”中FeSO4与(NH4)2CO3发生复分解反应,该反应的化学方程式为。(6)、溶液a中可回收一种化工产品,写出其在农业中的一种用途。 -
15、
某校兴趣小组从化学视角对我国造纸工艺开展了系列研学活动。
活动一:了解我国古代造纸技术

(1)“草木灰水”中含有K2CO3 , K2CO3属于(填“酸”“碱”或“盐”)。
(2)“石灰”即生石灰,加水“调乳”的化学方程式为。
活动二:了解现代造纸生产
古法制浆用石灰脱脂脱色能力强,但成纸强度低,现代造纸对蒸煮试剂进行改良,使用NaOH。某造纸厂对造纸废弃物进行处理,经检验“蒸煮”后过滤所得溶液中存在Na2CO3。
【查阅资料】BaCl2溶液显中性,BaCO3为难溶于水的白色固体。
【实验探究】
(3)兴趣小组同学设计如下实验,证明滤液中还含有NaOH。
实验操作
实验现象
实验结论
I.取少量“蒸煮”后过滤所得溶液于试管中,向其中滴加足量BaCl2溶液,观察现象。
含Na2CO3
Ⅱ.
溶液变红色
含NaOH
【拓展交流】造纸厂废水主要含有NaOH和一些细小纤维有机物及沉淀物,如果不经处理或轻度处理就将废水直接排放,会造成严重的污染。
(4)某造纸厂利用pH计和COD传感器(可以用来表示废水中总有机物含量)测得在污水处理过程中溶液pH和COD变化情况(如图所示)。当废水的pH在6~9之间,COD的指标范围为 , 便可排放。

(5)该造纸厂进行废液处理时,在“硫酸调节池”中发生反应的化学方程式为(写一个)。
-
16、“液态阳光”即“清洁甲醇”和“绿色甲醇”,是指生产过程中碳排放极低或为零时制得的甲醇。“液态阳光”生产、运输及使用过程如图所示。
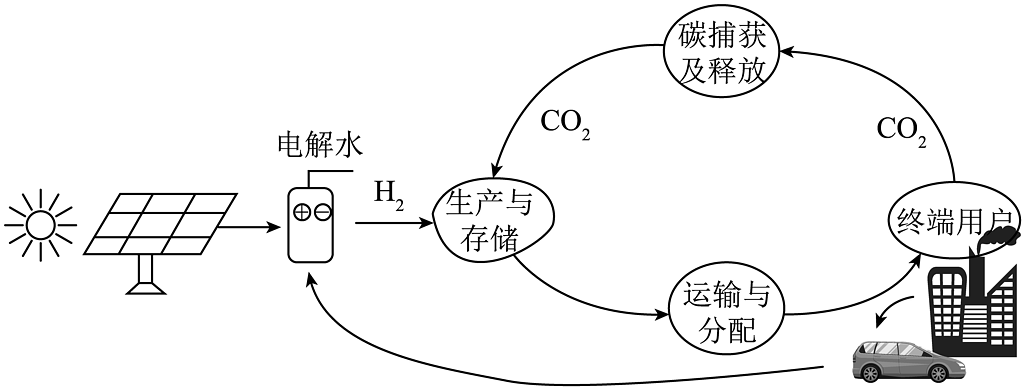
常温常压下,甲醇为液体,具有毒性,误饮后对人体有严重伤害,但作为能源,甲醇具有储运安全、排放清洁、可再生等特点。
依据上文,回答问题。
(1)、“液态阳光”生产利用的可再生能源是。(2)、一定条件下H2与CO2反应生成甲醇的微观示意图如图所示: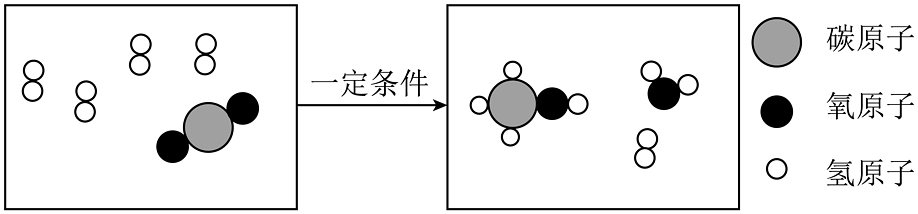
由图可知,甲醇由种元素组成,参加反应的H2与CO2分子个数比为。
(3)、误食甲醇会对人体有伤害,是因为。(4)、加压水洗法可捕集CO2 , 是因为压强增大时CO2在水中的溶解度(填“增大”“不变”或“减小")。CO2也能与水反应,该反应属于反应(填基本反应类型)。(5)、除了利用可再生能源进行生产外,再写一条“液态阳光”作为能源的优点。 -
17、欲证明“CO2与NaOH能发生化学反应”,某化学兴趣小组进行如图所示实验:①将滴有酚酞试液的适量氢氧化钠溶液快速推入瓶内,振荡充分反应;②待压强不再减小后,再将适量的稀盐酸快速推入瓶内,振荡充分反应;③待压强不再增大后,将两个注射器活塞先后拉回原位(不进行活塞操作时,活塞不能自主移动)。瓶内压强变化如图2所示。下列说法错误的是
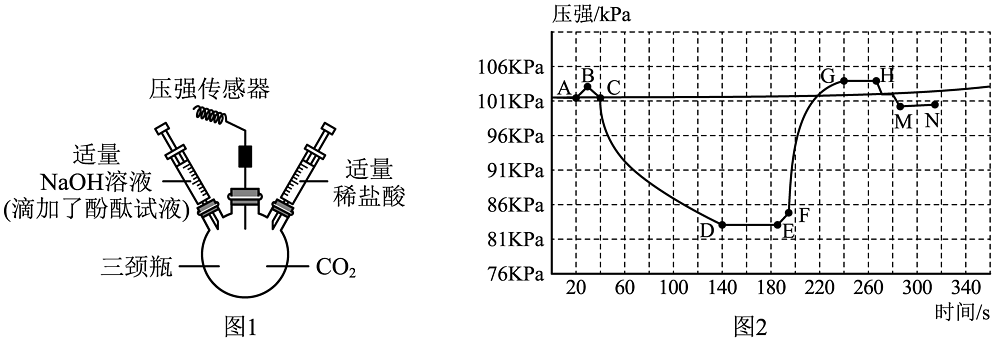 A、步骤①现象为三颈瓶中溶液由红色变为无色 B、步骤②观察到有气泡产生,说明CO2能与NaOH反应 C、DE段压强远低于MN段压强,说明CO2能与NaOH反应 D、MN段的压强比初始压强低,说明瓶内的水能吸收CO2
A、步骤①现象为三颈瓶中溶液由红色变为无色 B、步骤②观察到有气泡产生,说明CO2能与NaOH反应 C、DE段压强远低于MN段压强,说明CO2能与NaOH反应 D、MN段的压强比初始压强低,说明瓶内的水能吸收CO2 -
18、下列实验方法不能达到实验目的的是
选项
实验目的
实验方法
A
鉴别合成纤维和羊毛
灼烧,闻气味
B
检验过氧化氢溶液是否完全变质
加入MnO2 , 观察是否有气泡生成
C
除去NaCl中混有的少量KNO3
加水溶解,蒸发结晶,趁热过滤
D
验证Zn、Cu的金属活动性强弱
将Zn、Cu分别放入AgNO3溶液中,观察现象
A、A B、B C、C D、D -
19、下列与氧气有关的实验中,说法正确的是
 A、实验甲:制取氧气,可以控制反应的发生与停止 B、实验乙:干燥氧气,洗气瓶中盛装的液体为浓盐酸 C、实验丙:收集氧气,气体从导管b进,从导管a出 D、实验丁:对比通入氧气前后白磷的状态,验证燃烧需要氧气
A、实验甲:制取氧气,可以控制反应的发生与停止 B、实验乙:干燥氧气,洗气瓶中盛装的液体为浓盐酸 C、实验丙:收集氧气,气体从导管b进,从导管a出 D、实验丁:对比通入氧气前后白磷的状态,验证燃烧需要氧气 -
20、劳动创造幸福。下列劳动项目包含了化学知识,相关解释错误的是
选项
劳动项目
相关解释
A
洗净并擦干炒菜后的铁锅
铁在潮湿空气中易生锈
B
洗好的衣服在太阳下晾晒
温度越高,分子运动越快
C
用活性炭制作简易净水器
活性炭常温下是黑色固体
D
用白醋除去水壶中的水垢
白醋能与水垢反应生成可溶性物质
A、A B、B C、C D、D