-
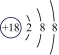
1、某微粒的结构示意图为+n28.若该微粒是原子,则该微粒含有的质子数为;若该微粒为阳离子,则n10(填“>”“<”或“=”);若该微粒为阴离子,则其对应的原子的核外电子层数为.
-
2、学习化学后,我们学会了从微观角度认识物质.(1)、已知碳原子和氧原子的结构示意图为:+634和+8 , 两种原子中相等的是____(填序号).A、质子数 B、电子数 C、第一层电子数 D、第二层电子数(2)、保持一氧化碳化学性质的粒子名称是.(3)、下图是一氧化碳与氧气反应的微观模型图,请在下图方框中以图示的方式完成该化学反应的微观过程(图中“●”表示氧原子,“◯”表示碳原子).
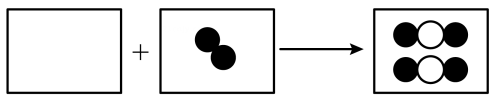
-
3、如图是1~18号元素原子最外层电子数与原子核电荷数的关系图.试回答:
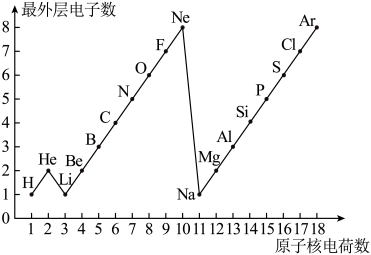 (1)、一个水分子共有个原子核,个质子.(2)、一个Mg2+核外共有 个电子,Cl-的最外层电子数和原子的最外层电子数相同.(3)、通过该图你能发现哪些规律?请写出其中一个:
(1)、一个水分子共有个原子核,个质子.(2)、一个Mg2+核外共有 个电子,Cl-的最外层电子数和原子的最外层电子数相同.(3)、通过该图你能发现哪些规律?请写出其中一个: -
4、用化学符号表示:(1)、3个铁离子;(2)、4个硫酸根离子.
-
5、某粒子的结构示意图为
 (其中n≠0),请回答下列问题 (1)、n的最大值为.(2)、若该粒子带两个单位的负电荷,则其对应的化学符号为;由+6价的该元素形成的常见酸的化学式为.(3)、若m-n=10,则该粒子对应的常见金属元素有(写元素符号).
(其中n≠0),请回答下列问题 (1)、n的最大值为.(2)、若该粒子带两个单位的负电荷,则其对应的化学符号为;由+6价的该元素形成的常见酸的化学式为.(3)、若m-n=10,则该粒子对应的常见金属元素有(写元素符号). -
6、如图为6种原子的结构示意图:
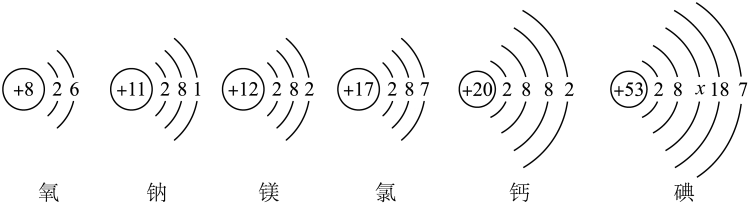 (1)、图中六种元素之间的最本质区别是.(2)、镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学符号为;氧化钠由钠离子和氧离子构成,氧化钠的化学式为.(3)、从原子结构上分析,图中哪两种元素具有相似的化学性质(填元素符号)、.(4)、在上述碘的原子结构示意图中,x=.
(1)、图中六种元素之间的最本质区别是.(2)、镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学符号为;氧化钠由钠离子和氧离子构成,氧化钠的化学式为.(3)、从原子结构上分析,图中哪两种元素具有相似的化学性质(填元素符号)、.(4)、在上述碘的原子结构示意图中,x=. -
7、在通常状况下,硫是一种黄色粉末,下图是硫元素的某种粒子的结构示意图:
 (1)、硫原子的核内质子数为.(2)、图中所示粒子的符号为.(3)、硫在氧气中燃烧,发出蓝紫色火焰,该反应的化学方程式为.
(1)、硫原子的核内质子数为.(2)、图中所示粒子的符号为.(3)、硫在氧气中燃烧,发出蓝紫色火焰,该反应的化学方程式为. -
8、下列说法中错误的是( ).A、阳离子一定带有正电荷 B、带电荷的原子团一定是酸根 C、具有相同质子数的粒子不一定是同一种元素 D、最外层电子数为8的粒子不一定是稀有气体元素的原子
-
9、钠是人体必需的常量元素,如图是钠原子结构示意图.下列说法正确的是( ).
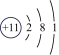 A、钠的相对原子质量为11g B、钠原子在化学反应中易失去电子 C、钠由液态变成气态,微粒间间隔变小 D、人体缺钠会导致甲状腺疾病
A、钠的相对原子质量为11g B、钠原子在化学反应中易失去电子 C、钠由液态变成气态,微粒间间隔变小 D、人体缺钠会导致甲状腺疾病 -
10、硅是发展信息技术的关键材料.右图为硅的原子结构示意图,下列说法正确的是( ).
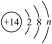 A、硅属于稀有气体元素 B、图中n 的值为8 C、硅的相对原子质量为14 D、硅元素位于第三周期
A、硅属于稀有气体元素 B、图中n 的值为8 C、硅的相对原子质量为14 D、硅元素位于第三周期 -
11、下列粒子结构示意图,表示阴离子的是( ).A、
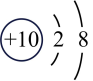 B、
B、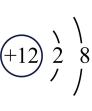 C、
C、 D、
D、
-
12、现榨的苹果汁在空气中会由浅绿色变为棕黄色.你猜测其原因可能是( ).A、苹果汁中含有OH- B、苹果汁中含有Cu2+ C、苹果汁中的Fe2+变成Fe3+ D、苹果汁中含有Na+
-
13、在“宏观—微观—符号”之间建立联系是化学学科特有的思维方式.对如图所示信息的分析不正确的是( ).
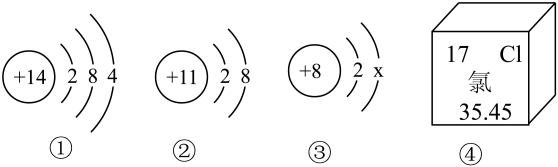 A、硅单质是制造芯片的重要材料,图①是硅原子的结构示意图 B、图②对应的元素属于金属元素 C、图②④对应元素组成的化合物是由分子构成的 D、若图③中x的值为8,则其粒子符号为O2-
A、硅单质是制造芯片的重要材料,图①是硅原子的结构示意图 B、图②对应的元素属于金属元素 C、图②④对应元素组成的化合物是由分子构成的 D、若图③中x的值为8,则其粒子符号为O2- -
14、右图为某粒子的结构示意图,下列说法正确的是( ).
 A、该粒子有12个质子 B、该粒子有2个电子层 C、该粒子属于非金属元素 D、该粒子已达到相对稳定结构
A、该粒子有12个质子 B、该粒子有2个电子层 C、该粒子属于非金属元素 D、该粒子已达到相对稳定结构 -
15、下列符号所表示的粒子中,能保持氯气化学性质的最小粒子是( ).A、Cl B、Cl- C、Cl2 D、ClO3
-
16、下列离子中,所带电荷数与该离子的核外电子层数相等的是( ).A、Al3+ B、Mg2+ C、Be2+ D、H+
-
17、下表是核电荷数为3~18的元素原子的核外电子排布示意图.
Li
Be
B
C
N
O
F
Ne
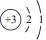



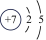


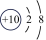
Na
Mg
Al
Si
P
S
Cl
Ar
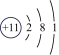

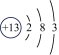
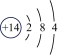

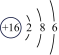
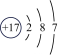
 (1)、上表中每一横行的元素原子核外电子排布的特点是;
(1)、上表中每一横行的元素原子核外电子排布的特点是;每一纵行的元素原子核外电子排布的特点是.
(2)、若将氢、氦元素也排入上表,已知氦元素原子的核外电子排布为 , 可得到以下两种形式:
, 可得到以下两种形式:
你同意种排列方式,针对氦元素说明你选择的理由是.
-
18、根据原子结构的知识和图中信息填空.
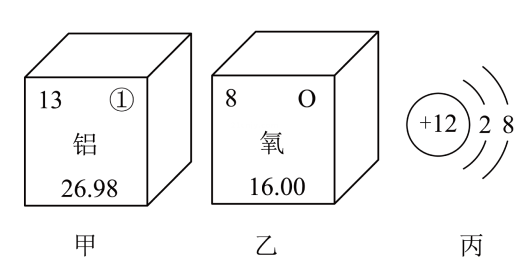 (1)、甲图中①代表的元素符号是 , 乙图中所示元素原子的核电荷数是 , 丙图所示粒子属于(填“原子”“阳离子”或“阴离子”).(2)、写出甲、乙两种元素的单质间发生反应的文字表达式:.
(1)、甲图中①代表的元素符号是 , 乙图中所示元素原子的核电荷数是 , 丙图所示粒子属于(填“原子”“阳离子”或“阴离子”).(2)、写出甲、乙两种元素的单质间发生反应的文字表达式:. -
19、下列五种微粒中,最易失去电子的是(填序号,下同),最易得到电子的是 , 已达到稳定结构的是 , 元素化学性质比较相似的是.
A
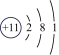 B
B C
C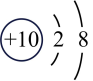 D
D E
E 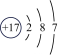
-
20、全球首个液态阳光项目由中国的李灿院士团队提出,该项目通过太阳能等可再生能源技术,将二氧化碳和水转化为甲醇(CH3OH)等产品,促进“双碳”目标的实现。转化和利用甲醇流程如图所示。
 (1)、甲醇中碳、氢元素的质量比为。(2)、应用该技术转化甲醇的化学方程式:
(1)、甲醇中碳、氢元素的质量比为。(2)、应用该技术转化甲醇的化学方程式:ⅰ.该流程中CO2回收利用对环境的意义。
ⅱ.若一辆轿车到某地要消耗汽油8升,一升汽油燃烧约产生2.2kg的二氧化碳,要将行驶过程中产生的二氧化碳全部转化为甲醇,理论上可得到甲醇的质量为kg?(根据方程式写出计算过程)。
(3)、在一定条件下,甲醇的产率变化如下图所示,为提高甲醇的产率,最佳反应条件为。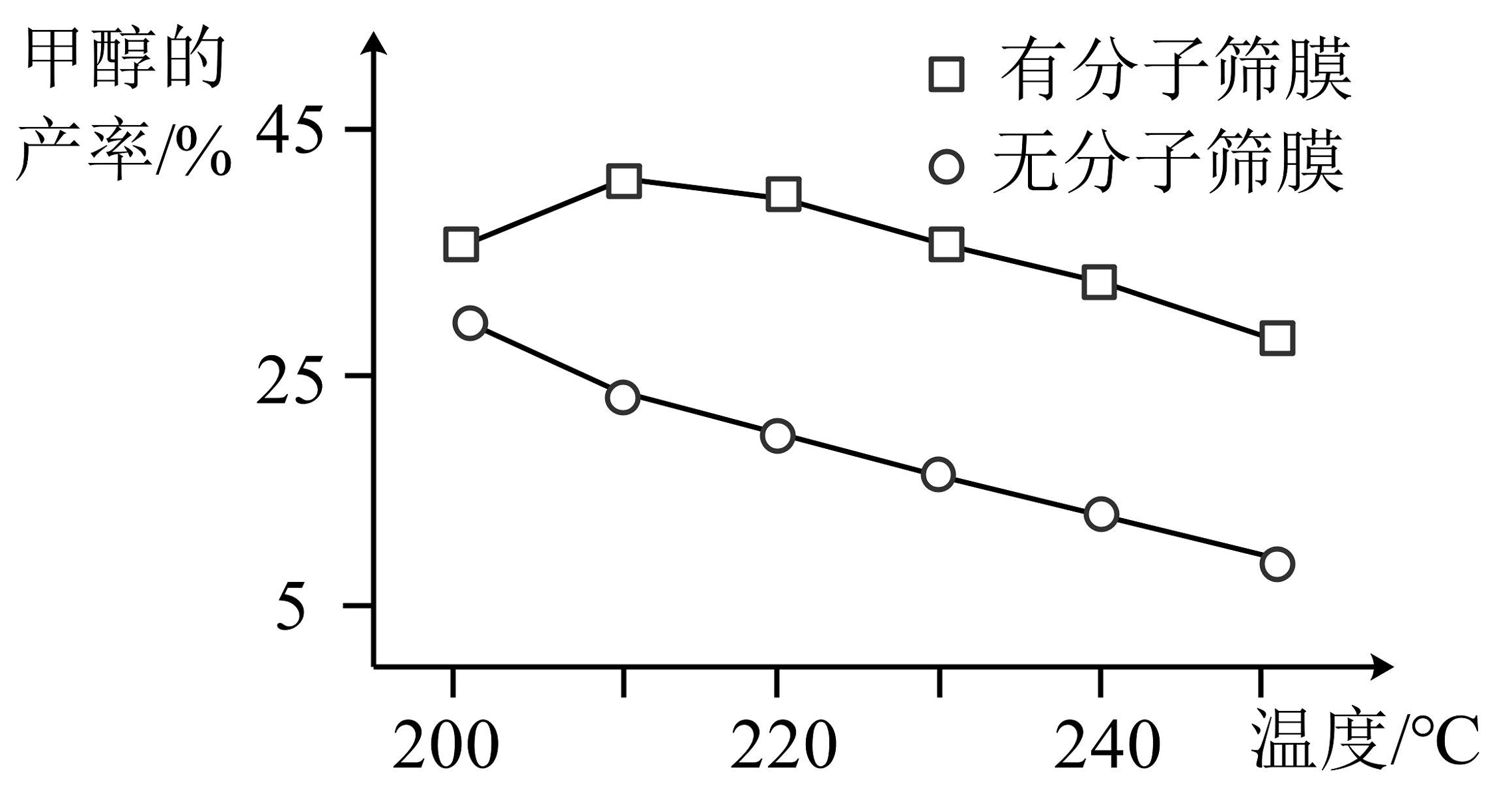 (4)、现有一定质量的甲醇不完全燃烧,生成CO、CO2和水蒸气的混合气体150kg,经测定混合气体中碳元素质量分数为16%,则参加反应的氧气质量为kg。
(4)、现有一定质量的甲醇不完全燃烧,生成CO、CO2和水蒸气的混合气体150kg,经测定混合气体中碳元素质量分数为16%,则参加反应的氧气质量为kg。