-
1、
已知草酸钙(CaC2O4)加热易分解。某实验小组对其分解产物进行探究。
【查阅资料】草酸钙加热分解产生金属氧化物和非金属氧化物。
【提出问题】非金属氧化物的成分是什么?
【提出猜想】猜想一:CO
猜想二:CO2
猜想三:CO和CO2
猜想四:H2O
【提出质疑】
(1)猜想四不成立,原因是。
【设计实验】
(2)实验装置如图:

实验现象
结论
B中观察到澄清石灰水变浑浊
非金属氧化物中有
D中观察到
非金属氧化物中有CO
【实验结论】
(3)猜想成立,则草酸钙分解的化学方程式为。
【交流反思】
(4)从环保的角度考虑,该实验装置的不足之处是。
-
2、实验室制取某些气体的装置如下:
 (1)、仪器b的名称为。(2)、实验时要根据(填仪器名称)调整仪器a的高度,并固定在铁架台上。(3)、写出实验室用A装置制氧气的化学方程式 , 该反应属于基本反应类型中的。(4)、若收集的氧气用来做铁丝燃烧实验,最好选择装置收集。(5)、实验室制取二氧化碳,应选用的液体药品是。(填名称)选用发生装置时,选用C装置相对B装置的优点是。(6)、用G装置收集二氧化碳时,证明是否集满的方法是将燃着的小木条放在导管口处。
(1)、仪器b的名称为。(2)、实验时要根据(填仪器名称)调整仪器a的高度,并固定在铁架台上。(3)、写出实验室用A装置制氧气的化学方程式 , 该反应属于基本反应类型中的。(4)、若收集的氧气用来做铁丝燃烧实验,最好选择装置收集。(5)、实验室制取二氧化碳,应选用的液体药品是。(填名称)选用发生装置时,选用C装置相对B装置的优点是。(6)、用G装置收集二氧化碳时,证明是否集满的方法是将燃着的小木条放在导管口处。 -
3、过氧化钙()能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等领域。可由鸡蛋壳(含)为原料,实验室可按以下流程制得:

查阅资料:在潮湿空气及水中会缓慢放出 , 温度较高时会分解生成和。
回答下列问题:
(1)、煅烧前要把鸡蛋壳碾碎,其目的是。(2)、反应①的化学方程式为 , 该反应属于(填基本反应类型)。(3)、反应②的生成物为和 , 该反应需在低温条件下进行,主要原因是。(4)、过滤料浆时,玻璃棒的作用是。(5)、结合以上信息,保存需注意的是。 -
4、已知A、B为两种黑色粉末状固体,E是能与血红蛋白结合的有毒气体,D为红色单质。A、B、C、D、E、F六种物质之间的转化关系如图所示,请回答:
 (1)、请描述固体D的一个物理性质(颜色除外)和对应的用途。(2)、写出化学式:A;E。(3)、B和E反应的化学方程式为。(4)、C→F的化学方程式为。
(1)、请描述固体D的一个物理性质(颜色除外)和对应的用途。(2)、写出化学式:A;E。(3)、B和E反应的化学方程式为。(4)、C→F的化学方程式为。 -
5、K2CO3和KNO3在不同温度时的溶解度如表所示。
温度/℃
20
30
50
60
80
溶解度/g
K2CO3
110
114
121
126
139
KNO3
31.6
45.8
85.5
110
169
回答下列问题:
(1)、根据表中数据,绘制溶解度曲线如图所示,下列说法正确的是______。 A、甲表示K2CO3的溶解度曲线 B、乙表示KNO3的溶解度曲线 C、M点对应的纵坐标在126g和139g之间 D、t1对应的温度在50℃和60℃之间(2)、40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图所示。下列说法中正确的是______(填标号)。
A、甲表示K2CO3的溶解度曲线 B、乙表示KNO3的溶解度曲线 C、M点对应的纵坐标在126g和139g之间 D、t1对应的温度在50℃和60℃之间(2)、40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图所示。下列说法中正确的是______(填标号)。 A、烧杯①中溶解的是K2CO3 , 烧杯②中溶解的是KNO3 B、升高温度或增加溶剂都有可能将烧杯①中固体全部溶解 C、烧杯②中溶液一定是不饱和溶液 D、若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定变小(3)、80℃时,有KNO3饱和溶液(含少量K2CO3),若要得到较纯净的KNO3晶体,宜采用实验操作方法是。(4)、将60℃时的210g饱和KNO3溶液降温至20℃,析出的晶体质量为。
A、烧杯①中溶解的是K2CO3 , 烧杯②中溶解的是KNO3 B、升高温度或增加溶剂都有可能将烧杯①中固体全部溶解 C、烧杯②中溶液一定是不饱和溶液 D、若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定变小(3)、80℃时,有KNO3饱和溶液(含少量K2CO3),若要得到较纯净的KNO3晶体,宜采用实验操作方法是。(4)、将60℃时的210g饱和KNO3溶液降温至20℃,析出的晶体质量为。 -
6、在宏观、微观和符号之间建立联系是化学学科的重要思维方式。

回答下列问题:
(1)、图1中,共有种元素,①表示的微粒符号是。(2)、图2中,X元素原子的核电荷数为12,它的元素符号是。(3)、图2中,不能直接获取有关Na的信息是______(填选项)。A、元素名称 B、元素的相对原子质量 C、原子序数 D、原子核内的中子数(4)、图1中⑤是镓元素(Ga)的原子结构示意图,它与图2中铝元素化学性质相似的原因是。(5)、蚀刻芯片的微观示意图如下,其中甲、丙、丁均为气体,该反应的化学方程式是。
-
7、下列图像与实验设计对应正确的有
图像




实验设计
将一定质量的木炭放在密闭容器中燃烧
向CuSO4溶液中滴加H2O2溶液
分别向等质量的Mg和MgO中加入足量的稀盐酸
足量红磷在密闭的集气瓶中燃烧
A、1项 B、2项 C、3项 D、4项 -
8、下列实验方法能达到实验目的的是
选项
实验目的
实验方法
A
鉴别水和过氧化氢溶液
分别加入少量二氧化锰粉末,观察现象
B
鉴别氮气和二氧化碳气体
将燃着的木条分别伸入其中,观察现象
C
除去粉末中的少量木炭粉
加足量水溶解、过滤、蒸发
D
除去溶液中的少量
加足量锌粉、充分反应后过滤
A、A B、B C、C D、D -
9、向和溶液中加入一定量粉和粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是A、向滤渣中加入稀盐酸,可能有气泡产生 B、滤液中一定有和 C、滤渣中一定有 , 可能有和 D、滤液中一定无 , 可能有
-
10、分析推理是化学学习过程中的常用方法,下列推理正确的是A、合金中一定含有金属元素,氧化铝中也含有金属元素,则氧化铝是一种合金 B、分子、原子可以构成物质,所以物质一定是由分子、原子构成的 C、化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物 D、离子是带电的一种微粒,所以带电的微粒一定是离子
-
11、天然气的主要成分是甲烷(CH4),甲烷参与某反应的微观示意图如图,下列说法错误的是
 A、微粒“R”的化学式为CO2 B、反应前后,原子和分子数目均保持不变 C、参加反应的
A、微粒“R”的化学式为CO2 B、反应前后,原子和分子数目均保持不变 C、参加反应的 与
与 的质量之比为1:2
D、天然气是不可再生的化石燃料
的质量之比为1:2
D、天然气是不可再生的化石燃料
-
12、如图1是电解水的装置,量筒甲中收集到A气体、量筒乙中收集到B气体。如图2是生成气体体积与反应时间的关系图。下列说法错误的是
 A、A气体能使带火星的木条复燃,B气体能燃烧 B、a处连接的是电源的负极,b处连接的是电源的正极 C、电解前,在水中加入少量氢氧化钠,以增强导电性 D、正极产生的气体与负极产生的气体体积比为1:2,质量比为8:1
A、A气体能使带火星的木条复燃,B气体能燃烧 B、a处连接的是电源的负极,b处连接的是电源的正极 C、电解前,在水中加入少量氢氧化钠,以增强导电性 D、正极产生的气体与负极产生的气体体积比为1:2,质量比为8:1 -
13、“酒越陈越香醇”是指酒在存放过程中可生成有香味的乙酸乙酯().下列有关乙酸乙酯的说法正确的是A、乙酸乙酯的相对分子质量为 B、乙酸乙酯中含有氧分子 C、乙酸乙酯中C、H元素质量比为6:1 D、乙酸乙酯中O元素的质量分数最大
-
14、化学与社会、生活密切相关,对下列现象或事实的解释错误的是
选项
现象或事实
解释
A
冬季用煤取暖,注意排气通风
血红蛋白与一氧化碳结合,会导致中毒
B
打开汽水瓶盖时,汽水会自动喷出来
气体的溶解度随压强的减小而减小
C
液氮遇热汽化
分子间隔变大
D
石墨用于制作电极
石墨质软
A、A B、B C、C D、D -
15、下列图示的实验操作正确的是下列实验操作中,正确的是




A.液体加热
B.称量10.05g固体
C.过滤
D.量取9.5mL液体
A、A B、B C、C D、D -
16、依靠科技进步,促进环境保护。下列环境保护的措施切实可行的是A、推动木材替代燃煤,防止温室效应增强 B、提倡深埋废旧电池,减少土壤污染 C、使用新型可降解塑料,减少白色污染 D、加高烟囱,排放废气,减少酸雨产生
-
17、酸、碱、盐是中学化学学习的重要内容,它们在生产、生活中具有广泛的用途。
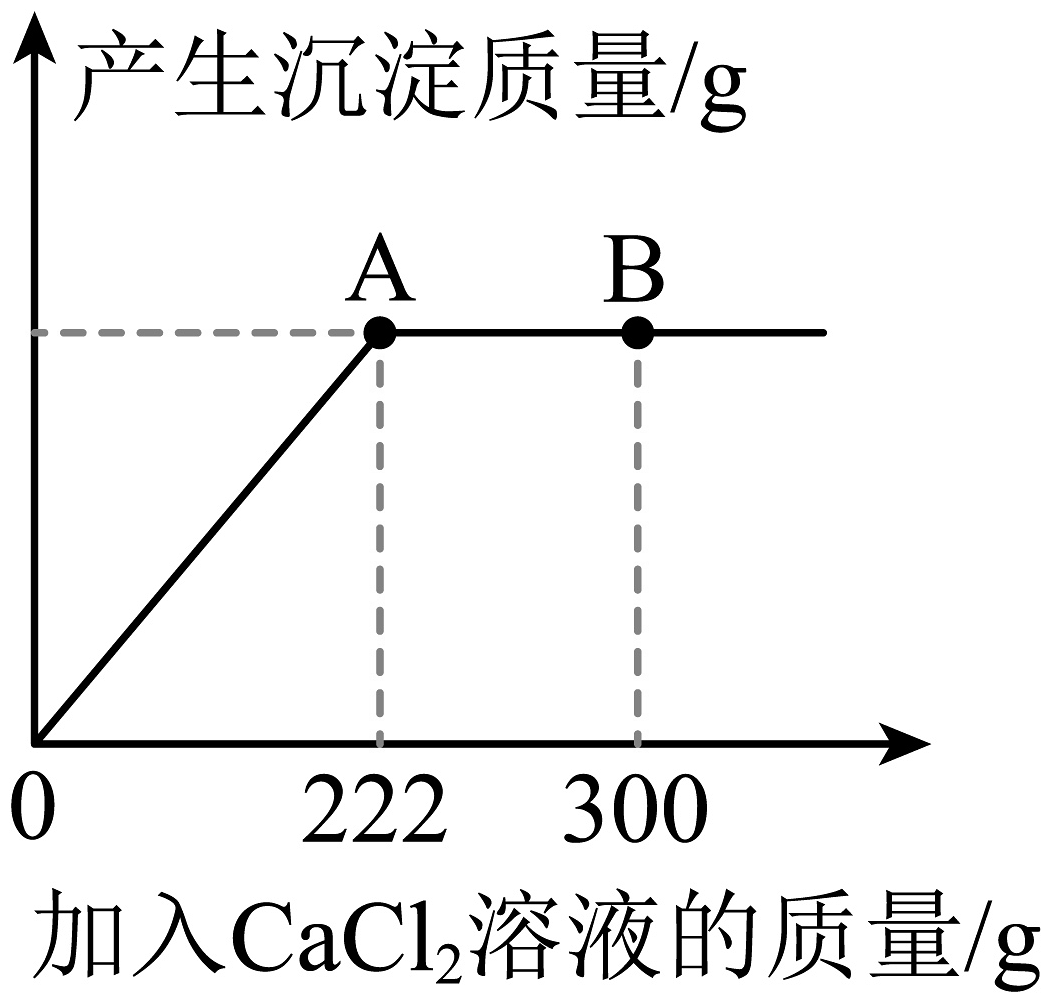 (1)、盐酸常用来除铁锈,写出该反应的化学方程式。(2)、厨房中烘焙糕点常使用发酵粉,发酵粉的主要成分之一是小苏打,其化学式是。(3)、现有100gNaCl和的混合溶液,逐滴加入溶质质量分数为10%的溶液,反应过程中产生沉淀的质量与所滴入溶液的质量关系如下图所示。试回答:
(1)、盐酸常用来除铁锈,写出该反应的化学方程式。(2)、厨房中烘焙糕点常使用发酵粉,发酵粉的主要成分之一是小苏打,其化学式是。(3)、现有100gNaCl和的混合溶液,逐滴加入溶质质量分数为10%的溶液,反应过程中产生沉淀的质量与所滴入溶液的质量关系如下图所示。试回答:①当滴入溶液300g时(即图中B点),烧杯中溶液里存在的溶质是(填化学式)。
②当滴入溶液222g时(即图中A点),恰好完全反应,试计算此时所得溶液的质量。
-
18、
实验室现有一瓶用石灰石和稀盐酸制取二氧化碳后的剩余废液,某小组同学想探究该废液中是否有残留的稀盐酸存在。
(1)甲同学向剩余废液中加入碳酸钠粉末,若观察到________的现象,则证明该废液中一定存在稀盐酸。
(2)乙同学从下列四种试剂中选取了一种试剂,也成功验证了废液中是否有残留的稀盐酸。则他所选的试剂不可能是________(填选项序号之一)。
A. 紫色石蕊试液 B. 硝酸银溶液 C. 氧化铜 D. 镁条 现欲探究一固体混合物A的成分,已知其中可能含有五种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:

(3)气体B的化学式为________,常温下气体B的水溶液的pH________7(填“大于”、“小于”、“等于”)。
(4)写出实验过程①中发生反应的一个化学方程式________。
(5)写出滤液C中一定含有的阳离子________(写离子符号),滤液E中肯定大量存在的酸根离子为________(写离子符号)。
(6)写出实验过程②中生成沉淀F的化学方程式________。根据实验现象,推断混合物A中一定不存在的物质是________(填化学式),理由是________。混合物A中还不能确定存在的物质是________(填化学式),若要通过实验判断该物质是否存在,可取适量滤液C进行探究。写出实验操作的步骤、现象及结论________。
-
19、
学习了《常见的酸和碱》后,同学们对碱的化学性质整理归纳并进行如下实验活动。请回答下列问题:

(1)实验一中两实验均产生的现象为;两溶液具有相似化学性质的原因是。
(2)实验二中能证明溶液与稀盐酸发生反应的现象是溶液由色变为无色,该反应的化学方程式为。
(3)如图Ⅰ是实验二反应的微观示意图,反应前后没有发生变化的微粒是(填符号)。结合图Ⅰ的微观图示,判断图Ⅱ中②代表的是(填符号)。

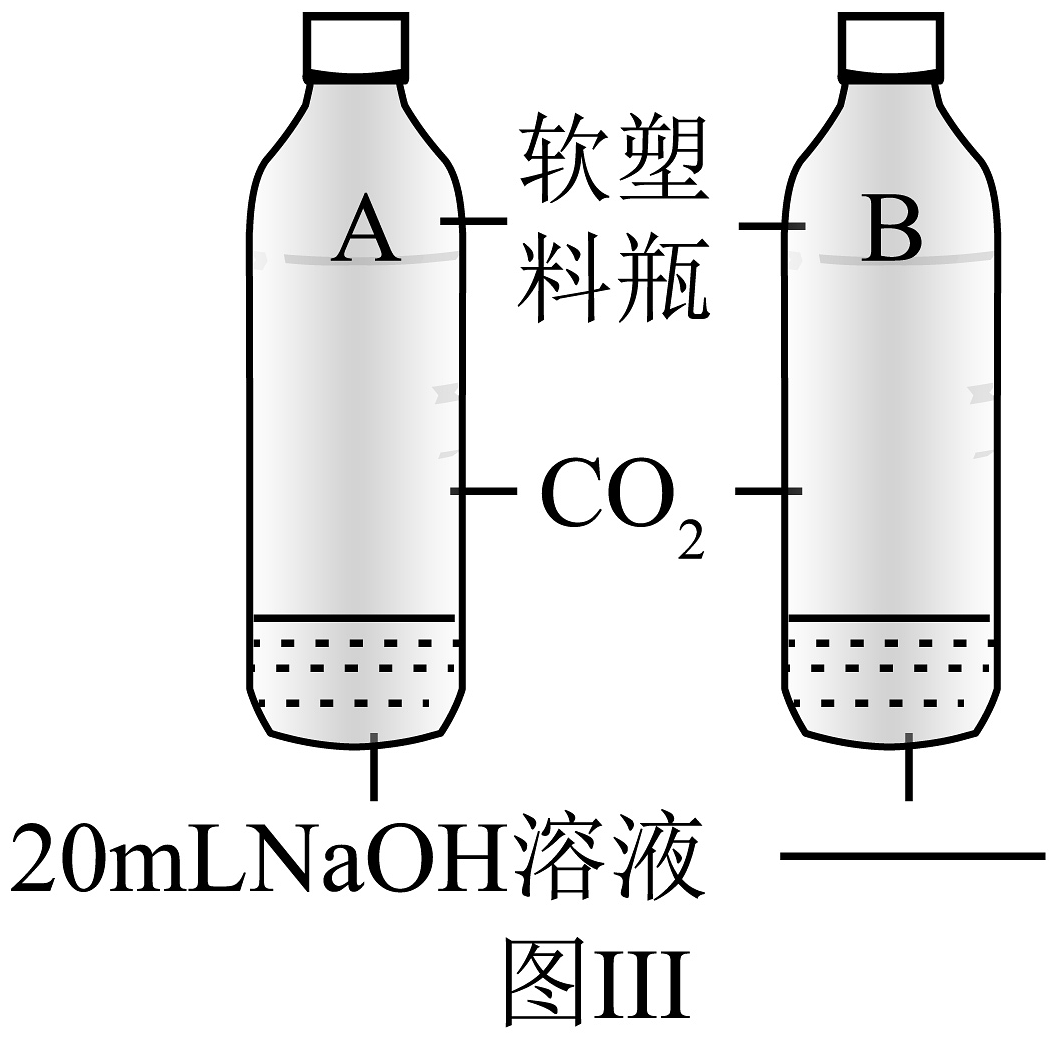
(4)实验三为证明与NaOH溶液发生了化学反应,你认为加入的试剂X为 , 预计产生的现象为 , 写出与NaOH溶液反应的化学方程式。
(5)拓展提升:没有明显现象的化学反应,可利用间接观察法证明反应发生。于是同学们对实验三又进行了拓展,做了如图Ⅲ的对比实验,图中横线上应该填写的内容为 , 该实验的设计思路为(填序号)。
①验证有新物质生成 ②验证反应物减少(或消失)
-
20、海洋是人类的母亲,是人类千万年来取之不尽、用之不竭的巨大资源宝库。(1)、沿海的盐厂都是“盐田法”晒盐,其基本原理是结晶,得到的是粗盐。在实验室用过滤法提纯粗盐的过程中有三次用到了玻璃棒,其作用分别是:①引流②搅拌,加速固体物质溶解③搅拌,使液体受热均匀,其先后顺序是(填数字序号)。(2)、近年来我国在南海成功试采可燃冰,推动了世界能源利用格局的改变。写出可燃冰被科学家誉为“21世纪能源”的原因(写一条即可)。(3)、从海水中获得淡水的过程称为“海水淡化”。现在所用的海水淡化方法主要是蒸馏法(热法)和膜法两大类。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中有些溶质离子不能通过淡化膜,从而得到淡水。
①膜法淡化海水的原理是利用不同分离出淡水。
②将少量加压后的右侧海水置于表面皿中,用酒精灯加热,水分蒸干后,可在表面皿上观察到的现象是。下列对加压后右侧海水成分变化情况的分析中,正确的是(填选项序号之一)。

A.溶质质量增加 B.溶剂质量减少 C.溶液质量不变 D.溶质质量分数减小
(4)、镁是国防元素。从海水中提取单质镁的工艺流程如下图所示:在上述转化过程中,所发生的化学反应属于复分解反应的是(填过程序号),过程①中加入石灰乳时会采用喷淋的方式,目的是。海水或卤水中本来就含有氯化镁,还需要过程①②的原因是。金属镁是一种性质非常活泼的金属,在加热的条件下可与水反应生成一种难溶性碱和一种可燃性气体。请写出该反应的化学方程式 , 该反应属于(填“化合”“复分解”“置换”之一)反应。