-
1、
人类社会的发展离不开优质能源的开发和先进能源技术的使用,在新能源的开发和利用中,化学起着不可替代的作用。阅读下面材料,回答相关问题。
材料一:氢能的生产
目前,常见的氢气制备方法除了电解水制氢法以外,还有如下方法:
1.光催化制氢:在二氧化钛()催化下利用光能分解水得到氢气和氧气。
2.生物质发酵制氢:利用厌氧菌发酵水解淀粉和纤维素得到葡萄糖,在酶的作用下进一步转化为氢气。
3.利用天然气制氢:首先在转化炉中,将甲烷和水蒸气在高温和催化剂条件下转化为一氧化碳和氢气。余热回收后,在变换塔中,一定条件下,使一氧化碳和水反应,生成氢气和二氧化碳。
(1)写出光催化制氢的化学方程式:。该反应属于(填“化合”或“分解”)反应。
(2)生物质发酵法原理如下: , 的化学式是。
(3)天然气制氢工艺中,转化炉中甲烷和水蒸气反应的微观示意图如下图所示:
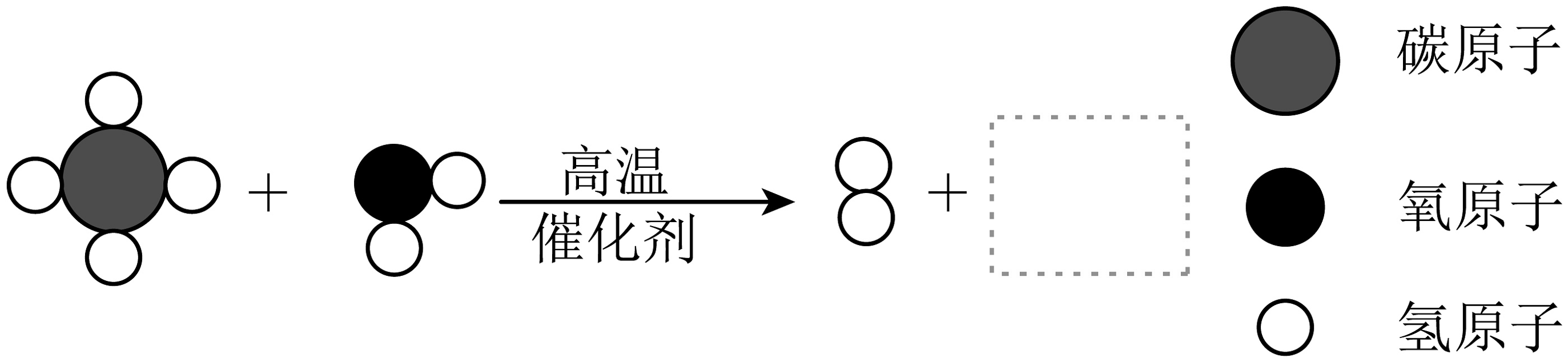
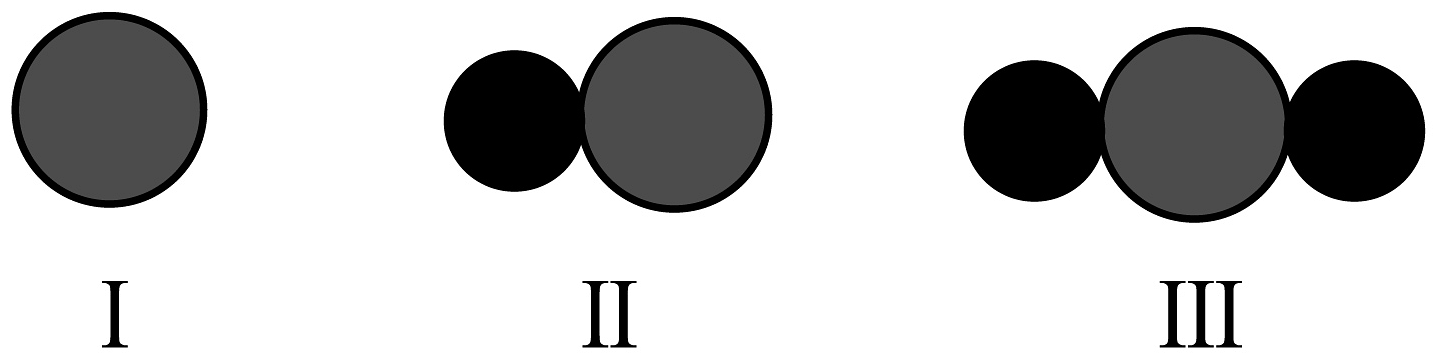
图中虚线方框内物质的微观模型图是(填数字序号)。
(4)天然气制氢工艺中,变换塔中发生反应的化学方程式:。
(5)天然气制氢工艺中,分离氢气和二氧化碳混合气体,可采用加压、降温的方法,得到气态的氢气和液态的二氧化碳。此分离原理是利用与的不同。
材料二:新能源电池的使用
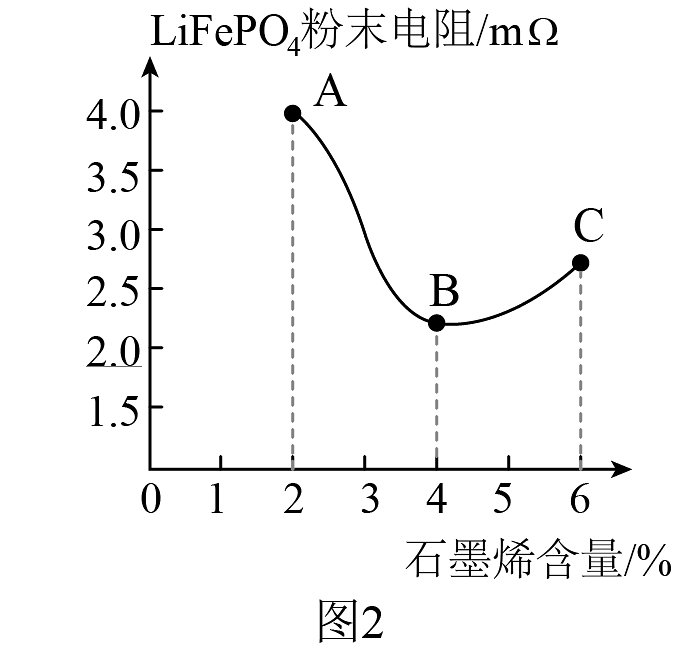
几类电池的部分性能指标如图1所示。其中含磷酸铁()、磷酸亚铁锂()的锂电池具有轻便、能量密度高的突出优点。生产该电池时,在电池材料中添加适量的石墨烯作导电剂,可以有效提高电池的性能,但过多的石墨烯会阻碍电池中锂离子的迁移,导致电池内阻增加,性能下降,研究结果如图2所示。

(6)磷酸亚铁锂()中,锂元素显价,则磷元素的化合价为。
(7)依据图1,锂电池优于镍氢电池的性能是。
(8)根据材料信息,图2中段曲线,随着石墨烯含量的增加,电池电阻增加的原因是。
-
2、请回答下列问题。(1)、化学用语是学习化学的重要工具。请用正确的化学用语填空:
①5个钙原子;
②2个氧分子;
③3个镁离子;
④保持氮气化学性质的最小粒子;
⑤氯化铜;
(2)、化生万物,创造美好。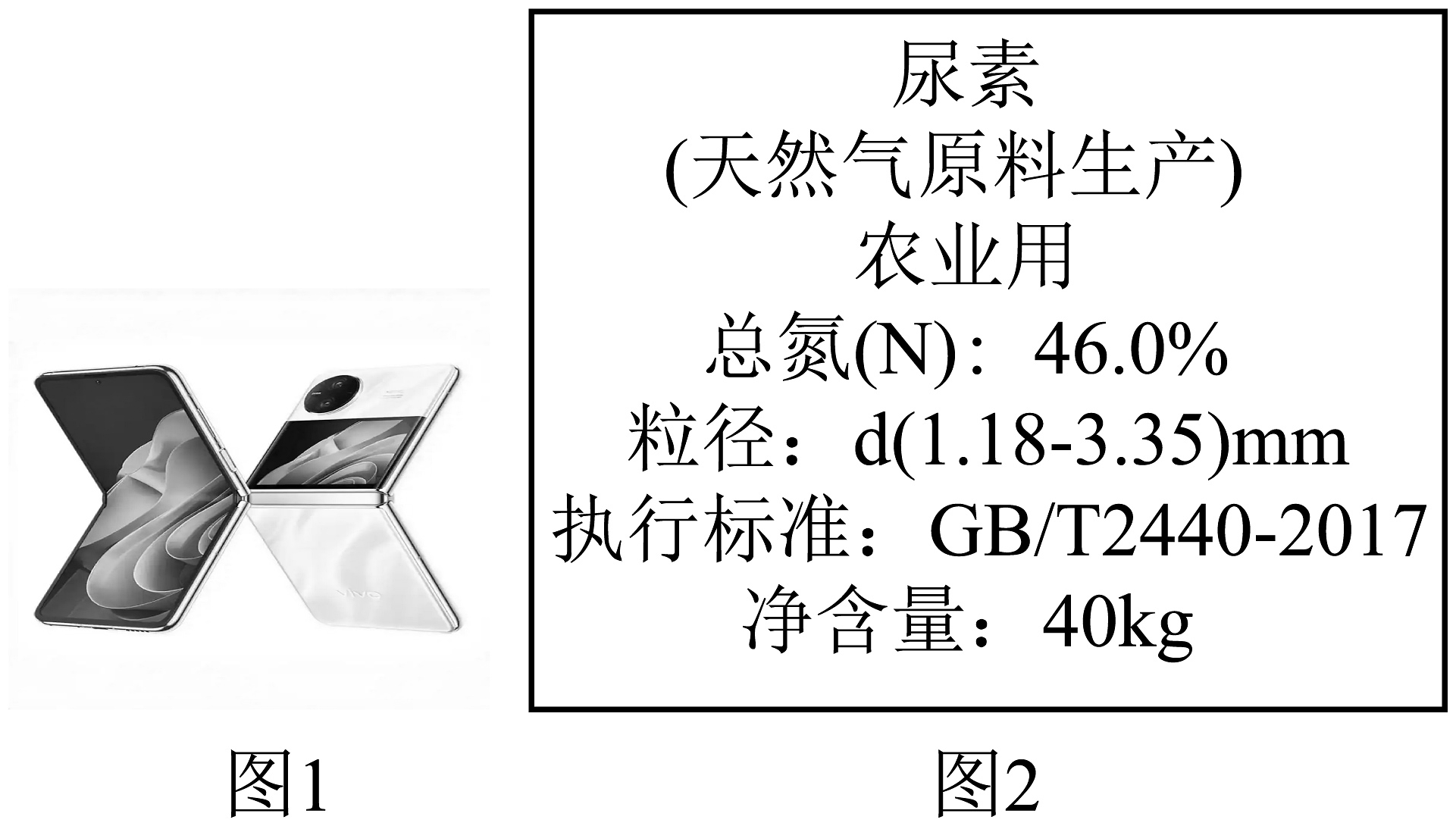
①引领通信变革:近年来一些手机厂商陆续开发可折叠手机。化学物质吡唑啉是生产折叠手机用到的柔性屏幕的重要物质,其化学式为。吡唑啉属于(填“混合物”“化合物”“氧化物”之一);吡唑啉分子中碳原子与氢原子的个数比是(填最简整数比)。
②保障农业生产:尿素化肥是使用量较大的一种化学氮肥。尿素的化学式 , 尿素中氮元素的质量分数是(计算结果精确到)。如图2所示,某尿素化肥的包装袋土标着含氮量大于等于 , 国家质量标准规定,市场上出售的尿素产品中,尿素含量在以上为一级品,经计算这批尿素产品(填“是”或“不是”)一级品。
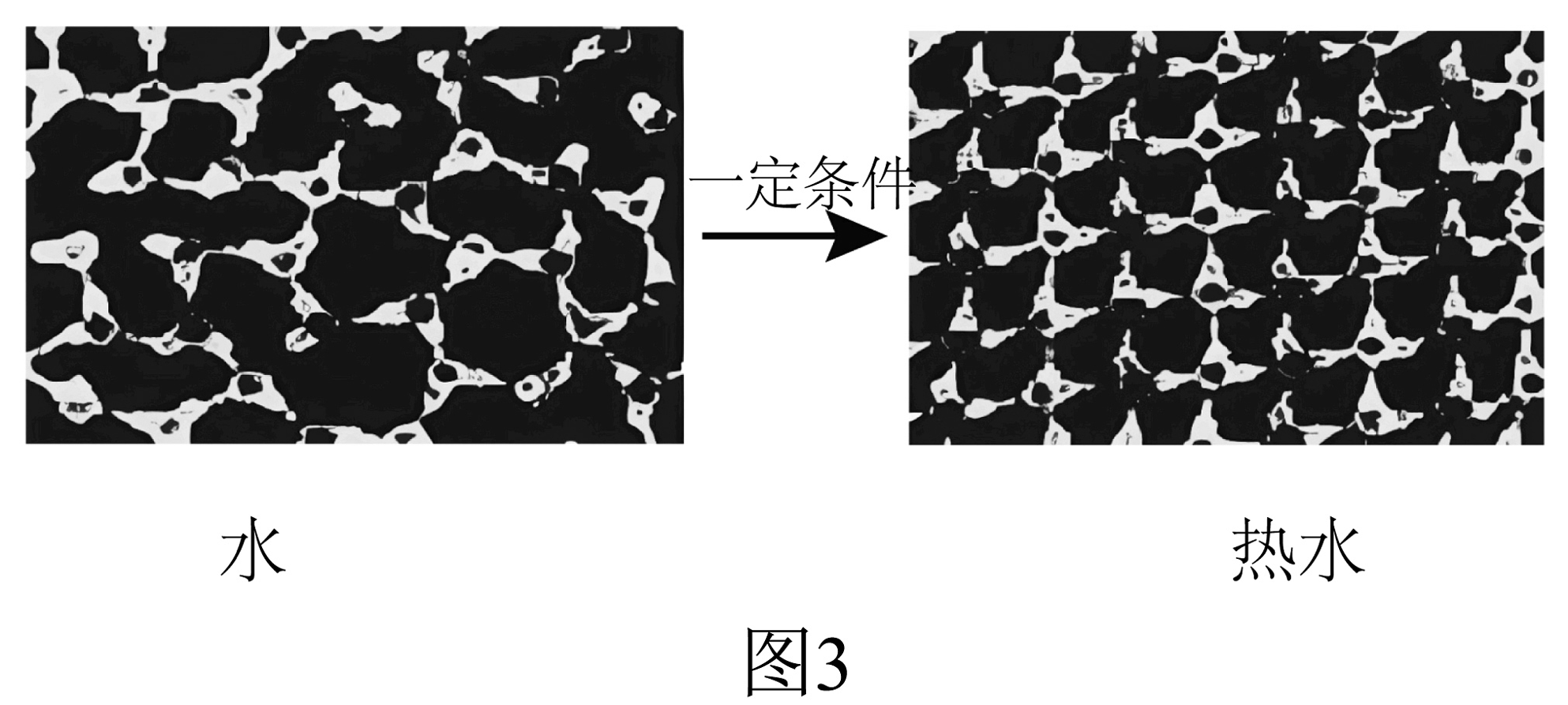
③发现新型结构:科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水就可以结成冰,俗称“热冰”,图3为其计算机模拟图。下列说法正确的是(填字母序号)。
A.水结成“热冰”的过程中分子个数发生变化
B.上述变化过程中分子间间隔没有发生变化
C.在弱电场下,水分子从运动转变为不再运动
D.利用该性质,人们可在常温常压下可建成溜冰场
-
3、密闭容器中盛有和的混合气体,点燃使其充分反应,全部转化为、和 , 待容器恢复至室温。测得容器内混合气体质量为 , 其中碳元素的质量分数为。下列有关说法中,正确的是A、反应前的质量为 B、反应前和的质量比为 C、生成的质量为 D、生成和的微粒个数比为
-
4、利用和在催化剂的作用下反应可得到合成气(和),是实现“双碳”经济的有效途径之一。催化剂表面同时发生积碳反应和消碳反应,原理如图1所示。当催化剂表面的积碳量变大,会影响催化剂与反应物接触而使反应减慢。其他条件相同时,积碳量与温度的关系如图2所示。下列说法中,正确的是
 A、反应前后催化剂的质量和化学性质不变 B、积碳反应的方程式为 C、积碳量增加的原因是积碳反应产生的碳量高于消碳反应消耗的碳量 D、在催化剂作用下,和得到合成气的反应适宜在时进行
A、反应前后催化剂的质量和化学性质不变 B、积碳反应的方程式为 C、积碳量增加的原因是积碳反应产生的碳量高于消碳反应消耗的碳量 D、在催化剂作用下,和得到合成气的反应适宜在时进行 -
5、化学实验课上,某小组同学探究在不加催化剂的情况下氯酸钾受热是否会产生氧气。向试管中加入少量氯酸钾后,将高温传感器探头插入试剂内,把氧气传感器插放在试管口,如图1所示。测定试管中氧气含量随温度变化情况如图2所示(已知:氯酸钾的熔点为)。下列说法中,不正确的是
 A、试管口向上倾斜的原因是防止受热熔化的氯酸钾流出试管 B、氯酸钾加热产生氧气的化学方程式为 C、氯酸钾分解前氧气含量在一段时间内略有下降,原因可能是空气受热膨胀,变得稀薄 D、该实验证明不加催化剂,氯酸钾受热会分解产生氧气
A、试管口向上倾斜的原因是防止受热熔化的氯酸钾流出试管 B、氯酸钾加热产生氧气的化学方程式为 C、氯酸钾分解前氧气含量在一段时间内略有下降,原因可能是空气受热膨胀,变得稀薄 D、该实验证明不加催化剂,氯酸钾受热会分解产生氧气 -
6、下列实验方案中,能达到实验目的的是
选项
实验目的
实验方案
A
除去中的
通过灼热的碳粉
B
除去水中的异味和颜色
加入活性炭
C
鉴别氮气与氧气
将两种气体分别通入澄清石灰水中
D
鉴别矿泉水和蒸馏水
滴在玻璃片上蒸干,观察是否有固体残留
A、A B、B C、C D、D -
7、实验探究是解决化学问题最重要的手段。下列探究实验的设计中,不能达到实验目的的是A、
 探究燃烧的条件
B、
探究燃烧的条件
B、 探究水的元素组成
C、
探究水的元素组成
C、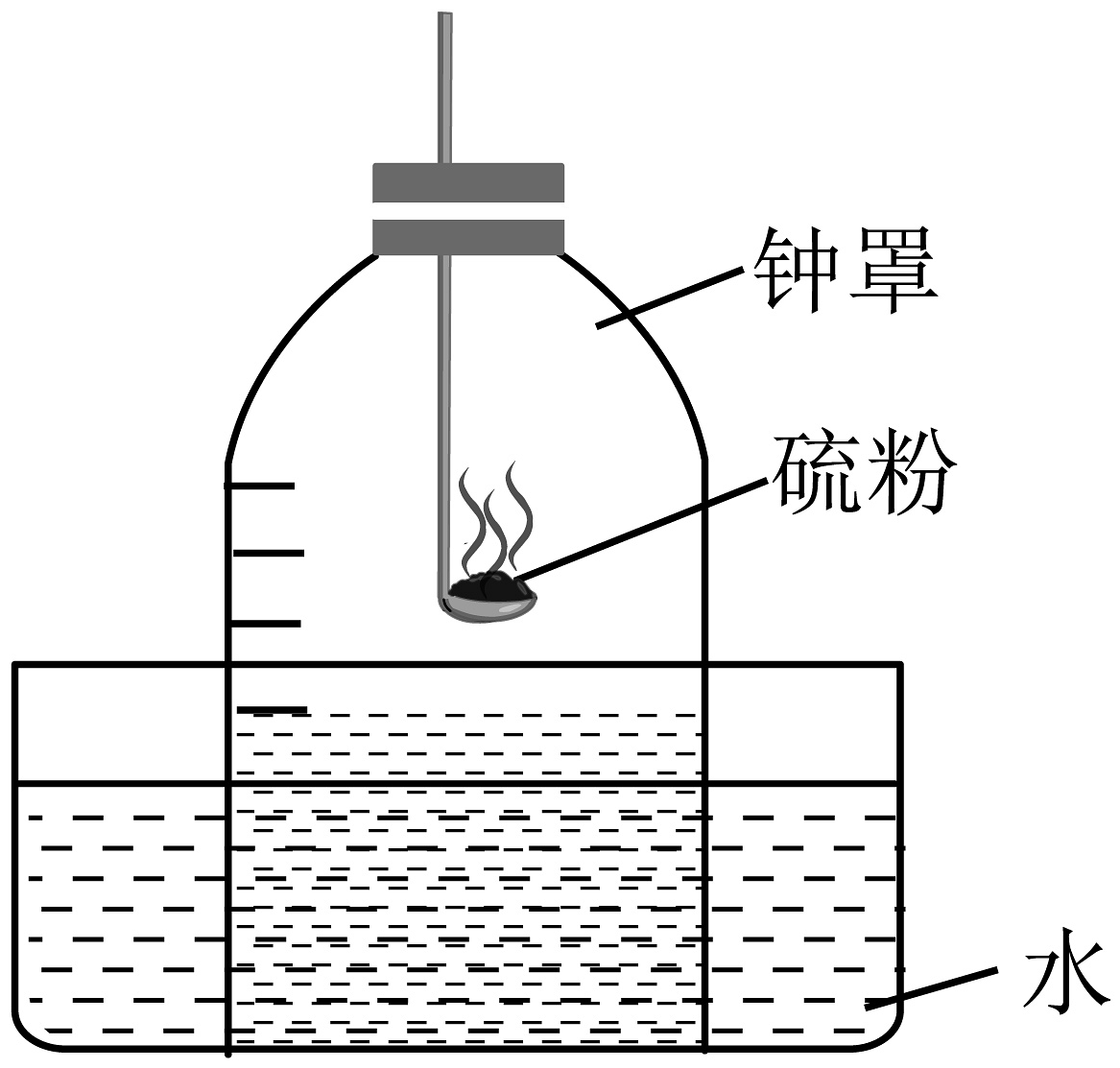 测定氧气含量
D、
测定氧气含量
D、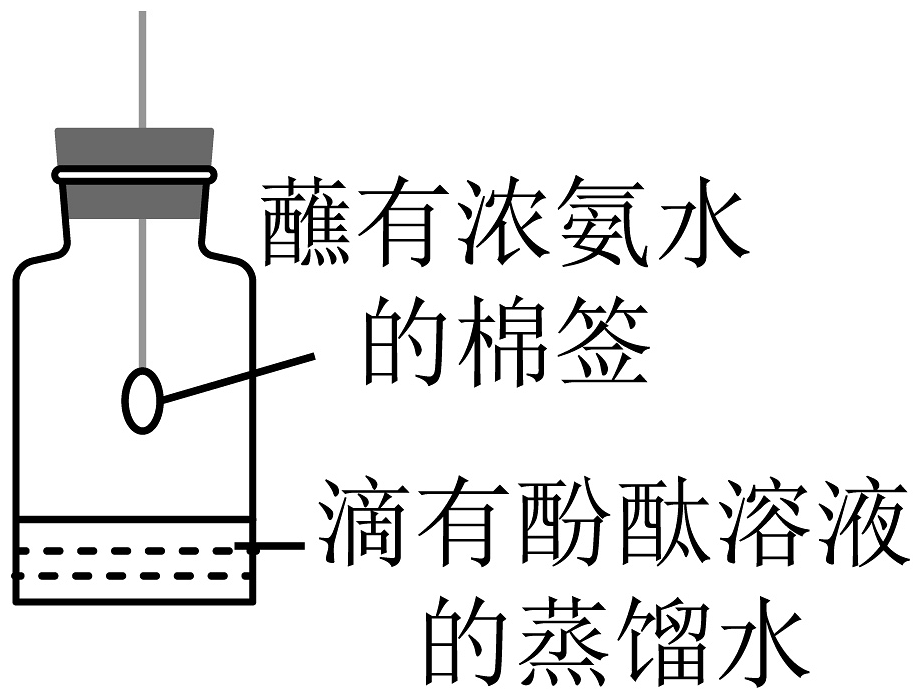 探究分子的运动
探究分子的运动
-
8、某同学使用激光手电引燃红磷(如下图所示)。下列图像中能够体现该实验过程中锥形瓶内物质质量与时间关系的是
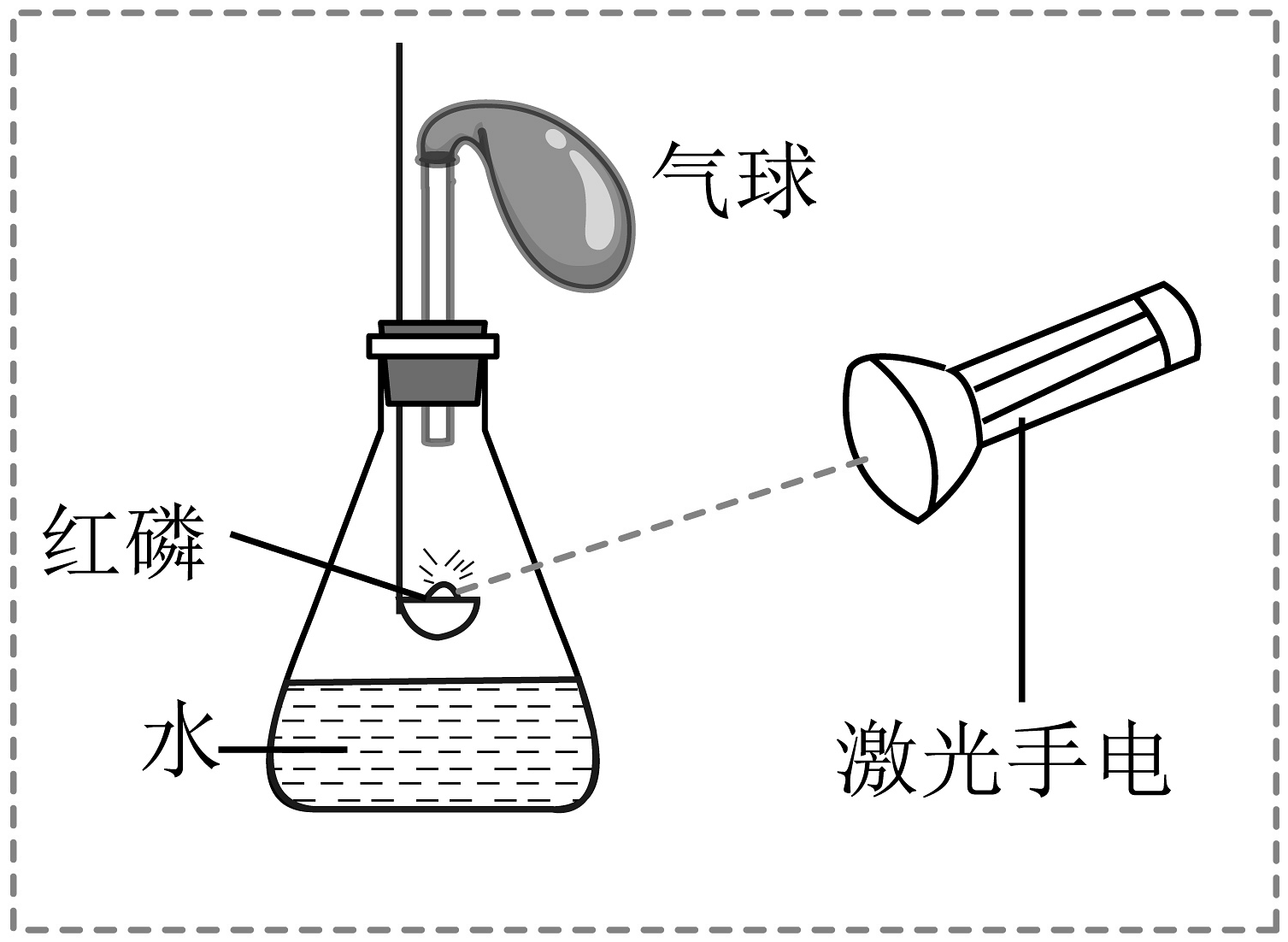 A、
A、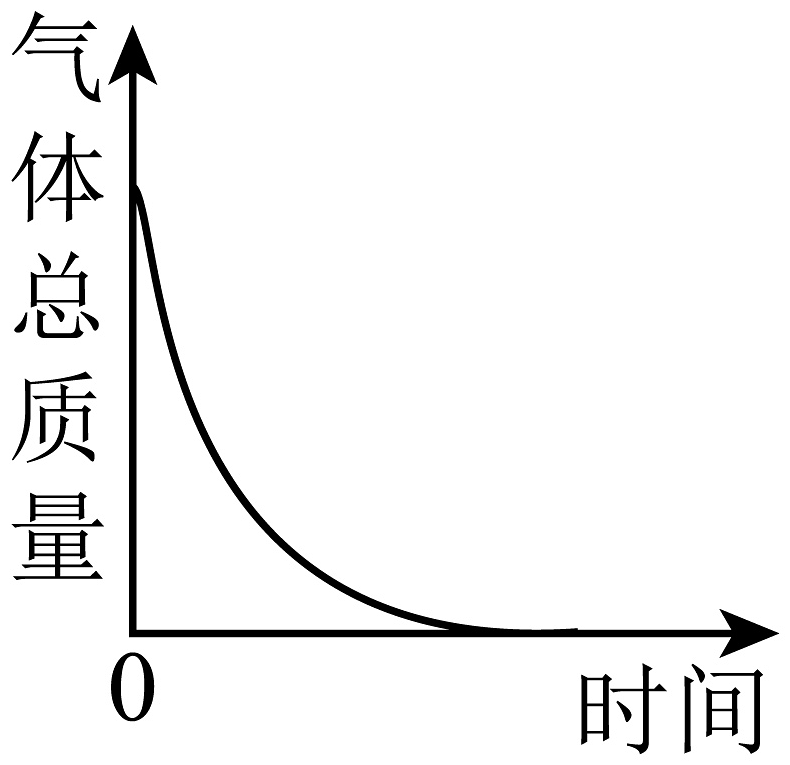 B、
B、 C、
C、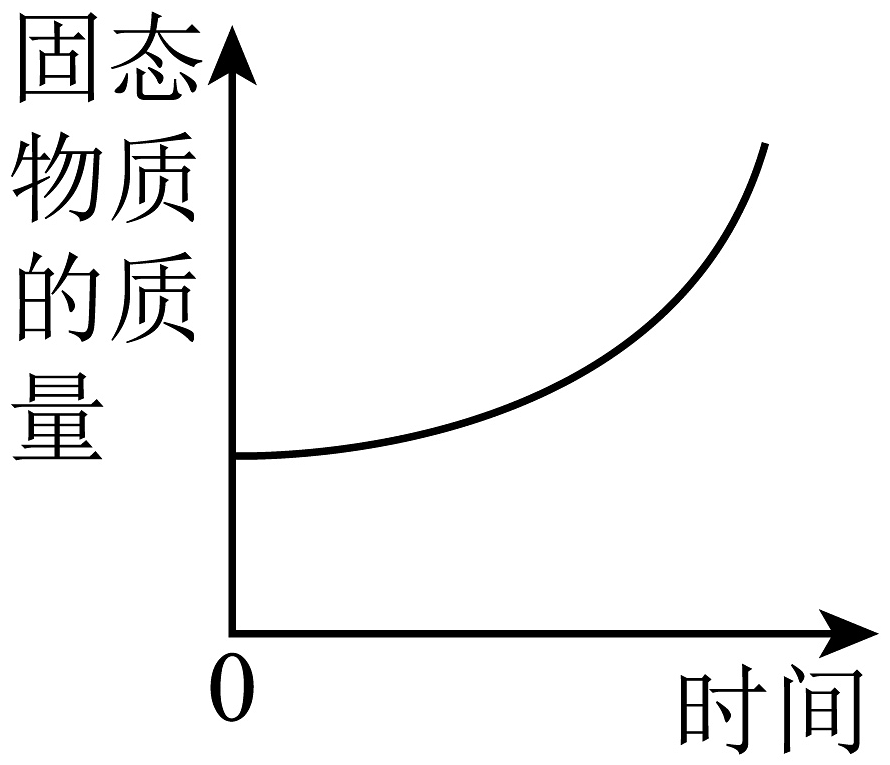 D、
D、
-
9、如图是水、氯化钠晶体以及氯化钠溶于水的微观示意图。下列有关说法中,不正确的是
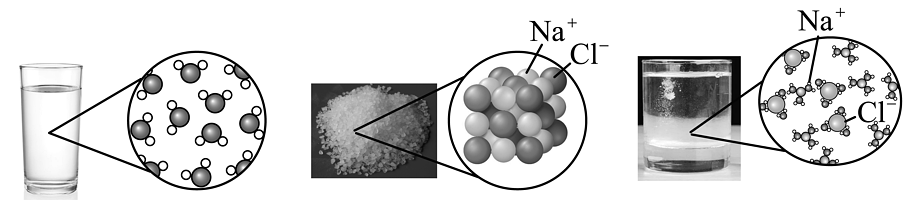 A、水是由水分子构成的,氯化钠是由氯化钠分子构成的 B、氯化钠溶液中含有钠离子、氯离子、水分子 C、氯化钠易溶于水不溶于植物油,是因为水分子与油分子对和的作用不同 D、钠离子、氯离子向水中扩散过程中吸收的热量,与钠离子、氯离子和水分子形成水合离子过程中放出的热量基本相等
A、水是由水分子构成的,氯化钠是由氯化钠分子构成的 B、氯化钠溶液中含有钠离子、氯离子、水分子 C、氯化钠易溶于水不溶于植物油,是因为水分子与油分子对和的作用不同 D、钠离子、氯离子向水中扩散过程中吸收的热量,与钠离子、氯离子和水分子形成水合离子过程中放出的热量基本相等 -
10、如图为粉尘爆炸实验:将蜡烛点燃放入塑料筒内,盖上硬纸板,吹入空气,面粉吹起的瞬间发生爆炸,硬纸板被冲开,蜡烛熄灭。下列有关说法中,不正确的是
 A、蜡烛的作用是使面粉的温度达到着火点 B、吹入空气的作用是使面粉与氧气充分接触 C、面粉爆炸和轮胎爆炸的原理完全相同 D、面粉厂的生产车间应张贴禁止烟火标志
A、蜡烛的作用是使面粉的温度达到着火点 B、吹入空气的作用是使面粉与氧气充分接触 C、面粉爆炸和轮胎爆炸的原理完全相同 D、面粉厂的生产车间应张贴禁止烟火标志 -
11、门捷列夫发现元素周期律并编制了元素周期表。如图是几种元素在元素周期表中的信息。下列有关说法中,合理的是
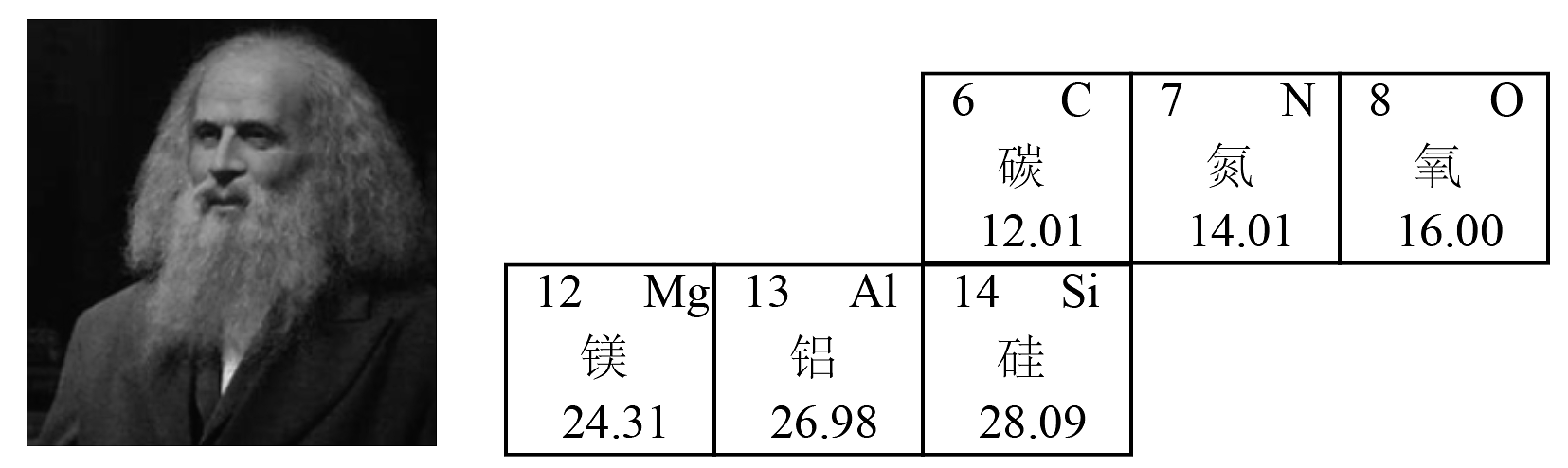 A、氧原子的质子数是16 B、碳、氮、氧元素属于同一周期 C、镁、铝、硅元素均属于金属元素 D、氧元素和铝元素形成化合物的化学式为
A、氧原子的质子数是16 B、碳、氮、氧元素属于同一周期 C、镁、铝、硅元素均属于金属元素 D、氧元素和铝元素形成化合物的化学式为 -
12、构建化学基本观念是学好化学的基础。下列对化学基本观念的认识中,不正确的是A、变化观:在一定条件下,和可以相互转化 B、微粒观:所有原子的原子核都是由质子和中子构成的 C、结构观:金刚石和石墨性质不同,因为它们的化学结构不同 D、分类观:根据组成物质的元素种类多少,可将纯净物分为单质和化合物
-
13、模型建构是化学科学研究的重要方法。如图是某同学绘制的原子结构示意图和原子结构模型。下列说法中,正确的是
 A、①对应的原子结构模型是③ B、②在化学反应中易失去电子,形成阳离子 C、①和②的化学性质相似 D、③④属于同种元素
A、①对应的原子结构模型是③ B、②在化学反应中易失去电子,形成阳离子 C、①和②的化学性质相似 D、③④属于同种元素 -
14、对物质进行分类是化学学习的重要方法。下列图示中,可以表示氧化物的是A、
 B、
B、 C、
C、 D、
D、
-
15、规范的实验操作是进行科学实验的基础和保证。下列实验操作中,“先”与“后”的顺序不合理的是A、在进行制备气体的实验时,先装入药品,后检查装置的气密性 B、用托盘天平称取一定质量药品时,先加入合适的砝码,移动游码,后加药品至平衡 C、用量筒量取液体时,先倒入接近的液体,后用胶头滴管滴加至刻度线 D、用加热的方法制备氧气,并用排水法收集氧气的实验结束时,先把导管移出水面,后停止加热
-
16、在“宏观”与“微观”之间建立联系是化学学科重要的思维方式。下列对宏观现象的解释中,合理的是A、过氧化氢分解可以产生氧气,是因为过氧化氢中有氧分子 B、氢气和液氢都可以做燃料,是因为同种分子化学性质相同 C、的氧气加压后能装在的钢瓶中,是因为压强越大分子体积越小 D、卢瑟福进行粒子(带正电荷)轰击金箔实验时,少数粒子发生偏移,说明原子核外电子质量较大且带负电
-
17、中华民族的科技文化源远流长,体现了我国劳动人民的勤劳和智慧。下列古代技术发明中,主要涉及化学变化的是A、
 榫卯古建
B、
榫卯古建
B、 活字印刷
C、
活字印刷
C、 陶瓷烧制
D、
陶瓷烧制
D、 司南指路
司南指路
-
18、
某化学兴趣小组同学对CO2进行了一系列的调查研究,请对小组同学的下列材料进行分析作答。
I.自工业革命以来,CO2排放量逐年递增。作为最主要的温室气体,会导致全球气候变暖,这也引起世界各国的高度重视。中国作为负责任的大国,向世界庄严承诺在2035年实现“碳达峰”,2060年实现“碳中和”。
“碳捕捉和封存”技术是实现碳中和的重要途径之一。
“碳捕捉技术”是指通过一定的方法,将工业中产生的CO2分离出来进行储存和利用的新工艺和技术。科学家设想利用碳酸钙与氧化钴之间的相互转化,在太阳能加热器的作用下“捕捉”与“释放”CO2实现碳循环。
“碳封存技术”是指将CO2捕捉、压缩后运输到选的地,点长期储存。目前正在研究的技术有:海洋封存——利用庞大的水体使海洋成为封存CO2的容器;地质封存——将CO2注入特定的地层等。
(1)①碳酸钙高温分解产生氧化钙的化学反应方程式为 , 生成的氧化钙具有疏松、多孔的结构特点,常用以捕集CO2。
②地质封存CO2的方法之一是将CO2和水在低温、高压条件下形成一种固态的二氧化碳水合物封存。该过程中CO2分子间间隔(填“变大”、“变小”或“不变”)。
II.某购物平台有自制碳酸饮料的设备出售,与该设备一同出售的还有二氧化碳弹,用设备将其“打”入水中,便可形成碳酸饮料。小组同学购买后制备碳酸饮料进行实验,探究影响CO2溶解能力的因素。
【活动一】探究温度和压强对CO2溶解能力的影响
实验1:标准大气压下,向试管中分别加入所购设备自制的无色碳酸饮料100mL,大烧杯中加入不同温度的水,小烧杯中加入适量澄清石灰水。
(2)由实验1得到的结论是:温度升高,二氧化碳的溶解能力(选填“变大”、“变少“或“不变”),小组同学建议:制好碳酸饮料后,应(选填“低温”、“高温”或“常温”)保存。
实验装置
实验序号
大烧杯中
水的温度
试管中产生
气泡的速率
澄清石灰水
的现象
实验①
0℃
缓慢
不浑浊
实验②
20℃
适中
不浑浊
实验③
90℃
很快
变浑浊
实验2:室温下,向试管中分别加入100mL,自制无色碳酸饮料(针筒体积为100mL)。
实验装置
实验序号
注射器活塞的位置
试管中产生气泡的速率
实验④
不拉动活塞
适中
实验⑤
向上拉活塞到25mL
变快
实验⑥
向上拉活塞到50mL
变得更快
(3)由实验2可知,压强越大,CO2溶解的量越(选填“多”或“少”);小组同学推测所购设备的作用是 , 使得二氧化碳能大量溶解于水中,形成碳酸饮料。
【活动二】探究CO2在不同物质的溶解性
实验3:烧瓶中收集250mL的气体,分别加入50mL不同液体,通过压强传感器测定瓶中压强变化(实验前烧瓶内压强为104.20kPa,实验过程中保持温度恒定)。
实验操作
实验序号
烧瓶中气体
注射器中物质
实验后瓶内压强

实验⑦
空气
水
130.25kPa
实验⑧
CO2
水
104.98kPa
实验⑨
CO2
盐酸
106.67kPa
实验⑩
CO2
小苏打溶液
103.40kPa
(4)实验后瓶内的压强,实验⑧小于实验⑦,其原因中存在一个化学反应,该反应的化学方程式为。
(5)通过实验(填实验序号)中数据可知,1体积水约能溶解1体积CO2。
(6)根据实验3分析可知,选用排液体收集CO2效果更好。
-
19、化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。
(一)氧气是参与“氧循环”的重要物质。
 (1)、若用图1装置测出空气中氧气体积分数小于、可能的原因是(答一点)。(2)、利用如图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释BC段气体压强变化的原因。(3)、某同学进行如图3所示实验时发现,产物中有少许黄色固体。
(1)、若用图1装置测出空气中氧气体积分数小于、可能的原因是(答一点)。(2)、利用如图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释BC段气体压强变化的原因。(3)、某同学进行如图3所示实验时发现,产物中有少许黄色固体。【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与空气中的氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水反应生成氨气。氨气的水溶液呈碱性。
【做出猜想】黄色固体为Mg3N2
【实验过程】进行图4实验。取燃烧产物于烧杯B中,加水,用大烧杯罩住小烧杯A和B。
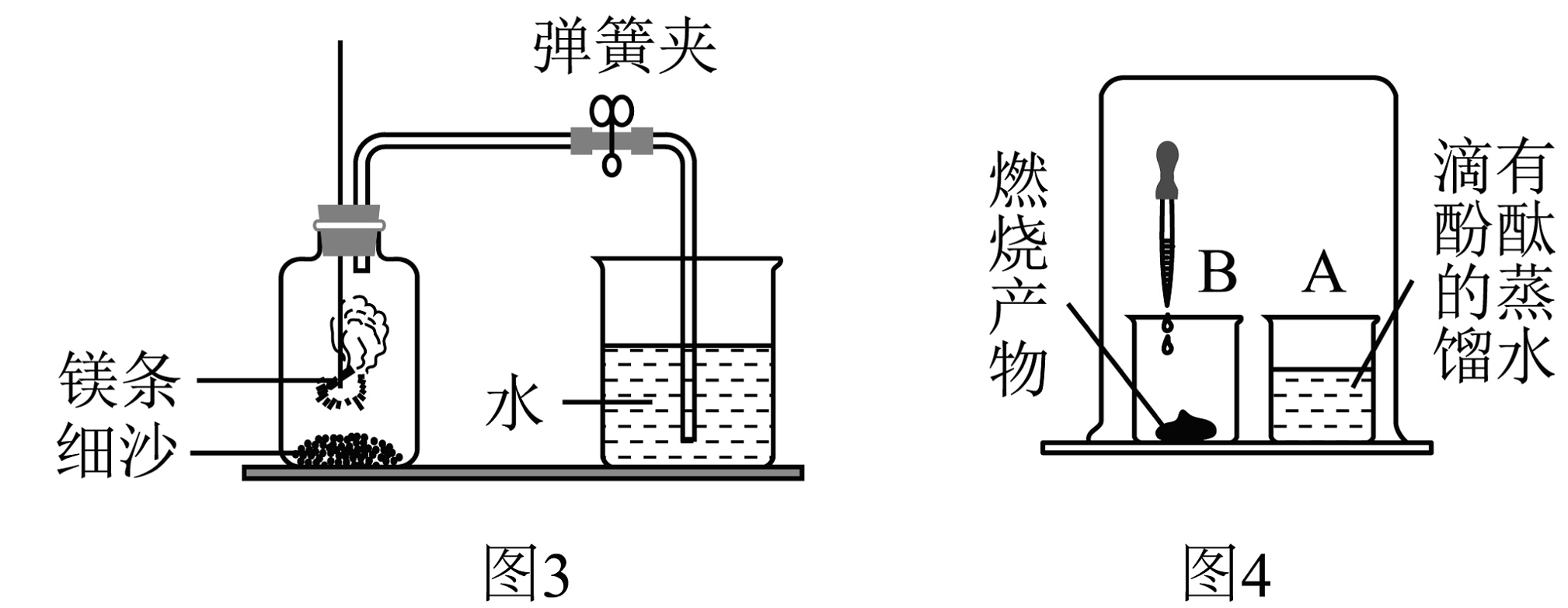
【实验结论】观察到的现象: , 据此可推断燃烧产物中含氮化镁(Mg3N2)。
【反思交流】进行如图3所示实验时,在规范操作的前提下,该同学所测得的空气中氧气的体积分数(填“大于”、“小于”或“等于”)。
-
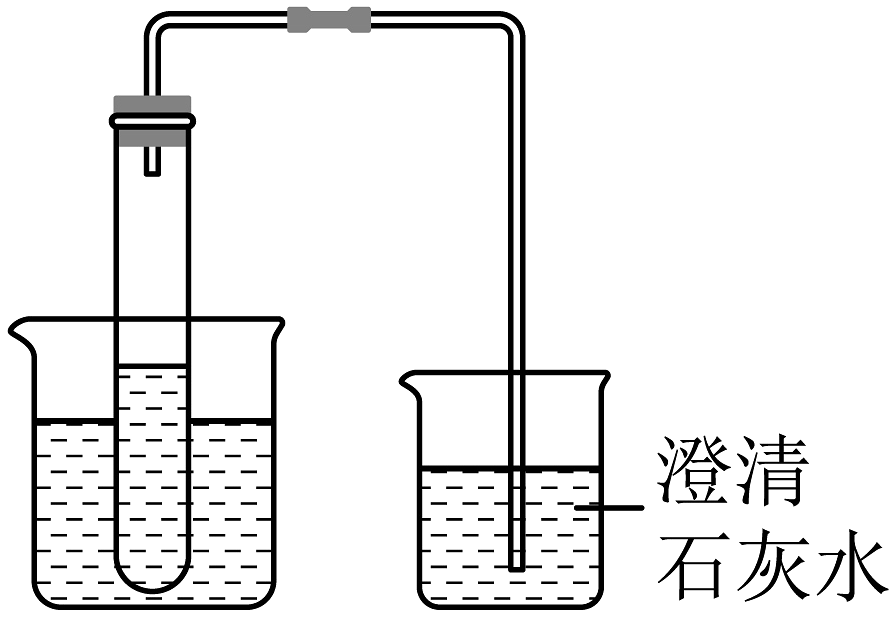
20、回答下列问题:(1)、如图是探究燃烧条件的三组实验。已知:着火点(白磷)=40℃,着火点(红磷)=240℃。
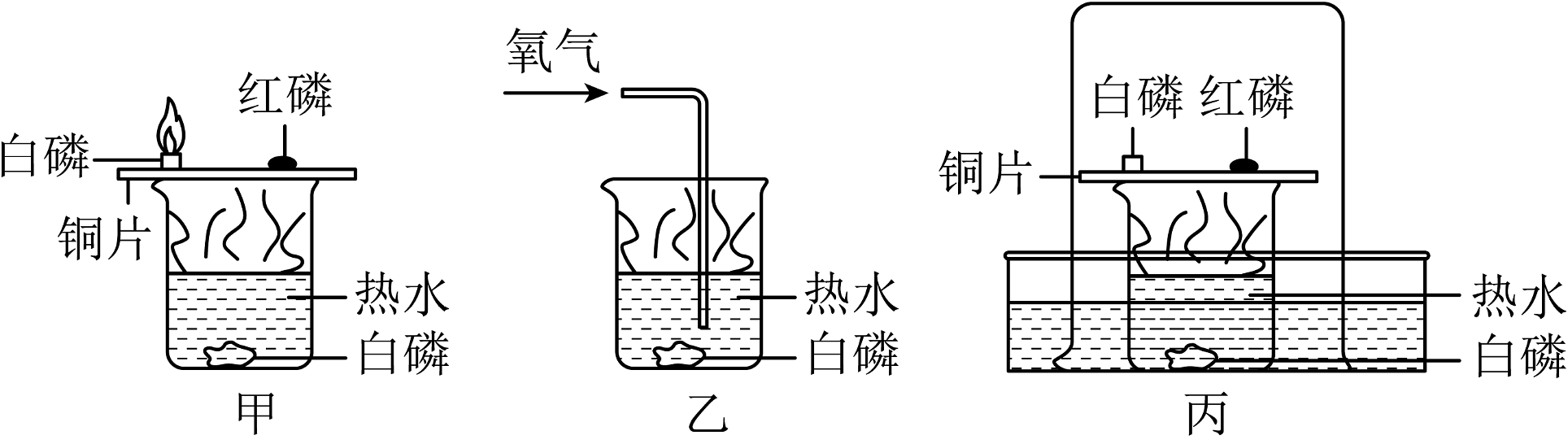
①甲实验可以得出有关可燃物燃烧的条件是。
②用丙装置进行实验时,可观察到外层大烧杯内壁上的水位高低变化情况是。
③以下对三组实验进行的分析或总结中,错误的是(填字母序号)。
A.甲实验中小烧杯里的热水只起提高温度的作用
B.乙实验中白磷换成红磷,也能观察到燃烧现象
C.丙实验可以粗略测定烧杯内空气中氧气的含量
D.丙实验还有环保、防止污染空气的优点
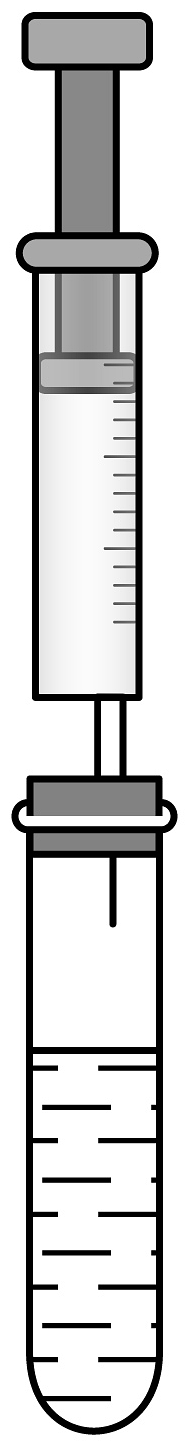
(2)、已知铂丝可作H2O2分解的催化剂。为加深对燃烧条件的认识,设计了如图所示实验装置。
①圆底烧瓶若安全管内液面上升太快,可(填操作)缓解压强增大。
②打开弹簧夹,可观察到W形管中的现象为。
③若要验证燃烧的条件之一是必须与充足的氧气接触,应对比观察的现象。
④上述实验装置的优点是。