-
1、
某化学兴趣小组同学对CO2进行了一系列的调查研究,请对小组同学的下列材料进行分析作答。
I.自工业革命以来,CO2排放量逐年递增。作为最主要的温室气体,会导致全球气候变暖,这也引起世界各国的高度重视。中国作为负责任的大国,向世界庄严承诺在2035年实现“碳达峰”,2060年实现“碳中和”。
“碳捕捉和封存”技术是实现碳中和的重要途径之一。
“碳捕捉技术”是指通过一定的方法,将工业中产生的CO2分离出来进行储存和利用的新工艺和技术。科学家设想利用碳酸钙与氧化钴之间的相互转化,在太阳能加热器的作用下“捕捉”与“释放”CO2实现碳循环。
“碳封存技术”是指将CO2捕捉、压缩后运输到选的地,点长期储存。目前正在研究的技术有:海洋封存——利用庞大的水体使海洋成为封存CO2的容器;地质封存——将CO2注入特定的地层等。
(1)①碳酸钙高温分解产生氧化钙的化学反应方程式为 , 生成的氧化钙具有疏松、多孔的结构特点,常用以捕集CO2。
②地质封存CO2的方法之一是将CO2和水在低温、高压条件下形成一种固态的二氧化碳水合物封存。该过程中CO2分子间间隔(填“变大”、“变小”或“不变”)。
II.某购物平台有自制碳酸饮料的设备出售,与该设备一同出售的还有二氧化碳弹,用设备将其“打”入水中,便可形成碳酸饮料。小组同学购买后制备碳酸饮料进行实验,探究影响CO2溶解能力的因素。
【活动一】探究温度和压强对CO2溶解能力的影响
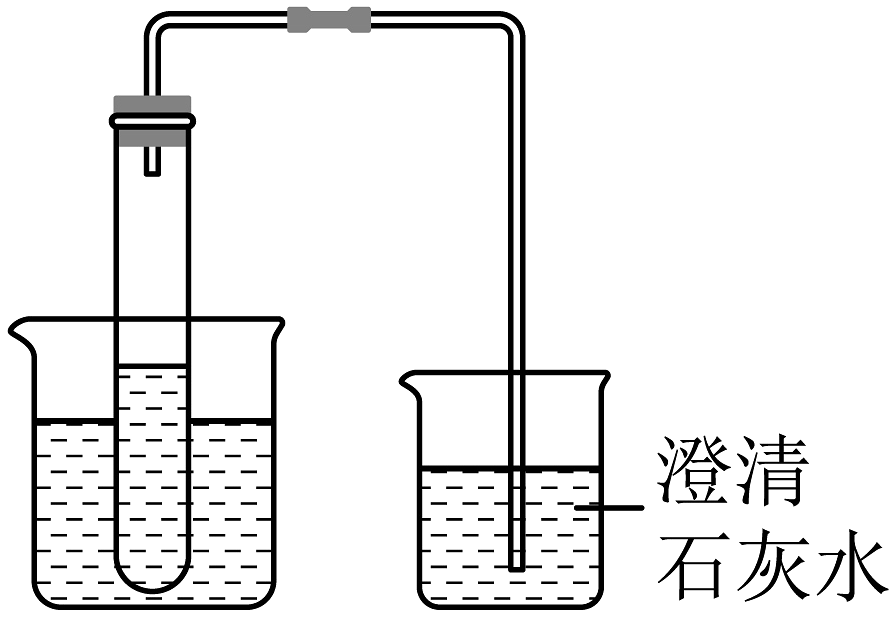
实验1:标准大气压下,向试管中分别加入所购设备自制的无色碳酸饮料100mL,大烧杯中加入不同温度的水,小烧杯中加入适量澄清石灰水。
(2)由实验1得到的结论是:温度升高,二氧化碳的溶解能力(选填“变大”、“变少“或“不变”),小组同学建议:制好碳酸饮料后,应(选填“低温”、“高温”或“常温”)保存。
实验装置
实验序号
大烧杯中
水的温度
试管中产生
气泡的速率
澄清石灰水
的现象
实验①
0℃
缓慢
不浑浊
实验②
20℃
适中
不浑浊
实验③
90℃
很快
变浑浊
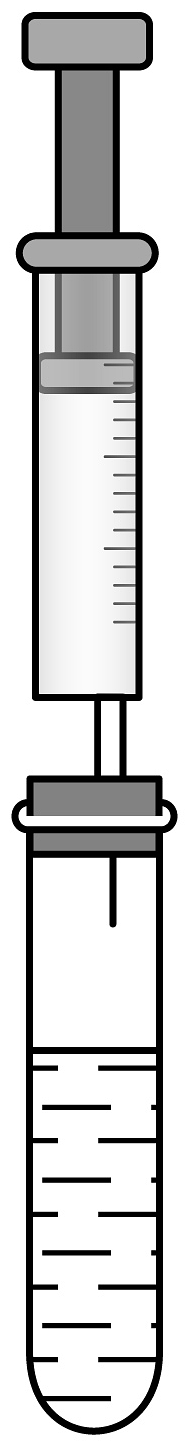
实验2:室温下,向试管中分别加入100mL,自制无色碳酸饮料(针筒体积为100mL)。
实验装置
实验序号
注射器活塞的位置
试管中产生气泡的速率
实验④
不拉动活塞
适中
实验⑤
向上拉活塞到25mL
变快
实验⑥
向上拉活塞到50mL
变得更快
(3)由实验2可知,压强越大,CO2溶解的量越(选填“多”或“少”);小组同学推测所购设备的作用是 , 使得二氧化碳能大量溶解于水中,形成碳酸饮料。
【活动二】探究CO2在不同物质的溶解性
实验3:烧瓶中收集250mL的气体,分别加入50mL不同液体,通过压强传感器测定瓶中压强变化(实验前烧瓶内压强为104.20kPa,实验过程中保持温度恒定)。
实验操作
实验序号
烧瓶中气体
注射器中物质
实验后瓶内压强

实验⑦
空气
水
130.25kPa
实验⑧
CO2
水
104.98kPa
实验⑨
CO2
盐酸
106.67kPa
实验⑩
CO2
小苏打溶液
103.40kPa
(4)实验后瓶内的压强,实验⑧小于实验⑦,其原因中存在一个化学反应,该反应的化学方程式为。
(5)通过实验(填实验序号)中数据可知,1体积水约能溶解1体积CO2。
(6)根据实验3分析可知,选用排液体收集CO2效果更好。
-
2、化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。
(一)氧气是参与“氧循环”的重要物质。
 (1)、若用图1装置测出空气中氧气体积分数小于、可能的原因是(答一点)。(2)、利用如图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释BC段气体压强变化的原因。(3)、某同学进行如图3所示实验时发现,产物中有少许黄色固体。
(1)、若用图1装置测出空气中氧气体积分数小于、可能的原因是(答一点)。(2)、利用如图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释BC段气体压强变化的原因。(3)、某同学进行如图3所示实验时发现,产物中有少许黄色固体。【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与空气中的氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水反应生成氨气。氨气的水溶液呈碱性。
【做出猜想】黄色固体为Mg3N2
【实验过程】进行图4实验。取燃烧产物于烧杯B中,加水,用大烧杯罩住小烧杯A和B。
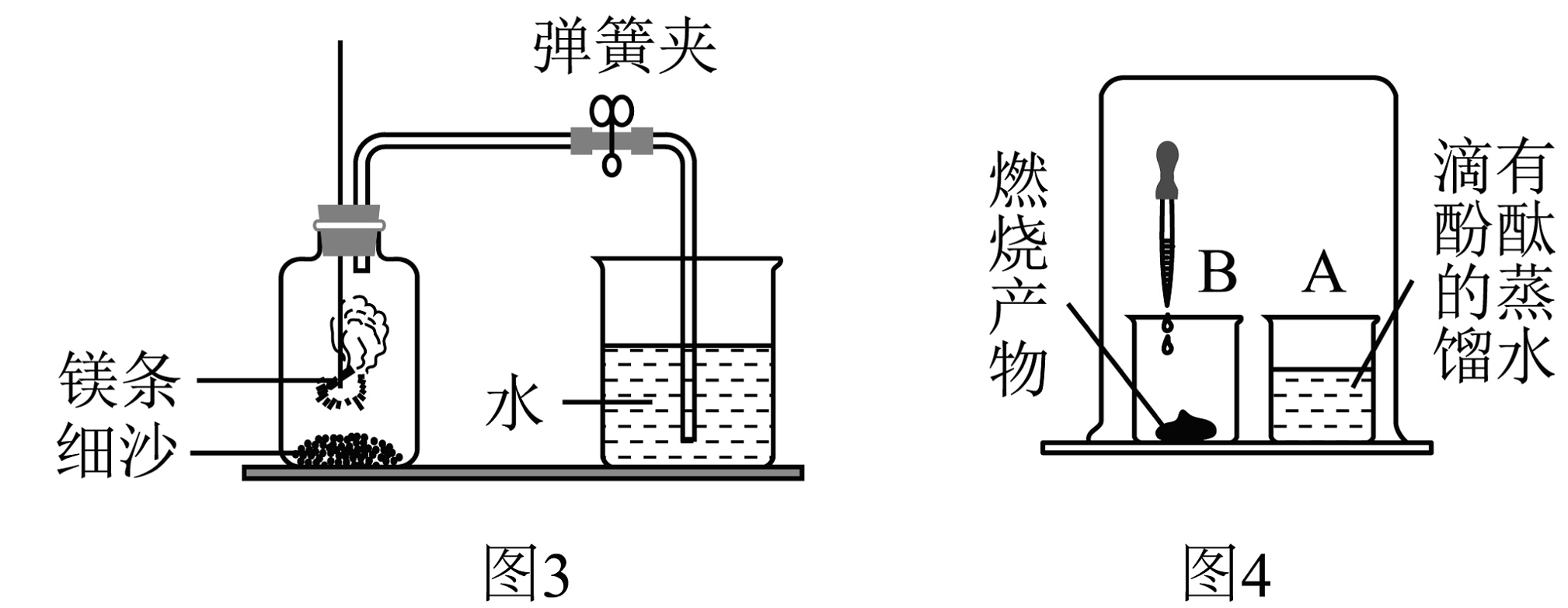
【实验结论】观察到的现象: , 据此可推断燃烧产物中含氮化镁(Mg3N2)。
【反思交流】进行如图3所示实验时,在规范操作的前提下,该同学所测得的空气中氧气的体积分数(填“大于”、“小于”或“等于”)。
-
3、回答下列问题:(1)、如图是探究燃烧条件的三组实验。已知:着火点(白磷)=40℃,着火点(红磷)=240℃。
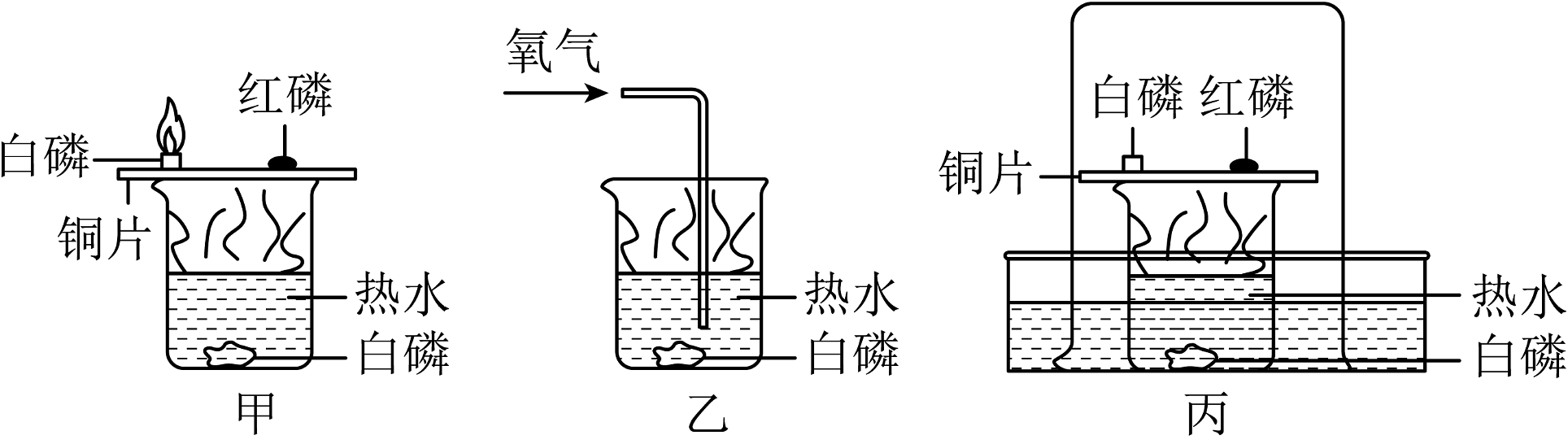
①甲实验可以得出有关可燃物燃烧的条件是。
②用丙装置进行实验时,可观察到外层大烧杯内壁上的水位高低变化情况是。
③以下对三组实验进行的分析或总结中,错误的是(填字母序号)。
A.甲实验中小烧杯里的热水只起提高温度的作用
B.乙实验中白磷换成红磷,也能观察到燃烧现象
C.丙实验可以粗略测定烧杯内空气中氧气的含量
D.丙实验还有环保、防止污染空气的优点
(2)、已知铂丝可作H2O2分解的催化剂。为加深对燃烧条件的认识,设计了如图所示实验装置。
①圆底烧瓶若安全管内液面上升太快,可(填操作)缓解压强增大。
②打开弹簧夹,可观察到W形管中的现象为。
③若要验证燃烧的条件之一是必须与充足的氧气接触,应对比观察的现象。
④上述实验装置的优点是。
-
4、研究性学习小组选择下列某些仪器进行气体的制取、收集等实验探究。(1)、制取气体时,按要求组装好仪器后,应先 , 再添加药品。(2)、观察图1,实验室制取氧气的方法有多种,例如:
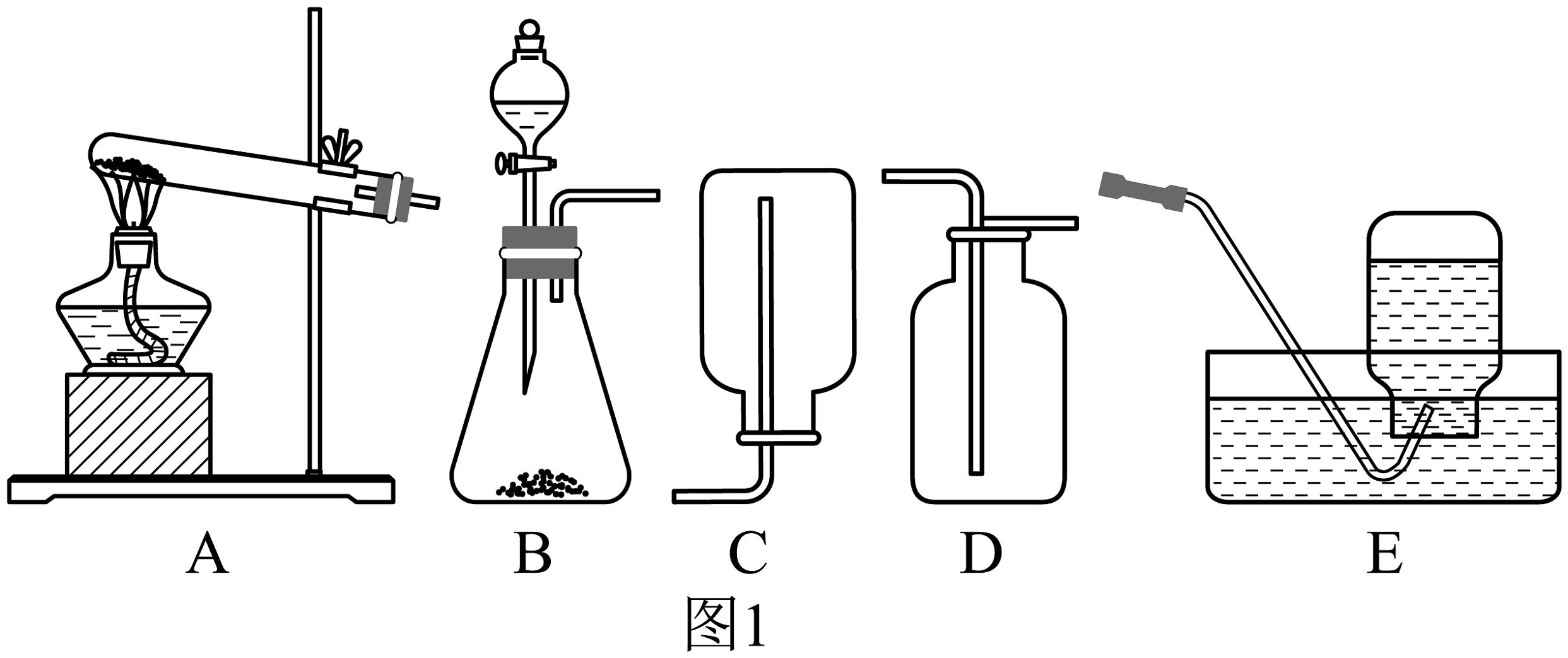
①加热分解高锰酸钾固体
②利用二氧化锰作催化剂分解过氧化氢溶液
若用方法①制取氧气应选用的发生装置是(选填字母序号),选择时考虑的因素是;若用方法②制取氧气,其反应原理用化学方程式表示为。
(3)、实验室用二氢体锰催化过氧化氢溶液生成氧气,并选用排水法收集氧气时,下列说法不正确的是_____。A、因O2难溶于水,所以可用排水法收集 B、导管口一有气泡冒出,要立即用集气瓶收集 C、收集满O2的集气瓶,用玻璃片盖好瓶口,正放在桌面 D、实验过程中要节约使用药品(4)、该小组设计了如图2所示的实验装置,既可用于制取气体,又可用于探究物质性质。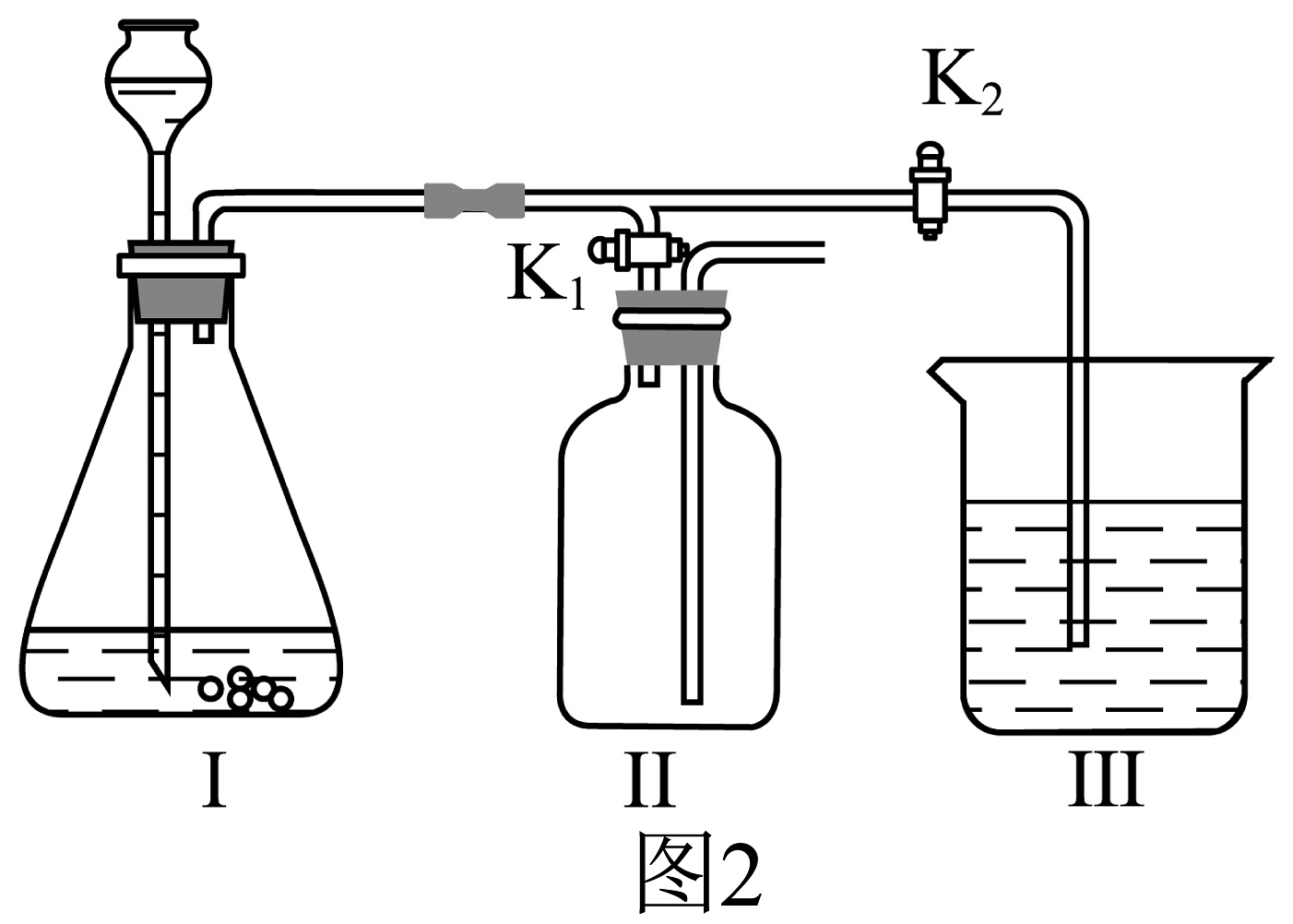
①当打开K1、关闭K2时,利用I、II装置,可进行的实验是(填字母)。
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用I、III装置制得二氧化碳并验证其性质。实验室制取二氧化碳的化学方程式是;若要证明二氧化碳能与水发生反应,应向烧杯的水中加入。
-
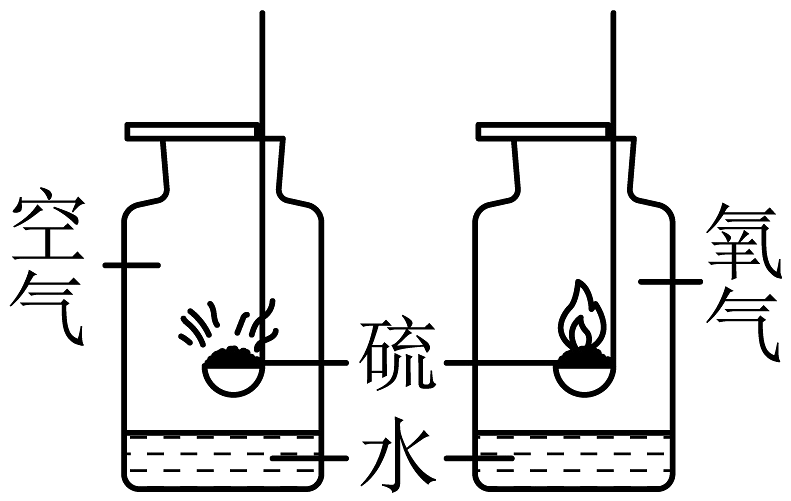
5、分类、类比是学习化学常用的方法。(1)、科学合理的化学实验是获取化学知识。形成科学思维的重要保证。初中有很多对比实验,但对比实验也有不同之处:有的实验应按先后顺序依次进行,有的实验需要同步进行。据此将下列实验中的A与______归为一类。A、木炭分别在空气中和氧气中燃烧 B、蜡烛在不同条件下的燃烧 C、硫分别在空气中和氧气中燃烧 D、比较吸入空气和呼出气体中CO2含量多少(2)、上述实验C中硫在氧气中燃烧的现象为。(3)、原子结构的奥秘被揭示后,人们逐步建立了结构决定性质的观念。Li、Ka、K、Rb(铷)、Cs(铯)位于元素周期表第一纵列,它们的原子最外层电子数相同,化学性质非常相似。它们的单质与水反应,生成的化合物中金属元素的化合价相同。例如:2Li+2H2O=2LiOH+H2↑、Na+2H2O=2NaOH+H2↑。用M代表K、Rb(铷)、Cs(铯)这三种活泼金属中的某一种,请仿照上述两个反应写出M与水发生反应的化学方程式:。
-
6、科普阅读。
北京冬奥会期间,近千辆氢燃料电池大巴车参与服务。氢燃料电池系统包括电堆、氢气供应系统、氧气供应系统等。氢气和氧气通过在电堆中发生化学反应,实现能量转化。氢燃料电池效率高,发电效率达到80%以上。随着氢燃料电池汽车的广泛使用,氢能产业链也得到长足发展。
氢的储运是氢能产业链中的瓶颈问题。目前,储氢技术有了新的发展,其中金属氢化物储氢是把氢以氢化物的形式储存在金属或合金中。如图为一些储氢材料的质量储氢密度(储氢后氢元素在储氢材料中的质量分数)。
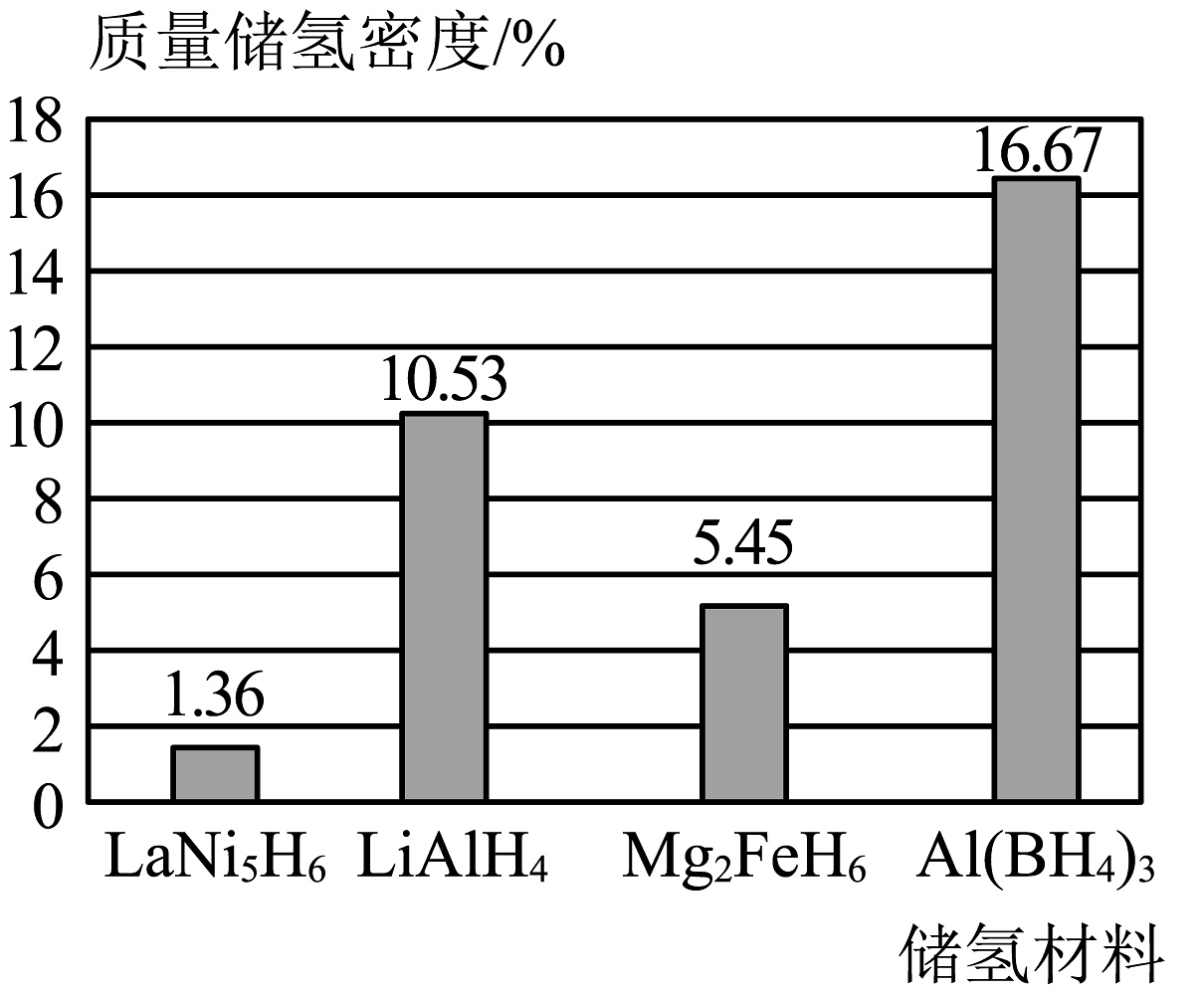 (1)、氢燃料电池的能量转化形式是。写出该化学反应的方程式。(2)、结合图示,储氢材料中最理想的是。(3)、氢燃料电池具有广阔应用前景的依据是(写一条即可)。
(1)、氢燃料电池的能量转化形式是。写出该化学反应的方程式。(2)、结合图示,储氢材料中最理想的是。(3)、氢燃料电池具有广阔应用前景的依据是(写一条即可)。 -
7、生活中处处有化学。分析下列生活情景,回答问题。(1)、用洗洁精的作用去除餐具上的油污。(2)、我们青岛大部分家庭的厨房燃料为天然气,它的主要成分是(写化学式)。(3)、石墨烯是由碳原子组成的单层蜂窝状结构,可用于航天器电池的制造,这主要是利用石墨烯的。(4)、真空包装和冰箱冷藏都可以延长食品的保存时间。是通过控制反应条件(选填“促进”或“抑制”)化学反应,满足人们的需要。(5)、在水处理系统中,用活性炭除去色素和异味,是利用了它的性。
-
8、下列图像能正确反映对应实验操作的是A、等量NaOH和NaCl固体分别溶于室温下等量水中
 B、一定质量高锰酸钾固体受热分解
B、一定质量高锰酸钾固体受热分解 C、用一定量的双氧水制取氧气
C、用一定量的双氧水制取氧气 D、向一定量的硫酸铜溶液中加入铁钉
D、向一定量的硫酸铜溶液中加入铁钉
-
9、下列从学科观点对碳循环和氧循环的认识正确的是
 A、变化观:每个人都在参与碳、氧循环 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、微粒观:绿色植物的作用是使自然界中氧原子总数增加 D、平衡观:碳、氧循环可维持大气中O2和CO2含量相对稳定,消耗二氧化碳途径有①和⑥
A、变化观:每个人都在参与碳、氧循环 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、微粒观:绿色植物的作用是使自然界中氧原子总数增加 D、平衡观:碳、氧循环可维持大气中O2和CO2含量相对稳定,消耗二氧化碳途径有①和⑥ -
10、证据推理是化学学科核心素养的重要内容,下列推理合理的是A、碳、硫、铁丝燃烧既是氧化反应又是化合反应,所以所有的氧化反应都是化合反应 B、化合物是由不同种元素组成的,所以由不同种元素组成的纯净物一定是化合物 C、在装满CO2的软塑料瓶中加入一定量的水,塑料瓶变瘪,则说明CO2溶于水 D、金刚石和石墨都由碳元素组成,化学性质相同,所以组成元素相同的物质化学性质相同
-
11、设计对比实验,控制变量是学习化学的重要方法。下列对比实验不能达到目的的是
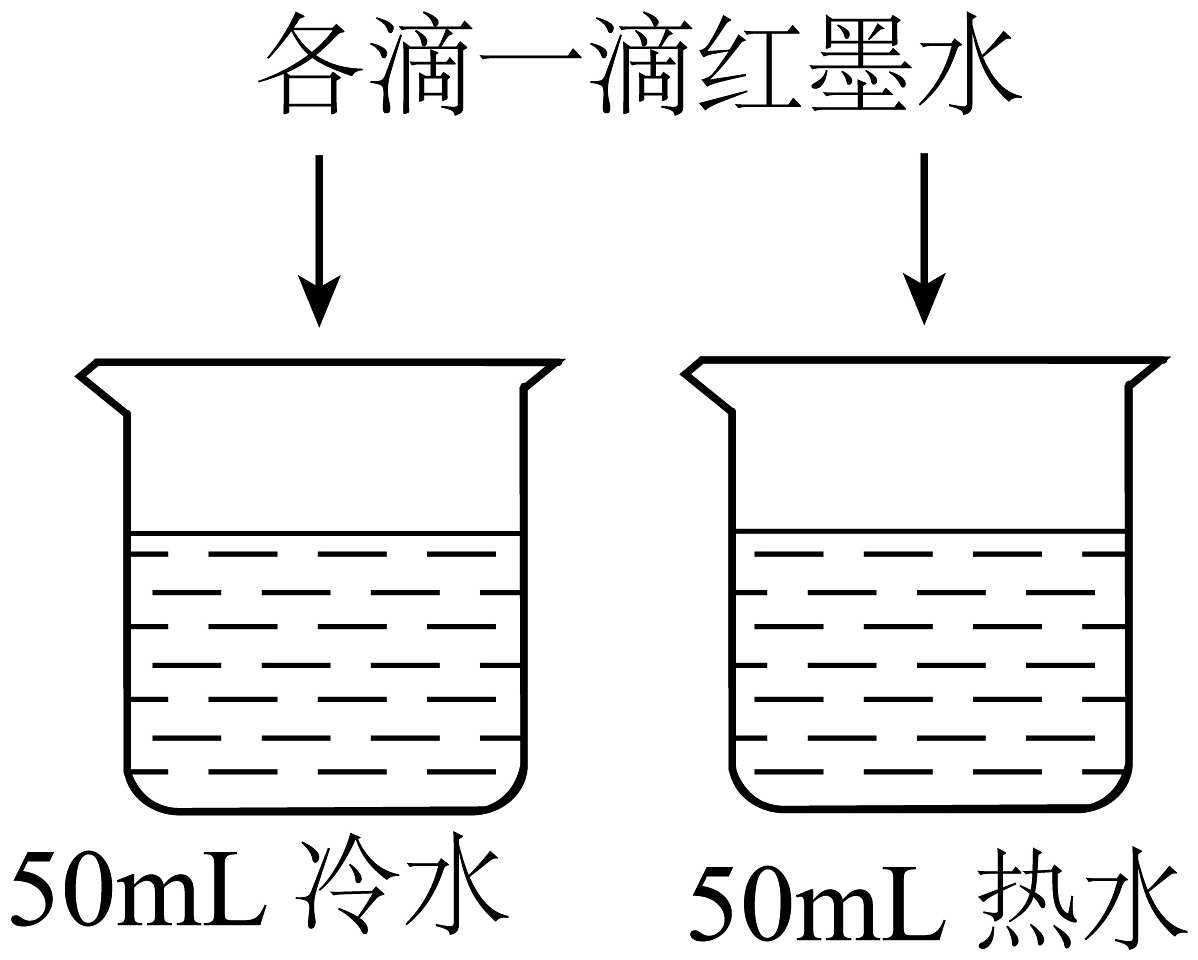
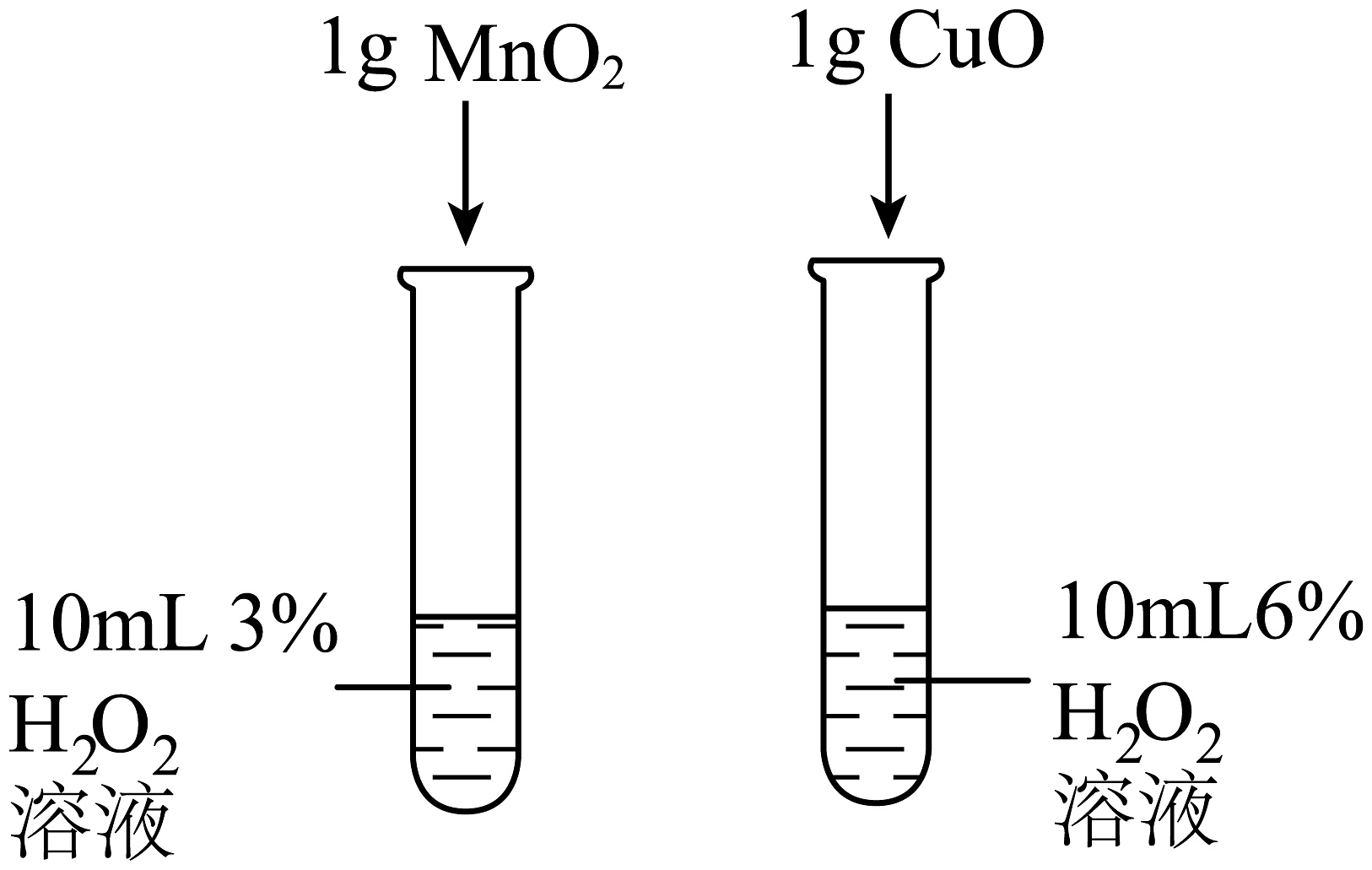
实验设计

实验目的
A.探究O2浓度对硫燃烧剧烈程度的影响
B.探究温度对分子运动快慢的影响
C.比较不同催化剂对H2O2分解速率的影响
D.探究同种溶质在不同溶剂中的溶解性
A、A B、B C、C D、D -
12、如图表示元素的化合价与物质类别关系,若它表示氮元素的部分关系图,则下列说法错误的是( )
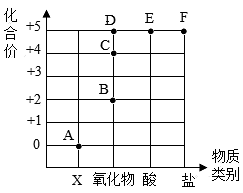 A、A点对应的物质类别是单质 B、B点表示物质的化学式为NO C、某化合物的化学式为KNO3 , 它代表的点是F D、写出由D点表示的物质与水发生反应生成E的化学方程式:3NO2+H2O=2HNO3+NO
A、A点对应的物质类别是单质 B、B点表示物质的化学式为NO C、某化合物的化学式为KNO3 , 它代表的点是F D、写出由D点表示的物质与水发生反应生成E的化学方程式:3NO2+H2O=2HNO3+NO -
13、如图是测定空气中氧气含量的实验,对该实验的认识正确的是
 A、该实验中的铜粉可以换成炭粉 B、熄灭酒精灯后,立即读数 C、加热过程中,要来回推拉注射器的活塞 D、正确操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的
A、该实验中的铜粉可以换成炭粉 B、熄灭酒精灯后,立即读数 C、加热过程中,要来回推拉注射器的活塞 D、正确操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的 -
14、已知元素周期表中第三周期各元素原子结构示意图如图,下列分析正确的是
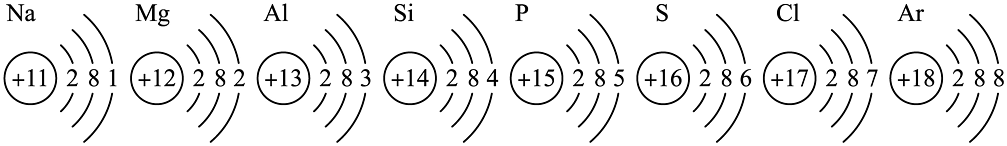 A、在此周期中,各元素原子结构变化规律是随核电荷数递增,最外层电子数从1递增到8 B、氩原子的最外层电子达到稳定结构,不会发生任何化学变化 C、Mg与S形成化合物的化学式为MgS2 D、硫离子(S2-)和氯离子(Cl-)的核外电子数不相同
A、在此周期中,各元素原子结构变化规律是随核电荷数递增,最外层电子数从1递增到8 B、氩原子的最外层电子达到稳定结构,不会发生任何化学变化 C、Mg与S形成化合物的化学式为MgS2 D、硫离子(S2-)和氯离子(Cl-)的核外电子数不相同 -
15、辣椒中含有的辣椒碱是一种天然植物碱,其化学式为C18H27NO3 , 下列说法正确的是A、辣椒碱由49个原子构成 B、辣椒碱中氢元素的质量分数最大 C、辣椒碱中碳、氢元素的质量比为2:3 D、辣椒碱由碳、氢、氮、氧四种元素组成
-
16、下列各项对相关异常情况的解释不合理的是A、细铁丝在纯氧中燃烧,集气瓶底炸裂可能是没放水或沙子 B、过滤操作中滤液浑浊的原因可能是滤纸破损 C、用排水法收集氧气,收集到的气体不纯,可能是瓶底留有少量水 D、一定质量的金属镁在空气中燃烧后固体质量减小,可能是部分白烟扩散到空气中
-
17、中华传统文化博大精深。下列说法错误的是A、“刀耕火耨”与“铁杵成针”都属于化学变化 B、“遥知不是雪,为有暗香来”体现了分子在不断地运动 C、“爆竹声中一岁除,春风送暖入屠苏”说明爆竹中的成分硫磺具有可燃性 D、“冰,水为之,而寒于水”体现了物质的状态不同,物理性质不同
-
18、伽利略说:“一切推理都必须从观察和实践中得来。”以下推理正确的是A、分子可以直接构成物质,则溶质都是以分子形式分散到溶剂中形成溶液 B、二氧化碳过多能引起温室效应,所以二氧化碳是大气污染物 C、H2O和H2O2的组成元素相同,所以二者的化学性质相同 D、稀有气体的化学性质稳定,所以稀有气体可用作保护气
-
19、下列有关水和溶液的说法正确的是A、可乐、雪碧、咖啡、牛奶等,都是生活中常见的溶液 B、配制好的溶液装瓶时不慎洒出少量,不会影响溶液溶质质量分数 C、溶液是均一、稳定的,溶质均匀分散在溶剂中且静止不动 D、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
-
20、硒元素在元素周期表中的部分信息如图所示,下列说法正确的是
 A、硒的相对原子质量为34 B、硒元素属于非金属元素 C、硒的核内质子数为78.96 D、摄入过量的硒可以防癌
A、硒的相对原子质量为34 B、硒元素属于非金属元素 C、硒的核内质子数为78.96 D、摄入过量的硒可以防癌