-
1、实验室需要配制17%的氯化钠溶液50g。
 (1)、计算:需要氯化钠的质量为g。(2)、B中仪器的名称为;E中玻璃棒的作用。(3)、若图A中砝码的质量为5g,游码的示数为3.5g,则小明称得氯化钠的质量实际为g。(4)、若用B观察方式量取水的体积,所配制溶液的溶质质量分数会(填“偏大”、“偏小”或“无影响”)。
(1)、计算:需要氯化钠的质量为g。(2)、B中仪器的名称为;E中玻璃棒的作用。(3)、若图A中砝码的质量为5g,游码的示数为3.5g,则小明称得氯化钠的质量实际为g。(4)、若用B观察方式量取水的体积,所配制溶液的溶质质量分数会(填“偏大”、“偏小”或“无影响”)。 -
2、化学实验能提升科学素养,某学习小组走进实验室,进行实验探究,请回答下列问题。(1)、探究“实验室制备氧气”实验,如下图所示,请回答下列问题:

①组装仪器后,加入药品前,应先。
②以过氧化氢溶液和二氧化锰来制取氧气时,可选用的发生装置是(填字母);该反应的化学方程式。反应前后,二氧化锰的和不变。
③如果用装置F来收集取氧气,验满的方法为:将带火星木条放在导管口(填“a”或“b”)处,若复燃,则已满。
(2)、探究“氧气的化学性质”实验,如下图所示,请回答下列问题:
①细铁丝在空气中不能燃烧。细铁丝在氧气中剧烈燃烧,火星四射,放出大量热,生成色固体,写出细铁丝在氧气中燃烧的化学方程式:;集气瓶底预留少量水的原因是:。
②木炭在空气中燃烧发出红光,在氧气中剧烈燃烧发光。写出木炭在氧气中燃烧的化学方程式:;图⑥的实验现象是。
③根据上述细铁丝和木炭燃烧的实验,归纳得出物质燃烧的剧烈程度与有关。
-
3、某学习小组通过查阅资料得知,工业上可利用二氧化碳生产尿素CO(NH2)2 , 既实现二氧化碳的转化,又获得化工产品。请回答以下问题:(1)、每个尿素分子中共有个原子:尿素中质量分数最大的元素是(填元素符号);(2)、尿素中碳元素和氢元素的质量比(填最简整数比)。(3)、60kg尿素中氮元素的质量kg。(4)、尿素是一种常用的化肥,下图是尿素包装换上的部分说明,请判断该化肥是(选填“纯净物”或“混合物”)。

-
4、请回答下列问题。(1)、化学用语是学习化学的重要工具,请用数字和化学符号按要求填空:
①氦气;
②2个钠离子;
③硝酸铵;
④氧化铝中铝元素显+3价;
⑤氢氧化钙。
(2)、请按要求从氮气、氧气、氧化铁、铜、氯化钠五种物质中选择合适的物质,将其化学式填写在下列空格中。①一种供给呼吸的气体;
②一种金属单质;
③食盐的主要成分;
④空气中含量最多的气体;
⑤一种氧化物。
(3)、化学与我们的生活息息相关。请回答下列问题。①桂花香:杭州亚运会闭幕式上能够闻到阵阵桂花香,请从微观角度解释:。
②桂花糕:桂花糕味道清香淡雅,富含钙、磷、铁、钾等,易于消化和吸收,补中益气,这里的“钙、磷、铁、钾”指的是(填“分子”、“原子”或“元素”)。
③我国氢能源汽车采用了第四代以氢气为燃料的电池技术,氢气作为理想的能源前景广阔,氢气作为燃料燃烧反应的化学方程式是;该反应的基本反应类型为反应。
-
5、下列实验与对应的图像正确的是A、
 是用红磷燃烧法测定空气中氧气的含量
B、
是用红磷燃烧法测定空气中氧气的含量
B、 是某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
C、
是某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
C、 用两份等质量、等浓度的过氧化氢溶液分别制取氧气
D、
用两份等质量、等浓度的过氧化氢溶液分别制取氧气
D、 将一定质量的碳在密闭容器中(含空气)燃烧
将一定质量的碳在密闭容器中(含空气)燃烧
-
6、推理是一种重要的思维方式。下列推理合理的是A、单质均由同种元素组成,所以由同种元素组成的物质都是单质 B、氧化物中含有氧元素,则含有氧元素的化合物一定是氧化物 C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化 D、含碳元素的物质充分燃烧会生成CO2 , 则在O2中燃烧能生成CO2的物质一定含碳元素
-
7、下列各组物质的鉴别和分离除杂方法中,能达到预期实验目的的是A、检验集气瓶中氧气是否收集满—带火星的木条伸入集气瓶中 B、鉴别蒸馏水和食盐水—分别加热蒸干,观察是否有固体残留 C、鉴别双氧水和水—加入二氧化锰 D、除去水中的色素—将水通过装有活性炭的净水器
-
8、如图是某密闭容器中物质变化过程的微观示意图,下列说法不正确的是
 A、该反应是化合反应 B、变化过程中分子数没有改变 C、该反应前后氧元素化合价没有改变 D、该反应中涉及两种氧化物
A、该反应是化合反应 B、变化过程中分子数没有改变 C、该反应前后氧元素化合价没有改变 D、该反应中涉及两种氧化物 -
9、科学家对人类文明和社会可持续发展作出了重要贡献。下列选项正确的是A、门捷列夫编制了元素周期表 B、屠呦呦等人成功研制出抗疟药物青蒿素 C、道尔顿确定了空气的组成 D、卢瑟福提出了原子的核式结构模型
-
10、如图所示,要想将去壳的熟鸡蛋吸入瓶中,可以向装有水的瓶中加入的物质是
 A、硝酸铵 B、氯化钠 C、浓硫酸 D、氢氧化钠
A、硝酸铵 B、氯化钠 C、浓硫酸 D、氢氧化钠 -
11、古代典籍中“银针验毒”的反应原理之一是:xAg+2H2S+O2=2Ag2S+2H2O。则x的数值及反应物中硫元素的化合价为A、2、-2 B、4、+2 C、4、-2 D、1、+2
-
12、下列物质由分子构成的是A、氦气 B、铜 C、一氧化碳 D、氯化钠
-
13、宏微结合是化学学科特有的思维方式。下列对宏观事实的微观解释不正确的是A、过氧化氢分解生成氧气—分子种类改变 B、氧气能被压缩贮存于钢瓶中—分子之间有间隔 C、气体受热体积变大—分子体积变大 D、一氧化碳能燃烧,二氧化碳不能燃烧—不同种分子的性质不同
-
14、下列实验操作中,正确的是A、
 加热固体药品
B、
加热固体药品
B、 检验氧气
C、
检验氧气
C、 倾倒液体
D、
倾倒液体
D、 量取水
量取水
-
15、化学在生活、生产中应用广泛,下列过程不属于化学变化的是A、
 光合作用
B、
光合作用
B、 木炭燃烧
C、
木炭燃烧
C、 葡萄酿酒
D、
葡萄酿酒
D、 干冰升华
干冰升华
-
16、一切反应以微观粒子相互作用为基础,用合适的方法计量微粒便于开展科学研究。(1)、国际上以一种碳原子质量的为标准,其他原子的质量与它相比较所得的比,作为这种原子的相对原子质量。根据这个标准,这种碳原子的相对原子质量为。(2)、已知核内有6个质子和6个中子的碳原子的质量为akg,一个铁原子的质量为bkg,则铁原子的相对原子质量为。(3)、我国科学院院士张青莲教授主持测定了多种原子的相对原子质量,其数据被确认为国际标准,如锢、钺、锌等。已知一种锌原子的相对原子质量约为65,核电荷数为30,则这种锌原子的中子数为。(4)、氢原子的质子数是1,氧原子的质子数是8,则一个水分子中的质子数是。(5)、某原子X的核电荷数为a能够形成Xn- , 另一个原子Y,能够形成与Xn-具有相同电子层结构的Y m+ , 则原子Y的质子数是。
-
17、
通过科学家的努力,人们对微观世界的认识越来越深入。
Ⅰ.“原子—分子”学说的建立经历了曲折的过程。
材料一 1897年,汤姆生发现原子中存在电子,随后1904年提出电子嵌于原子表面的枣糕型原子结构,否定了“原子不可再分”的观点。
材料二 1911年,卢瑟福用α粒子轰击金箔的实验,提出了“核式结构模型”,推翻了汤姆生提出的原子结构模型,为建立现代原子理论打下了基础。
(1)汤姆生发现原子中存在电子,电子带________电。卢瑟福通过实验得出原子是由________和________构成的,并提出了沿用至今的现代原子结构理论。在下图的三个原子结构模型中,能代表汤姆生原子结构模型的是________(填序号,后同),能代表卢瑟福原子结构模型的是________。

(2)分析“原子一分子”学说的建立过程,以下观点正确的是______(选填序号,下题同)。
A. 科学模型的建立是一个不断完善、修正的过程 B. 模型是一种重要的方法,人类借助模型构建对原子的认识逐渐接近本质 C. 科学结论的得出要依据客观事实,面对前人的观点要敢于质疑 D. 对于前人错误的科学理论应该全盘否定,不能借鉴 (3)如图是小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法正确的是_______。

A. 该原子的核电荷数为4 B. 该原子核由2个质子和2个中子构成 C. 该原子的质量主要集中在2个电子上 D. 模型中原子核与核外电子的体积大小比例与实际差不多 Ⅱ.请根据下图信息回答有关问题:
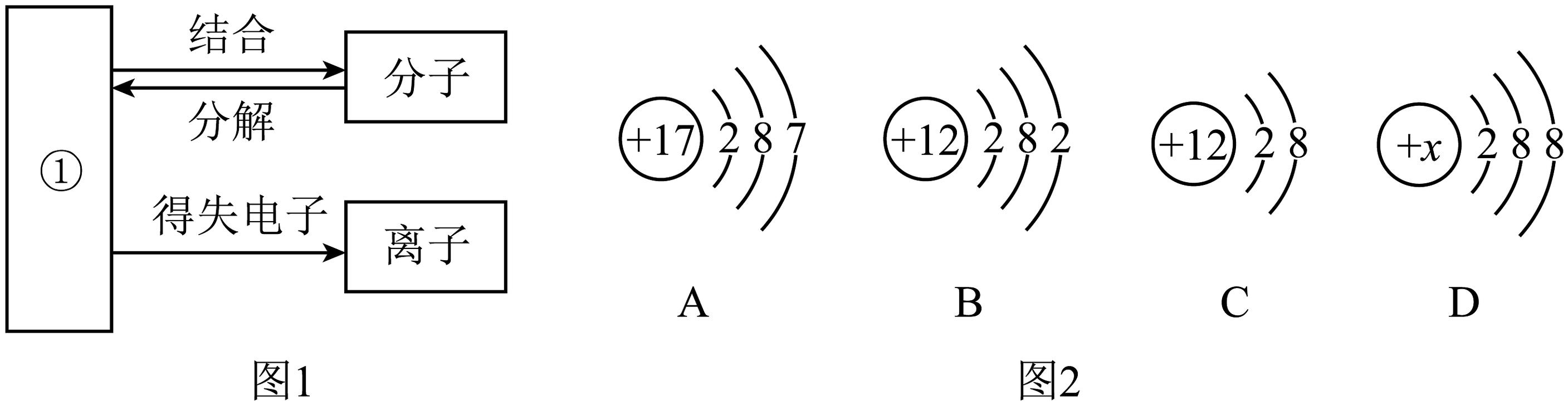
(4)图1为粒子之间的转化关系图,其中①表示的是________。下列物质中由离子构成的是________(选填下列序号,下同),由分子构成的是________。
A.二氧化碳 B.氩气 C.氯化钾 D.铜
(5)图2中A、B、C三种微粒属于离子的是________。图2中D为某粒子的结构示意图,当x=17时,则该粒子的符号可表示为________。A、B两种微粒形成化合物时的个数比为________。
-
18、
开展实验探究活动,提升科学实践素养。
Ⅰ.探究分子的基本性质
兴趣小组同学查阅资料,认识到浓氨水具有强挥发性,挥发出的氨气是一种带有刺激性气味的气体,能使酚酞试液变红色。小组设计了如下两套装置:
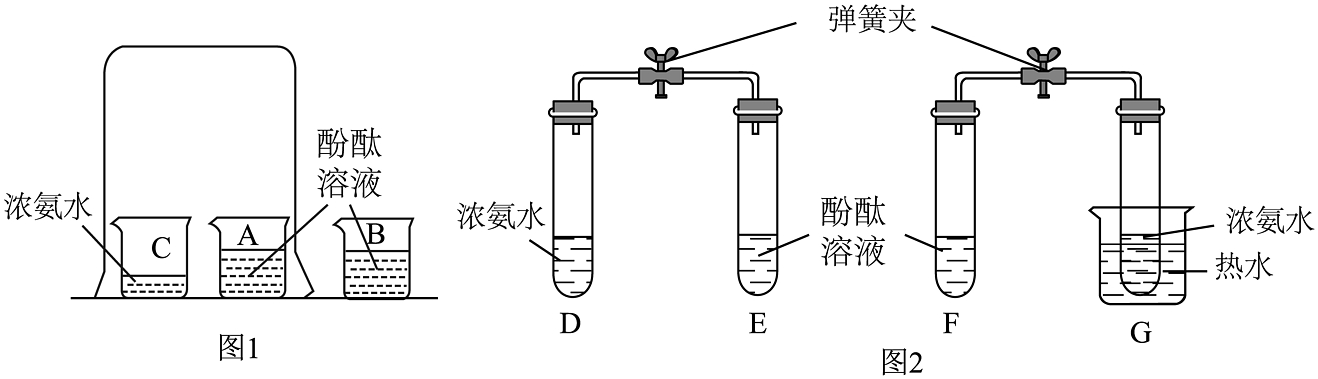
(1)图1装置实验中,观察到A烧杯中溶液变红,说明氨气分子________;B烧杯中溶液未变色,但仍然要设计此烧杯,其作用是________。
(2)图2装置实验中,对比观察E、F试管中的现象说明________。
(3)某同学对图1的实验进行了改进,如下图所示。实验中观察到棉花团a先变红色, b后变红。下列说法不合理的是_______(选填下列序号)。
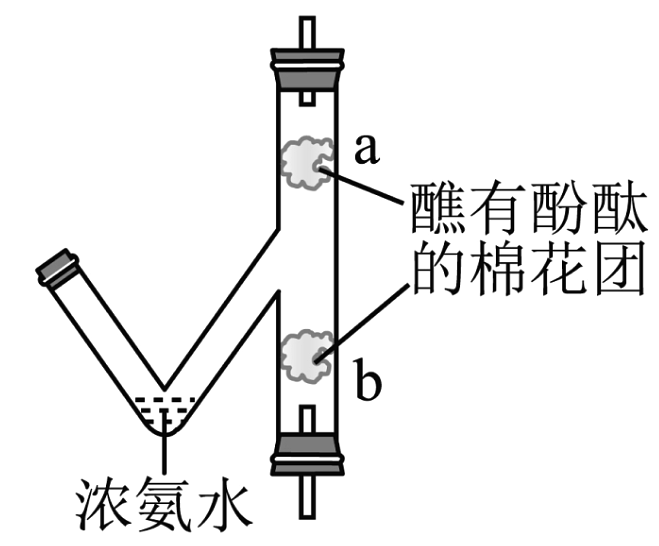
A. 该实验可以证明微粒在不断地运动 B. 该实验还可以证明氨气密度比空气大 C. 该装置的优点是节约药品、环保 D. 连接橡皮塞与玻璃管时,应稍用力旋转塞入 Ⅱ.探究水分子的变化
某小组同学设计下图装置进行电解水实验,先在电解器玻璃管里加满水(含少量NaOH),再接通直流电源。回答下列问题:

(4)加入少量NaOH的目的是________。电解时,玻璃管中产生气泡的位置在________(填“a”、“b”或“c”)处。甲、乙两支玻璃管中生成气体的体积比约为________。
(5)切断电源后,用燃着的木条在乙玻璃管尖嘴口检验产生的气体,观察到的现象是________,说明该气体是________(填写物质名称)。
(6)写出水在通电条件下反应的文字表达式________,该反应的基本类型是________(填“化合”或“分解”)反应。反应过程中的能量转化是________能转化成化学能。
(7)如图为水分子分解示意图,补全横线上的模型图________。
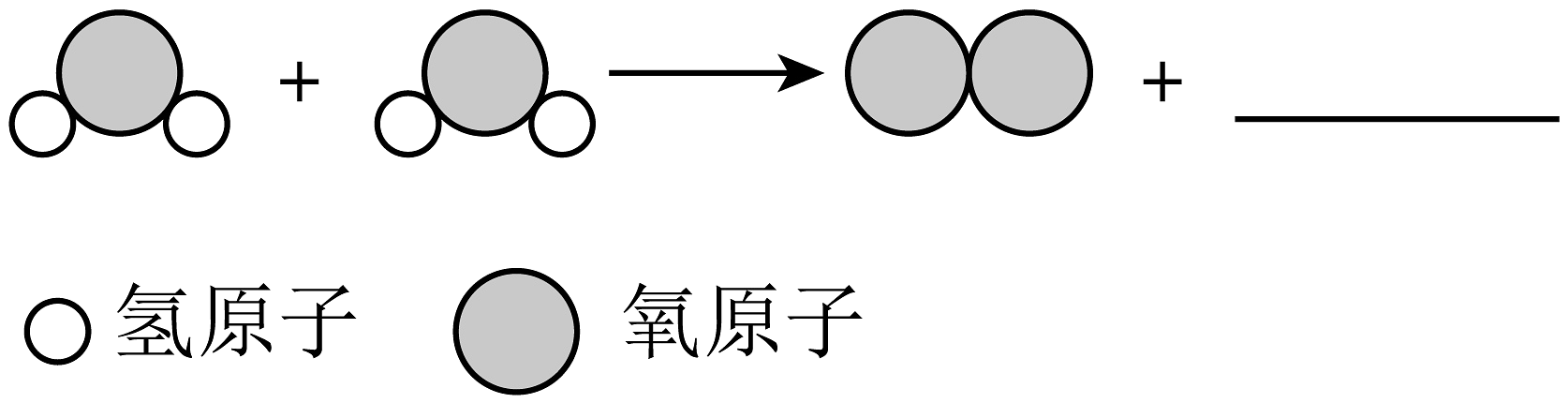
反应前后没有改变的微粒是________(填写微粒符号)。
-
19、学习化学要从生活中来,到生活中去。(1)、臭氧的化学符号是O3 , 在通常状况下是淡蓝色、有鱼腥臭味的气体。臭氧不稳定,一旦受热极易转化成氧气(O2),并放出大量的热。臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害。它是一切生命的保护层。雷雨之后空气更清新,这是由于放电时,极少量的氧气可转化为臭氧。
①臭氧的物理性质是(写一条即可)。
②将带火星的木条伸入到盛有O3的集气瓶中,木条(“会”或“不会”)复燃。
③氧气转变成臭氧的过程是(填“物理”或“化学”之一)变化。在此过程中,下列不会发生变化的是(选填下列序号)。
A.原子种类 B.分子种类 C.原子数目
(2)、氢气球中填充的气体是氢气,氢气球能飘上天空体现了氢气的性质是。氢气是一种可燃性气体,燃烧时可观察到火焰呈色。请写出氢气燃烧的文字表达式 , 该反应的基本类型是(填“化合”或“分解”)反应。氢能源作为最环保清洁的能源,原因是。(3)、家中常用的燃料是天然气,主要成分是甲烷(CH4)。甲烷是由甲烷分子构成的。甲烷在氧气中充分燃烧会产生二氧化碳和水,请写出甲烷燃烧的文字表达式;在该反应中发生改变的微粒是。(4)、水银温度计常用于测量人体的体温。水银是汞的俗称,汞在通常状态下是一种液态金属。从微观角度分析水银温度计的工作原理是,当体温升高时, , 从而导致水银温度计的示数上升。(5)、某校开展了2024年“世界水日”“中国水周”主题宣传活动。活动期间,项目小组同学利用自制的简易净水器(如图所示)对水样进行处理。如图所示是用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英沙等材料自制的一个简易净水器。

根据上述净化材料的特性,A层放置的材料最好是 , 这是利用了该物质的性。
-
20、化学是以实验为基础的学科,认识基本实验仪器,掌握基本实验技能。
 (1)、写出仪器的名称:⑧ , ⑨。(2)、选择图中仪器的序号填空:用作少量液体试剂反应容器的是 , 用于搅拌液体的是 , 用于支持和固定仪器的是。(3)、精确量取30mL液体应选量程为(选填“10、20或50”之一)mL 的量筒和(写仪器名称)。(4)、实验室用烧杯加热液体时,底部应垫放 , 目的是防止烧杯 , 导致炸裂。(5)、某同学用酒精灯给试管里的液体加热时,发现试管炸裂,可能原因有_____(选填下列序号)。A、用酒精灯的外焰给试管加热 B、加热前试管外壁水没有擦干 C、没有进行预热,直接加热试管的中下部 D、试管内液体超过试管容积的
(1)、写出仪器的名称:⑧ , ⑨。(2)、选择图中仪器的序号填空:用作少量液体试剂反应容器的是 , 用于搅拌液体的是 , 用于支持和固定仪器的是。(3)、精确量取30mL液体应选量程为(选填“10、20或50”之一)mL 的量筒和(写仪器名称)。(4)、实验室用烧杯加热液体时,底部应垫放 , 目的是防止烧杯 , 导致炸裂。(5)、某同学用酒精灯给试管里的液体加热时,发现试管炸裂,可能原因有_____(选填下列序号)。A、用酒精灯的外焰给试管加热 B、加热前试管外壁水没有擦干 C、没有进行预热,直接加热试管的中下部 D、试管内液体超过试管容积的