相关试卷
-
1、下列化学方程式与基本反应类型完全正确的是A、 分解反应 B、 化合反应 C、 分解反应 D、 置换反应
-
2、下列关于空气中各成分的说法正确的是A、空气中氧气的质量分数约为21% B、、、都是大气污染物 C、酥脆的饼干在空气中放置一段时间不脆了,是因为空气中含有氧气 D、空气中的稀有气体在通电时能发出不同颜色的光,常用于霓虹灯
-
3、用微粒的观点解释下列现象或事实,不合理的是A、酒精挥发——分子大小发生改变 B、过氧化氢分解——分子本身发生了改变 C、墙内开花墙外香——分子在不停运动 D、一氧化碳和二氧化碳化学性质不同——分子构成不同
-
4、取少量下列物质分别放入足量水中,充分搅拌后能形成溶液的是A、面粉 B、蔗糖 C、大理石 D、芝麻油
-
5、地壳中含量最多的元素是A、铁元素 B、铝元素 C、氧元素 D、硅元素
-
6、正确的实验操作是实验成功的关键。下列基本实验操作正确的是A、读取液体体积
 B、滴加液体
B、滴加液体 C、检查装置气密性
C、检查装置气密性 D、连接仪器
D、连接仪器
-
7、作为生活常识,我们应该知道一些特殊的符号。下列标志属于禁止吸烟的是A、
 B、
B、 C、
C、 D、
D、
-
8、《天工开物》被誉为“中国17世纪的工艺百科全书”,其中记载的下列工艺涉及化学变化的是A、棉线织布 B、甘蔗榨汁 C、楠木制舟 D、烧制陶瓷
-
9、某校化学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入 13.7g氢氧化钠溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠反应的化学方程式为:NH4NO3+NaOHNaNO3+H2O+NH3↑)。把产生的 NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质量,结果如下表所示:
时间/s
0
20
30
40
60
80
100
120
增加的质量/g
0
0.7
0.9
1.2
1.5
1.6
1.7
1.7
试回答下列问题:
(1)、求硝酸铵样品的纯度为(2)、求反应后所得的硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的质量) -
10、膨松剂在我们的日常饮食中屡见不鲜,小到包子馒头,大到其它的肉类食品,膨松剂的运用十分的广泛。某面包膨松剂由碳酸氢钠和碳酸氢铵一种或两种物质组成,甲同学想对其成分进行检验。查阅资料后,他设计了如图所示的实验装置(实验开始前弹簧夹都处于关闭状态),并分3步进行实验。

资料:①膨松剂在面包制作过程中发生化学反应:2NaHCO3Na2CO3+H2O+CO2↑,NH4HCO3NH3↑+H2O+CO2↑;②氨气溶于水所得溶液为氨水,呈碱性。
实验操作:
第1步:关闭K2 , 打开K1 , 经过加热,D中出现了明显现象。
第2步:关闭K1 , 打开K2 , 加热至试管B中的水里气泡不再产生。
第3步:观察到大试管中还有剩余物质。
根据以上信息回答以下问题:
(1)从“第2步”可知,装置B的作用是。
(2)如果没有装置C,D中可能不会出现什么实验现象?。
(3)写出实验中膨松剂的物质组成:。
-
11、科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考。从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种。为了确定该气体的成分,他们进行了如下探究。
查阅资料:
I.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;
II.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能。
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2 , 把它直接通入澄清石灰水,并观察实验现象。
乙同学认为甲同学的做法不合理。请用化学方程式表示其原因。
(2)同学们设计了一套合理的实验装置,如下图所示(铁架台已略去)。请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水,氢氧化钠溶液,酸性高锰酸钾溶液,浓硫酸,无水硫酸铜,碱石灰 (假设每步反应都是完全的)

①写出E装置中试剂的名称或化学式。
②若观察到(填装置序号)中澄清石灰水变浑浊, 证明原气体中有CO2;
③若观察到现象, 证明原气体中有H2无CO。
-
12、金属在生产生活中得到广泛应用,(1)、铁制品生锈对生活中影响较大,可用稀盐酸清除铁锈,写出清除铁锈的化学方程式:;(2)、现有两种金属单质组成的混合物,向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示,下列说法不正确的原是_________
 A、若混合物为Zn、Al,则m可能是0.2g B、若混合物为Zn、Cu,则m=0.2g C、若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3% D、若混合物为Fe、Cu,m=0.1g,则该混合物中Fe的质量分数可能是 50%
A、若混合物为Zn、Al,则m可能是0.2g B、若混合物为Zn、Cu,则m=0.2g C、若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3% D、若混合物为Fe、Cu,m=0.1g,则该混合物中Fe的质量分数可能是 50% -
13、将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进实验(Na2CO3 , 受热不分解)
 (1)、A样品中与BaCl2溶液反应的Na2CO3的质量是。(2)、化学式Na2CO3·nH2O中n是。(3)、对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.1%)
(1)、A样品中与BaCl2溶液反应的Na2CO3的质量是。(2)、化学式Na2CO3·nH2O中n是。(3)、对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.1%) -
14、某溶液含有Cu(NO3)2和AgNO3 , 现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示。下列说法不正确的是
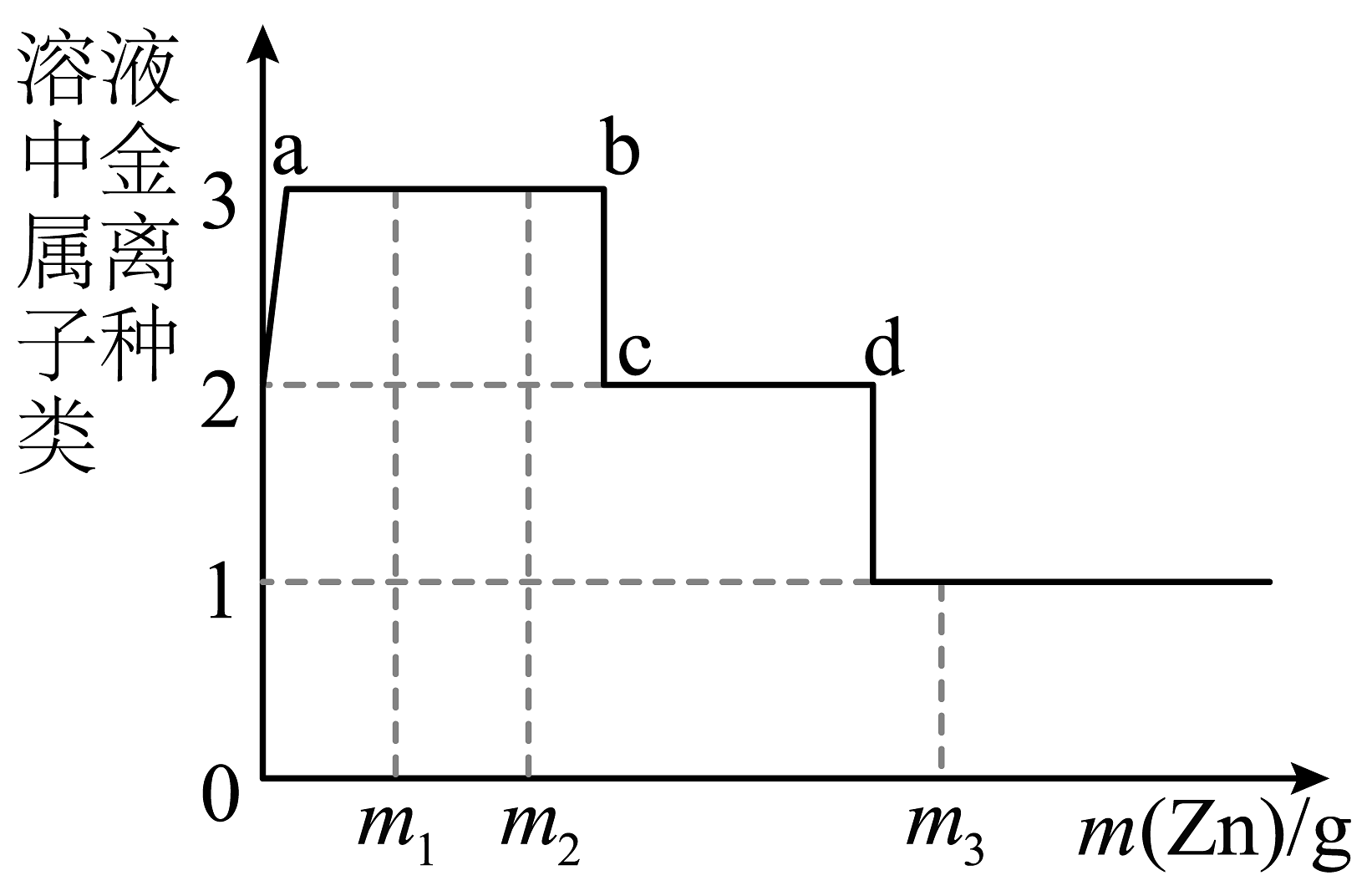 A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等
A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等 -
15、甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是
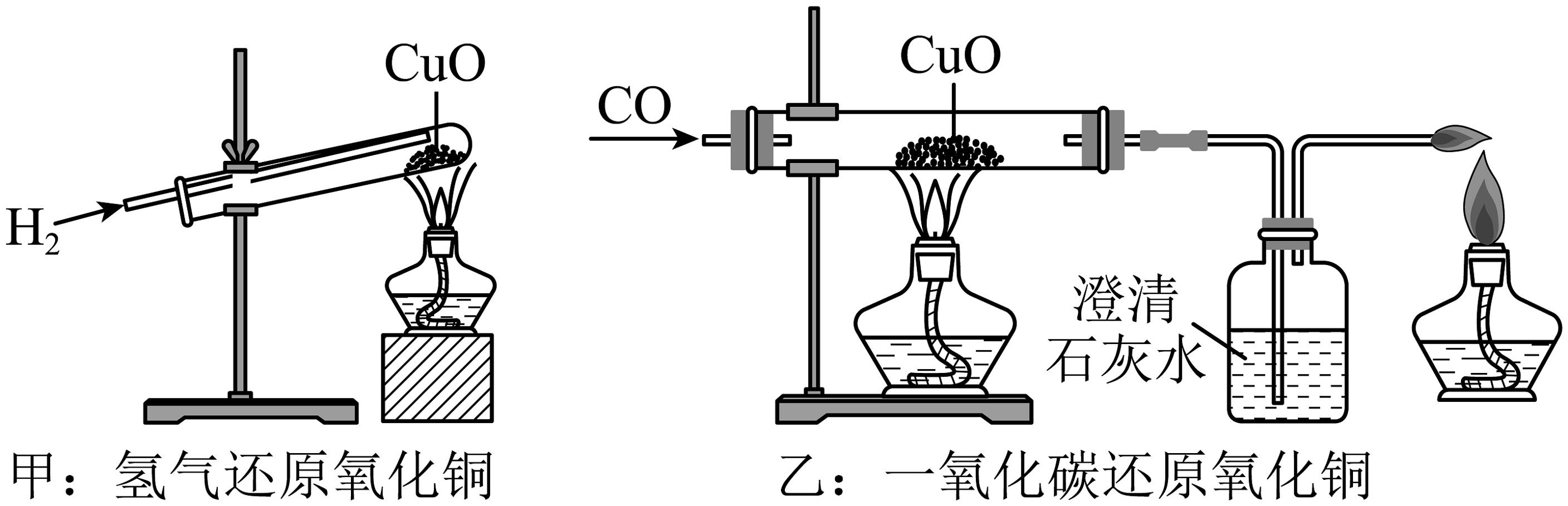 A、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲实验试管口向下倾斜可防止反应生成的水倒流
A、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲实验试管口向下倾斜可防止反应生成的水倒流 -
16、在托盘天平两边各放上一个盛有36.5克浓度为20%盐酸的烧杯,调节天平至平衡。现将各一定量的两种物质分别放入两烧杯中,都恰好完全反应,此时天平仍保持平衡,则加入的物质可能是A、MgO和MgCO3 B、Mg和MgCO3 C、MgO和Mg(OH)2 D、MgO和Mg
-
17、将一些氧化铜粉末加入到200克49%的硫酸溶液中,微热至氧化铜全部溶解。再向该蓝色溶液中加入铁粉 80克,充分反应过滤,仍得到干燥后的固体物质56克。求:(1)、原加入的氧化铜质量是多少克?(2)、最后得到的溶液的质量分数是多少?
-
18、将等质量的锌粉和镁粉,分别放入质量相等的19.6%稀硫酸中,当酸过量时生成氢气质量随反应时间变化的曲线如甲图所示,当金属过量时生成氧气质量随反应时间变化的曲线如乙图所示,请回答:
 (1)、下列对于甲乙两图理解的说法正确的是上___________(可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出与锌等量的镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据)。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)
(1)、下列对于甲乙两图理解的说法正确的是上___________(可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出与锌等量的镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据)。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)
-
19、在相同温度和相同体积的条件下,气体压强(p)与气体分子数目(n)成正比关系(p=kn)。若ag碳和 bg 氧气放入一密闭容器中,测得容器内的气体压强为p,然后,提供一定条件使容器内的物质发生充分反应,待温度复原时,得容器的气体压强仍然为p,则a与b的关系为。
-
20、将含有不溶性物质的硝酸钾固体的混合物放入一定量的水中充分搅拌,得到的实验数据如下:
表1:
温度/℃
20
40
60
剩余固体质量/g
136.8
72.2
20
表2:
温度/℃
20
30
40
50
60
70
80
溶解度/g
31.6
45.8
63.9
85.5
110
138
169
试计算:
(1)、原固体混合物中硝酸钾的质量是g。(2)、加入水的质量是g。