相关试卷
-
1、下列反应中,属于化合反应的是A、 B、氢氧化钙+盐酸→氯化钙+水 C、碳酸→二氧化碳+水 D、
-
2、下列微粒结构示意图,表示阴离子的是A、
 B、
B、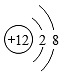 C、
C、 D、
D、
-
3、下列物质含有氧分子的是A、O2 B、H2O2 C、H2CO3 D、CO2
-
4、生活中的下列现象,可用分子的知识加以解释,其中不正确的是A、加热氧化汞可得到金属汞和氧气是因为分子可以再分 B、臭氧和氧气的性质不完全相同,因为它们分子种类不同 C、热胀冷缩是因为分子大小随温度而改变 D、墙内开花墙外香是因为分子在不断运动
-
5、下列物质属于纯净物的是A、过氧化氢溶液 B、五氧化二磷 C、液态空气 D、高锰酸钾受热分解后剩余的固体
-
6、化学反应前后肯定发生变化的是A、原子数目 B、原子种类 C、分子种类 D、元素种类
-
7、下列化学式书写正确的是A、氧化铝 AlO B、碳酸钠 NaCO3 C、氯化铁 FeCl2 D、氧化镁 MgO
-
8、下列方法能鉴别氧气和二氧化碳气体的是A、闻气味 B、观察颜色 C、向集气瓶中加适量水 D、将带火星的木条伸入集气瓶中
-
9、下列不属于氧气用途的是A、气焊 B、光合作用 C、医疗急救 D、火箭助燃剂
-
10、下列物质的用途中,利用其物理性质的是A、氮气用于制氮肥 B、氧气用于炼钢 C、氮气用作保护气 D、液氮用于冷冻手术
-
11、下列物质在氧气中燃烧时,能产生明亮蓝紫色火焰的是A、木条 B、木炭 C、硫 D、铁丝
-
12、将干冷的烧杯罩在蜡烛燃烧的火焰上方,发现烧杯内壁有无色液滴出现;将烧杯正放,向其中倒入少量澄清石灰水,发现石灰水变浑浊。蜡烛在空气中燃烧的产物是A、只有水 B、化为灰烬 C、只有二氧化碳 D、有二氧化碳和水
-
13、最早通过实验测定空气组成的科学家是A、英国汤姆生 B、俄国门捷列夫 C、法国拉瓦锡 D、英国道尔顿
-
14、下列不宜作化学反应容器的仪器是A、烧杯 B、烧瓶 C、试管 D、量筒
-
15、下列配制与使用火药的过程中,主要发生化学变化的是A、精磨配料
 B、称量配料
B、称量配料 C、混合配料
C、混合配料 D、点燃火药
D、点燃火药
-
16、下列物质含金属元素的是A、O2 B、H2O C、Fe3O4 D、P2O5
-
17、下列元素符号书写不正确的是A、硅SI B、硫S C、钠Na D、铜Cu
-
18、锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下。市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效。下图是某葡萄糖酸锌口服液的标签,请根据标签信息回答:
××牌口服液
主要成分:葡萄糖酸锌
化学是:
每只口服液含葡萄糖酸锌45.5mg
××制药厂
(1)、锌缺乏容易造成发育障碍。其中锌缺乏中的“锌”是指(选填“分子”、“原子”、“单质”或“元素”);(2)、葡萄糖酸锌的相对分子质量是(只写结果);(3)、葡萄糖酸锌中碳元素和氢元素的质量比(填最简整数比);(4)、葡萄糖酸锌中锌元素的质量分数(只写出数学表达式,不需计算结果);(5)、某患者除正常饮食补充锌元素外,还需服用该品牌葡萄糖酸锌口服液。若治疗是一个疗程需补充104mg锌元素,而这些锌有65mg来自该口服液,则患者共需服用支葡萄糖酸锌口服液。 -
19、
某小组以“探究催化剂的奥秘”为题展开了项目式学习。将适量淀粉放入过氧化氢溶液中,过氧化氢溶液的分解速率加快。因此,该小组同学进行了如下探究:
【提出问题】淀粉能否作过氧化氢分解的催化剂?
【做出猜想】淀粉能作过氧化氢分解的催化剂。
【实验验证】
(1)完成下列探究:
实验步骤
实验现象
结论及解释
Ⅰ.

A中无明显现象,B产生大量气泡,带火星木条复燃
B中产生的气体是(填名称)
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣
B中带火星木条又复燃,滤渣质量为g
淀粉的和在反应前后均没有发生变化,能作过氧化氢分解的催化剂
【实验拓展】
(2)设计了如下图所示装置对比淀粉与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关数据见下表:

实验编号
3%过氧化氢溶液的体积
其他物质质量
待测数据
Ⅰ
20mL
淀粉0.5g
a
Ⅱ
20mL
二氧化锰0.5g
b
上述实验中“待测数据”是指;若a>b,则可得出的结论是。
【拓展探究】
(3)催化剂在化工生产中起着重要作用,(选填“能”或“不能”)提高产物产量。
-
20、我国纪念2024年“世界水日”“中国水周”活动主题为“推进地下水超采综合治理、复苏河湖生态环境”。国庆假期,小吉从柴桑河带回一瓶浑浊的河水,在化学实验室模拟自来水厂的净水过程,最终制成蒸馏水,流程如下图所示:
 (1)、操作①的名称为;(2)、操作②,主要是吸附除去一些异味和色素,应选用的物质是;(3)、在上述净化水的方法中,净化程度最高操作的名称是;(4)、上述操作中,最后得到的蒸馏水属于(选填“纯净物”或“混合物”)。
(1)、操作①的名称为;(2)、操作②,主要是吸附除去一些异味和色素,应选用的物质是;(3)、在上述净化水的方法中,净化程度最高操作的名称是;(4)、上述操作中,最后得到的蒸馏水属于(选填“纯净物”或“混合物”)。