相关试卷
-
1、下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
检验自来水是否为硬水
取样,加入活性炭
B
验证质量守恒定律
称量镁燃烧前后的固体质量
C
探究蜡烛中是否含有氢元素
点燃蜡烛,在火焰上方罩一个蘸有澄清石灰水的烧杯
D
除去一瓶水中的难溶性杂质
过滤
A、A B、B C、C D、D -
2、下列说法正确的是A、反应前各物质的质量总和,一定等于反应后生成的各物质的质量总和 B、铁丝在氧气中燃烧后,生成物的质量比参加反应的铁丝的质量增加了 C、水的质量和受热变成水蒸气的质量相等,该变化符合质量守恒定律 D、酒精完全燃烧后,生成的水和二氧化碳的质量之和等于酒精减少的质量
-
3、氢气属于最清洁的燃料。氢气燃烧的化学方程式为 , 从中获得的信息错误的是A、氢气和氧气在点燃的条件下生成水 B、在点燃条件下,2份质量的氢气和1份质量的氧气反应生成2份质量的水 C、反应前后原子的数目不变 D、在点燃条件下,每2个氢分子和1个氧分子反应生成2个水分子
-
4、下列现象不能用质量守恒定律解释的是A、高锰酸钾受热分解后,固体质量减小 B、纸张燃烧后,灰烬的质量比纸张质量小 C、铜粉在空气中加热后,质量增大 D、水结冰后质量保持不变
-
5、现将12gA和12gB混合加热,A完全反应,反应后生成10gC和6gD,则参加反应的A与B的质量比是A、1:1 B、4:3 C、3:1 D、5:2
-
6、质量守恒定律是自然界基本定律之一,最早传播和用文字记载并使人们普遍接受质量守恒定律的科学家是A、拉瓦锡 B、门捷列夫 C、张青莲 D、屠呦呦
-
7、用来判断镁在氧气中燃烧是化学变化的依据的是A、放出大量的热 B、发出耀眼的白光 C、镁条变短 D、生成白色固体
-
8、实验是科学探究的重要途径,下面是测定空气中氧气含量的探究实验。
如图A、B两个实验均可用于空气中氧气含量的测定。用压力传感器测出B实验集气瓶中的气压变化,如图C所示。
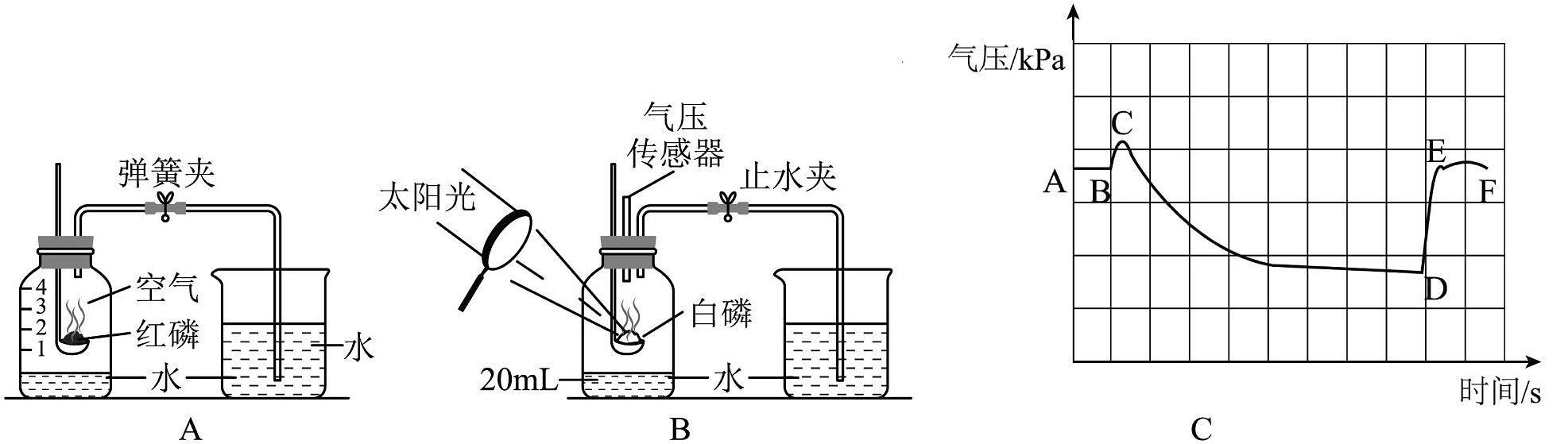 (1)、正确选择试剂是实验成功的关键,对图A实验中对试剂的选择合理的是______(填字母)。A、可以用铁代替红磷进行实验 B、红磷需要足量 C、只与氧气反应(2)、图A实验中,红磷燃烧的现象 , 此反应的文字表达式为。(3)、图B所示实验中,已知广口瓶的容积为220mL,冷却后打开止水夹,水从烧杯流入广口瓶中的体积为39mL,则空气中氧气的体积分数约为。(4)、实验中装置里气压变化如图C所示,CD段气压减小的主要原因是。
(1)、正确选择试剂是实验成功的关键,对图A实验中对试剂的选择合理的是______(填字母)。A、可以用铁代替红磷进行实验 B、红磷需要足量 C、只与氧气反应(2)、图A实验中,红磷燃烧的现象 , 此反应的文字表达式为。(3)、图B所示实验中,已知广口瓶的容积为220mL,冷却后打开止水夹,水从烧杯流入广口瓶中的体积为39mL,则空气中氧气的体积分数约为。(4)、实验中装置里气压变化如图C所示,CD段气压减小的主要原因是。 -
9、为探究氧气的化学性质进行如图实验:
 (1)、实验一瓶内放少量水是吸收二氧化硫,防止污染空气,由此推测二氧化硫的性质是。硫在氧气中燃烧的现象是发出 , 放热,生成有刺激性气味的气体,硫燃烧反应的属于(填基本反应类型)。(2)、实验二瓶内盛有少量水能否用少量细沙代替?答:。铁丝在氧气中剧烈燃烧反应的文字表达式为。(3)、实验三:把红热的木炭插入盛有氧气的集气瓶时,为什么要由瓶口向下缓慢插入?答:。
(1)、实验一瓶内放少量水是吸收二氧化硫,防止污染空气,由此推测二氧化硫的性质是。硫在氧气中燃烧的现象是发出 , 放热,生成有刺激性气味的气体,硫燃烧反应的属于(填基本反应类型)。(2)、实验二瓶内盛有少量水能否用少量细沙代替?答:。铁丝在氧气中剧烈燃烧反应的文字表达式为。(3)、实验三:把红热的木炭插入盛有氧气的集气瓶时,为什么要由瓶口向下缓慢插入?答:。 -
10、实验室现有下列仪器,回答相关问题:
 (1)、填仪器名称:a , c。(2)、实验室用高锰酸钾为原料制取氧气
(1)、填仪器名称:a , c。(2)、实验室用高锰酸钾为原料制取氧气①反应的文字表达为。
②组装发生装置时,除了上图所示的仪器外,还需要补充的仪器是。组装好发生装置后应该先再装入药品,然后在试管口内放一团棉花,以防止。
③选用c、d、e、g等四种仪器组成的装置收集氧气是因为氧气。用此装置收集气体时,如果产生气泡就立即收集,则收集到的气体(填“纯”或“不纯”)。
-
11、元素周期表是学习和研究化学的重要工具,根据如表回答有关问题。
族
周期
IA
0
1H
1.008
IIA
IIIA
IVA
VA
VIA
VIIA
2He
4.003
2
3Li
6.941
4Be
9.012
5B
10.81
6C
12.01
7N
14.01
8O
16.00
9F
19.00
10Ne
20.18
3
11Na
22.99
12Mg
24.31
13Al
26.98
14Si
28.09
15P
30.97
16S
32.06
17Cl
35.45
18Ar
39.95
(1)、第2周期第IA族元素符号是。在第2周期中属于稀有气体元素的是 , 该元素化学性质稳定的原因是。碳、氧元素最本质的区别是。(2)、硅原子的质子数为 , 它的相对原子质量是。(3)、如图是某原子结构示意图,它的最外层电子数是 , 在化学反应中该原子容易(填“得”或“失”)电子。 (4)、在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是______(填标号)。A、He和Ne B、C和Si C、Al和Mg D、O和Cl(5)、食盐的主要成分是氯化钠,其所含的阳离子是(写符号,下同),某带2个单位负电荷的阴离子与Ar的核外电子排布相同,该阴离子为。
(4)、在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是______(填标号)。A、He和Ne B、C和Si C、Al和Mg D、O和Cl(5)、食盐的主要成分是氯化钠,其所含的阳离子是(写符号,下同),某带2个单位负电荷的阴离子与Ar的核外电子排布相同,该阴离子为。 -
12、请阅读“科学史话——水的组成揭秘”,回答下列问题。
科学史话
水的组成揭秘
18世纪末,英国化学家普里斯特利(J。Priestley,1733—1804)把“易燃空气”和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁出现了液滴。
(1)、人们对水的组成的认识经历了相当长的时间。①普利斯特的研究中,“易燃空气”实际上是。
②请写出“易燃空气”与空气混合后点火所发生的反应的文字表达式:。
(2)、在电解水实验中,与正、负两极相连的玻璃管上方产生的气体体积比为。(3)、电解水的文字表达式为 , 在此反应中发生变化的微粒是(填“氧原子”、“氢原子”或“水分子”)。(4)、在水的净化实验中,过滤可以去除水中的(“可溶性”或“不溶性”)杂质,实验室过滤时要用到的玻璃仪器:漏斗、玻璃棒和 , 其中玻璃棒的作用是。(5)、生活中节约用水的方法有(写一条即可)。 -
13、如图所示的是课本中的一些实验,回答问题。
 (1)、图1实验,从微观角度,水的沸腾过程从液态水变成气态水,水分子之间的距离将(填“变大”或“变小”)。(2)、图2说明石蜡在约60℃的热水中熔化,所表现出来的性质属于(填“物理”或“化学”)性质。(3)、图3实验:硫酸铜溶液呈色,滴入氢氧化钠溶液后可观察到的现象是 , 加热上述反应后生成的物质,又可观察到的现象是。(4)、图4实验:观察到澄清石灰水变浑浊,说明大理石与稀盐酸反应生成的物质有。
(1)、图1实验,从微观角度,水的沸腾过程从液态水变成气态水,水分子之间的距离将(填“变大”或“变小”)。(2)、图2说明石蜡在约60℃的热水中熔化,所表现出来的性质属于(填“物理”或“化学”)性质。(3)、图3实验:硫酸铜溶液呈色,滴入氢氧化钠溶液后可观察到的现象是 , 加热上述反应后生成的物质,又可观察到的现象是。(4)、图4实验:观察到澄清石灰水变浑浊,说明大理石与稀盐酸反应生成的物质有。 -
14、下列各图中
 和
和 分别表示不同元素的原子,则其中表示混合物的是 , 表示纯净物的是 , 表示单质的是 , 表示化合物的是。
分别表示不同元素的原子,则其中表示混合物的是 , 表示纯净物的是 , 表示单质的是 , 表示化合物的是。
-
15、学化学更聪明,为区别或鉴别下列物质,填写有关空白。(1)、区别氧气和二氧化碳等两瓶无色气体:将分别伸入集气瓶,如果复燃,则是氧气。(2)、鉴别水和酒精两种无色液体:各取少量,分别 , 如果能燃烧,则是。(3)、区别水和过氧化氢溶液:各取少量,分别加入二氧化锰,如果 , 则是过氧化氢溶液,写出有关反应的文字表示式。
-
16、2024年9月11日,中国自主研发的朱雀三号可重复使用垂直回收火箭取得重大突破,该火箭使用液氧、甲烷做推进剂。下列关于甲烷(CH4)说法正确的是A、甲烷由5个原子构成 B、甲烷由碳、氢元素组成 C、甲烷中碳原子与氢原子个数比为1∶3 D、每个甲烷分子中有2个氢分子
-
17、氢气在氯气中燃烧生成氯化氢,反应的示意图如图,有关说法正确的是
 A、该反应属于分解反应 B、反应前后原子种类发生了变化 C、氢气、氯气与氯化氢的化学性质不同 D、甲表示为2H、乙表示为2Cl、丙表示为H2Cl2
A、该反应属于分解反应 B、反应前后原子种类发生了变化 C、氢气、氯气与氯化氢的化学性质不同 D、甲表示为2H、乙表示为2Cl、丙表示为H2Cl2 -
18、化学用语是国际通用的化学语言,下列说法正确的是A、2个氧分子:O2 B、铜元素:cu C、氢离子:H+ D、四氧化三铁:Fe2O3
-
19、铁对人体至关重要,主要作用包括促进血红蛋白合成、骨骼发育和免疫功能。下列关于铁元素的说法错误的是
 A、铁属于金属元素 B、铁的原子序数为26 C、铁在化学反应中容易失去电子 D、铁的相对原子质量为55.85g
A、铁属于金属元素 B、铁的原子序数为26 C、铁在化学反应中容易失去电子 D、铁的相对原子质量为55.85g -
20、汽油属于危险化学品,在运输汽油的车辆上应该张贴的警示标志是A、
 B、
B、 C、
C、 D、
D、