相关试卷
-
1、下列说法正确的是A、空气中氮气的质量分数为78% B、在房间里放一盆水可以防止煤气中毒 C、地壳中含量最高的元素是氧元素 D、防止金属腐蚀是保护金属资源的唯一途径
-
2、用如图装置进行电解水实验,下列说法正确的是
 A、实验目的是探究水的组成 B、水中加入NaOH作为催化剂 C、正负两极产生气体的质量比为2:1 D、负极产生的气体可以使带火星的木条复燃
A、实验目的是探究水的组成 B、水中加入NaOH作为催化剂 C、正负两极产生气体的质量比为2:1 D、负极产生的气体可以使带火星的木条复燃 -
3、下列保护水资源的措施中,不合理的是A、公共厕所使用节水龙头 B、用淘米后的水浇花 C、给农作物浇水采用喷灌 D、工业污水直接排放
-
4、下列自来水生产过程,属于化学变化的是A、静置沉降 B、砂池过滤 C、投药消毒 D、送水到家
-
5、铊是一种无色、无臭的剧毒金属,其在元素周期表中的信息如图下列关于铊的说法正确的是
 A、元素符号为TL B、原子的核外电子数为81 C、1个铊原子的质量为204.4 D、原子核内的中子数为204
A、元素符号为TL B、原子的核外电子数为81 C、1个铊原子的质量为204.4 D、原子核内的中子数为204 -
6、正确选择实验试剂和仪器,并能安全操作是一项基本的实验技能。在进行“石蜡的熔化”实验时,需要注意
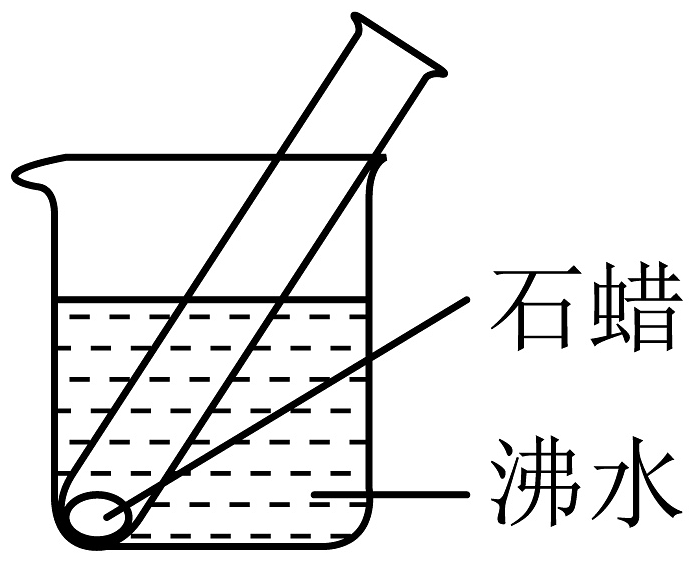 A、
A、 排风
B、
排风
B、 用电
C、
用电
C、 锐器
D、
锐器
D、 热烫
热烫
-
7、翻译《化学鉴原》并创造出氢、氧、钠等化学元素汉语名称的我国近代化学先驱是A、徐寿 B、门捷列夫 C、屠呦呦 D、拉瓦锡
-
8、实验室用锌粒和稀硫酸制取氢气,装置如图1.产生氢气的质量与反应时间的关系如图2所示。
 (1)、实验室制取氢气时,先检查装置的 , 后装入药品。(2)、实验结束后,共制得氢气g。(3)、计算消耗锌粒的质量。
(1)、实验室制取氢气时,先检查装置的 , 后装入药品。(2)、实验结束后,共制得氢气g。(3)、计算消耗锌粒的质量。 -
9、
钢铁是使用最多的金属材料。某校化学小组的同学在老师指导下进行以下有关铁的项目式学习。
项目一:探究铁丝的燃烧

(1)如图是铁丝在氧气中燃烧的实验,实验现象为铁丝剧烈燃烧, , 放出大量热。
(2)实验前,向集气瓶底放少量水的作用是。
项目二:探究铁生锈的条件
【实验内容】
取3段光亮无锈的铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。一段时间后,发现实验③中铁丝生锈。

【实验分析】
(3)该实验创新之处在于:可根据铁丝表面的铁锈和两种现象来判断铁丝反应进行的情况。
(4)通过对比实验(填序号),说明铁生锈的条件之一是铁要与水接触。
【实验结论】
铁生锈实际上是铁与水和氧气发生反应的结果。
【拓展探究】兴趣小组的同学用控制变量法进行如图实验:

(5)一段时间后观察到烧杯内左侧导管液面(填“高于”或“低于”)右侧导管液面,证明食盐水可以加快铁生锈的反应速率。
项目三:探究用铁粉脱氧剂测定空气中氧气的体积分数
【查阅资料】脱氧剂利用铁粉与氧气发生缓慢氧化生锈而除去氧气,达到食品防腐的目的,铁粉脱氧剂中的其他成分对后面的实验无影响。
【进行实验】实验1和实验2分别用红磷燃烧和铁粉生锈的方法测定空气中氧气的体积分数。连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图甲、乙所示。

(6)实验2进行至30min后,待集气瓶冷却至室温,打开K,烧杯中的水能倒吸入集气瓶的原因是。
(7)依据图甲、乙中的信息,(填“实验1”或“实验2”)的测定方法更准确。
(8)若要寻找红磷或铁粉脱氧剂的替代物来测定空气中氧气的体积分数,该替代物应满足的条件是(写两点)。
-
10、如图是实验室常见的气体制取装置。
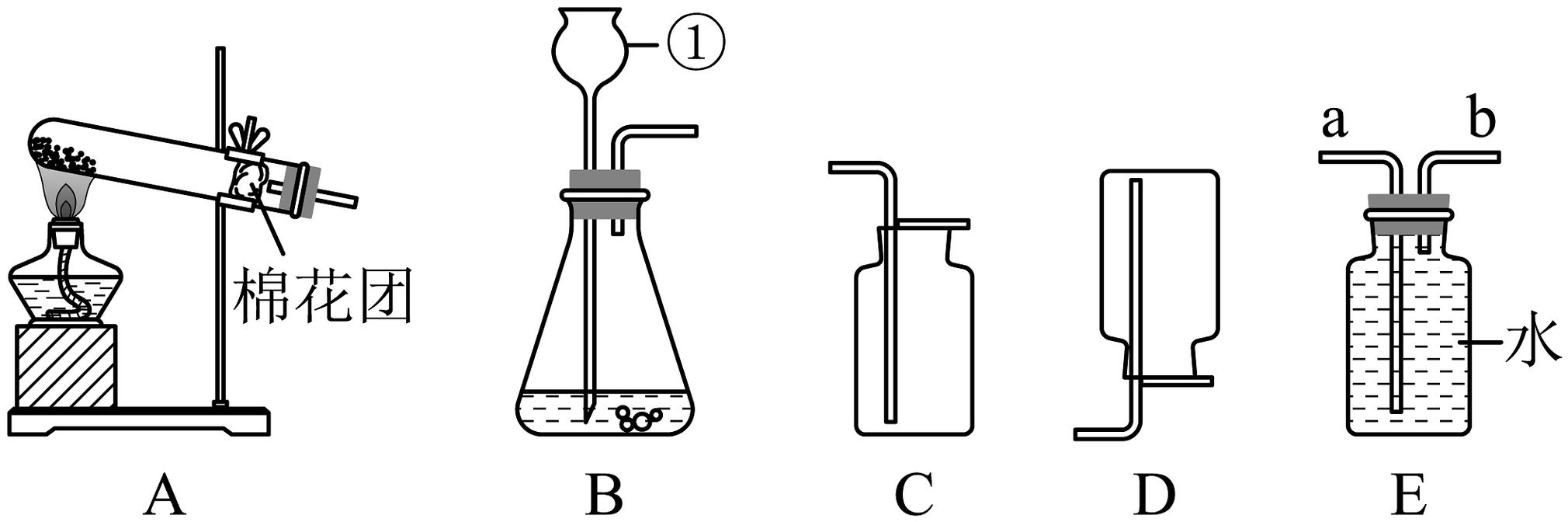 (1)、实验室制取一瓶二氧化碳,应选用的发生装置是(填字母);发生反应的化学方程式为。(2)、用装置E收集氧气时,气体应从(填“a”或“b”)端进入。(3)、如图为“简易制氧机”简图,下列说法不正确的是_____(填字母)。
(1)、实验室制取一瓶二氧化碳,应选用的发生装置是(填字母);发生反应的化学方程式为。(2)、用装置E收集氧气时,气体应从(填“a”或“b”)端进入。(3)、如图为“简易制氧机”简图,下列说法不正确的是_____(填字母)。 A、甲剂和乙剂可能为过氧化氢溶液和二氧化锰 B、通过洗气室中的水可观察输出氧气的速率 C、制取氧气过程中洗气室压强减小
A、甲剂和乙剂可能为过氧化氢溶液和二氧化锰 B、通过洗气室中的水可观察输出氧气的速率 C、制取氧气过程中洗气室压强减小 -
11、为探究锌、铁、铜三种金属的活动性及它们和氢元素的位置关系,小西设计如下实验:
 (1)、试管C中发生反应的化学方程式为。(2)、小莉认为省略上述实验中的(填字母),也能达到实验目的。(3)、上述反应中,溶液的质量比反应前增大的是(填字母)。
(1)、试管C中发生反应的化学方程式为。(2)、小莉认为省略上述实验中的(填字母),也能达到实验目的。(3)、上述反应中,溶液的质量比反应前增大的是(填字母)。 -
12、化学实验小组设计如下实验来验证质量守恒定律。
 (1)、B、C实验中,反应前后天平保持平衡,小明认为两个实验均能验证质量守恒定律。小明的观点(填“正确”或“不正确”)。(2)、A实验中天平不平衡的原因是(用化学方程式解释)。(3)、小明思考后,将A实验天平左盘中的反应装置进行了改进,如图D所示。并重新做了实验,但天平依旧不平衡。若整个操作过程中无差错,则造成上述实验误差的原因是。
(1)、B、C实验中,反应前后天平保持平衡,小明认为两个实验均能验证质量守恒定律。小明的观点(填“正确”或“不正确”)。(2)、A实验中天平不平衡的原因是(用化学方程式解释)。(3)、小明思考后,将A实验天平左盘中的反应装置进行了改进,如图D所示。并重新做了实验,但天平依旧不平衡。若整个操作过程中无差错,则造成上述实验误差的原因是。 -
13、下列为验证二氧化碳性质的两个实验。
 (1)、甲中进行实验时,先关闭K1和K2 , 加热c,一段时间后,再通入CO2 , 观察到b,d中纸花均不变色。
(1)、甲中进行实验时,先关闭K1和K2 , 加热c,一段时间后,再通入CO2 , 观察到b,d中纸花均不变色。①b中纸花不变色说明了;
②再打开K2 , 观察到 , 由此证明了CO2能与水反应。
③若打开K1 , 还可以证明CO2具有的性质是。
(2)、乙中将二氧化碳通入澄清石灰水中,观察到澄清石灰水变浑浊,写出发生反应的化学方程式。 -
14、水是一种重要的资源。根据所学知识,请回答下列问题。
 (1)、图1为电解水的实验,通电一段时间后,a、b两管收集到的气体体积比约为。(2)、切断电源,用燃着的木条分别检验两个玻璃管中的气体,观察到(填“a”或“b”)中气体能被点燃。(3)、此实验可证明水是由组成的。(4)、图2是电解水的微观反应过程,为使图B表达完整,应补充下图中的(填序号)。
(1)、图1为电解水的实验,通电一段时间后,a、b两管收集到的气体体积比约为。(2)、切断电源,用燃着的木条分别检验两个玻璃管中的气体,观察到(填“a”或“b”)中气体能被点燃。(3)、此实验可证明水是由组成的。(4)、图2是电解水的微观反应过程,为使图B表达完整,应补充下图中的(填序号)。
-
15、中国古人从自然万物、天地四时中发现了色彩,又赋予它们雅致动听的名字。缃叶、桃红、群青、沉香……这满庭芳的国色中也包含独特的化学内涵。(1)、缃叶,本身指淡黄色的叶子,是桑叶初生的色泽。桑蚕丝织锦的过程中,发生的是(填“化学”或“物理”)变化。(2)、桃红:由银朱和赭石调合而成,银朱是硫黄与汞加热制成的硫化汞(HgS),已知HgS中S元素的化合价为-2,则Hg元素的化合价为。(3)、群青,中国画传统颜料色,来自于青金石。青金石是指碱性铝硅酸盐矿物,其中含Na、Al、Si、S、Cl、O等元素,这些元素中属于金属元素的有(填元素名称)。(4)、沉香:树脂与木质的融合物。沉香木受到外伤刺激后,会大量分泌树脂帮助愈合,过程中产生浓郁香气,我们通常能闻到香味是因为分子。
-
16、如图是某品牌矿泉水标签的部分内容。
XX矿泉水
净含量:500mL
配料表:纯净水 硫酸镁 氯化钾
主要成分:钾1.0~27.3mg/L
镁0.1~4.8mg/L
(1)、2个氯原子的化学符号为。(2)、中“2+”的含义是。(3)、中“2”的含义是。 -
17、某兴趣小组探究物质燃烧的条件,装置如图所示(已知:白磷的着火点为40℃,红磷的着火点为240℃)。

步骤①:先将一定量的白磷、红磷分别浸入80℃热水中;
步骤②:升高右侧漏斗至红磷露出水面;
步骤③:升高左侧漏斗至白磷露出水面。
下列说法正确的是
A、白磷燃烧时产生大量白雾,放出热量 B、步骤②中可观察到红磷燃烧 C、步骤①中白磷不燃烧,③中白磷燃烧,对比①③可得物质燃烧的条件之一是与氧气接触 D、80℃热水的作用只是隔绝氧气 -
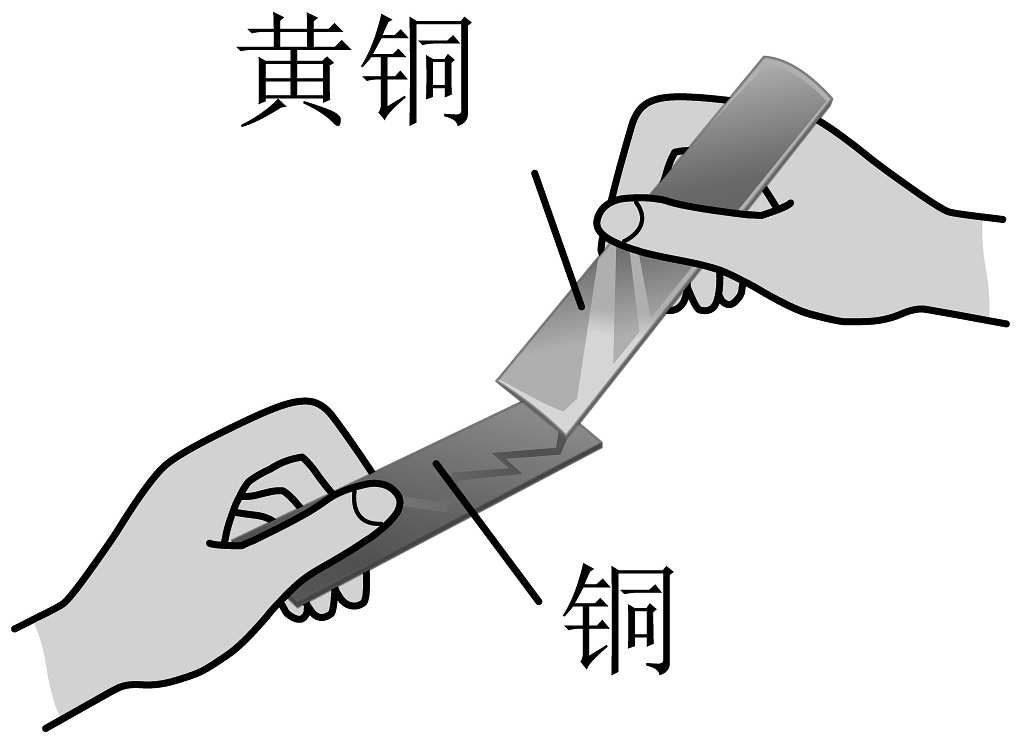
18、下列实验方案不能达到相应实验目的的是
实验方案

实验目的
A.比较合金的硬度
B.证明石墨具有导电性
实验方案


实验目的
C.探究二氧化锰的催化作用
D.除去中的CO气体
A、A B、B C、C D、D -
19、火箭发射过程中,某反应的微观示意图如下,下列说法正确的是
 A、物质甲中N、O元素的质量比为1∶2 B、该反应为分解反应 C、反应过程中分子和原子种类都发生改变 D、参加反应的甲和乙的分子个数比为1∶2
A、物质甲中N、O元素的质量比为1∶2 B、该反应为分解反应 C、反应过程中分子和原子种类都发生改变 D、参加反应的甲和乙的分子个数比为1∶2 -
20、为了保障野外工作人员的用水安全,便携净水器的设计有重要意义。小组同学自制如图所示便携式净水器。下列说法正确的是
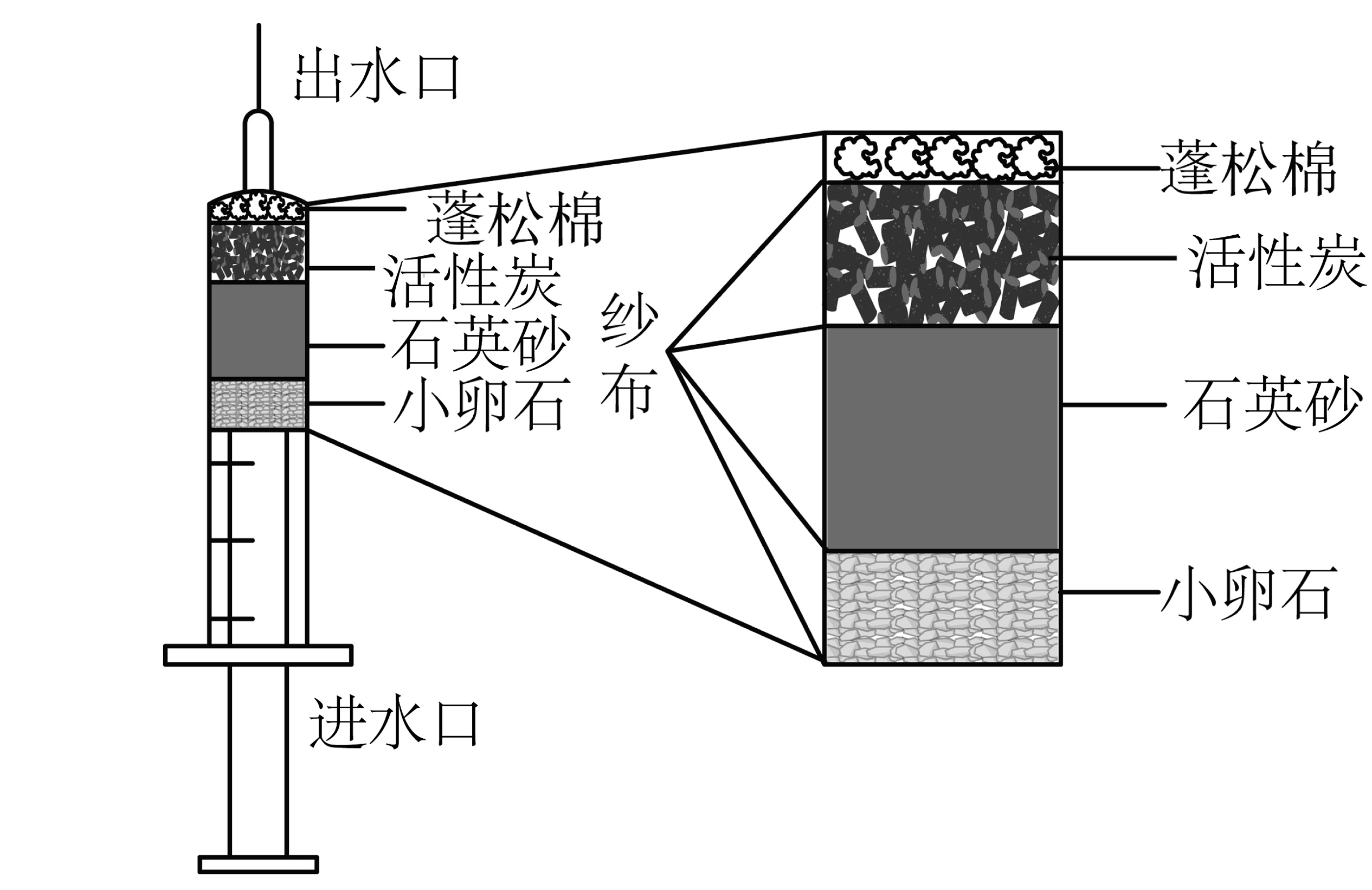 A、该装置能除去河水中的所有杂质 B、活性炭能吸附水中的色素和异味 C、该装置净化后的水为纯净物 D、石英砂和活性炭互换位置,净水效果相同
A、该装置能除去河水中的所有杂质 B、活性炭能吸附水中的色素和异味 C、该装置净化后的水为纯净物 D、石英砂和活性炭互换位置,净水效果相同