相关试卷
- 广东省广州市白云区钟落潭2025-2026学年九年级上学期11月期中联考化学试题
- 四川省甘孜州、阿坝州2025年初中化学中考真题
- 四川省内江市隆昌市知行中学2025-2026学年九年级上学期第一次核心素养测试化学试题
- 广东省梅州宪梓中学2025-2026学年九年级上学期第一次月考试化学试卷
- 广东省广州中学2025-2026学年九年级上学期10月阶段性测试化学试卷
- 广东省珠海市文园中学2025-2026学年九年级上学期第一次月考化学试卷
- 四川省甘孜州、阿坝州2024年中考化学真题
- 山东省日照市2025年化学中考试卷
- 广东省广州市番禺区华南碧桂园学校2025-2026学年九年级上学期化学11月期中考试试卷
- 四川省绵阳市游仙区2025-2026学年九年级上学期化学11月期中考试试卷
-
1、实验是学习化学的重要方法,下列有关实验现象描述正确的是A、红磷在空气中燃烧:发出黄光,生成大量的白色烟雾 B、细铁丝在空气中燃烧:火星四射,生成黑色固体 C、一氧化碳还原氧化铁:固体粉末由红色变黑色 D、铁片加入稀盐酸中,产生少量气泡,溶液变成黄色
-
2、下列实验操作正确的是A、
 B、
B、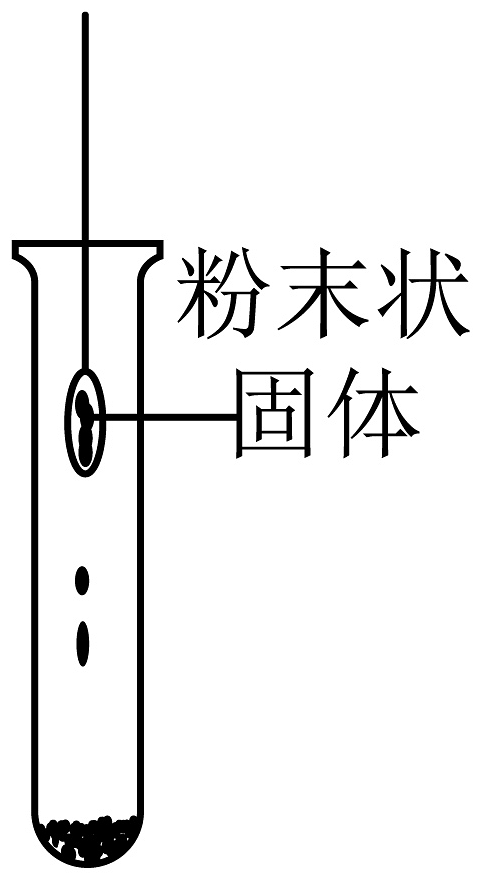 C、
C、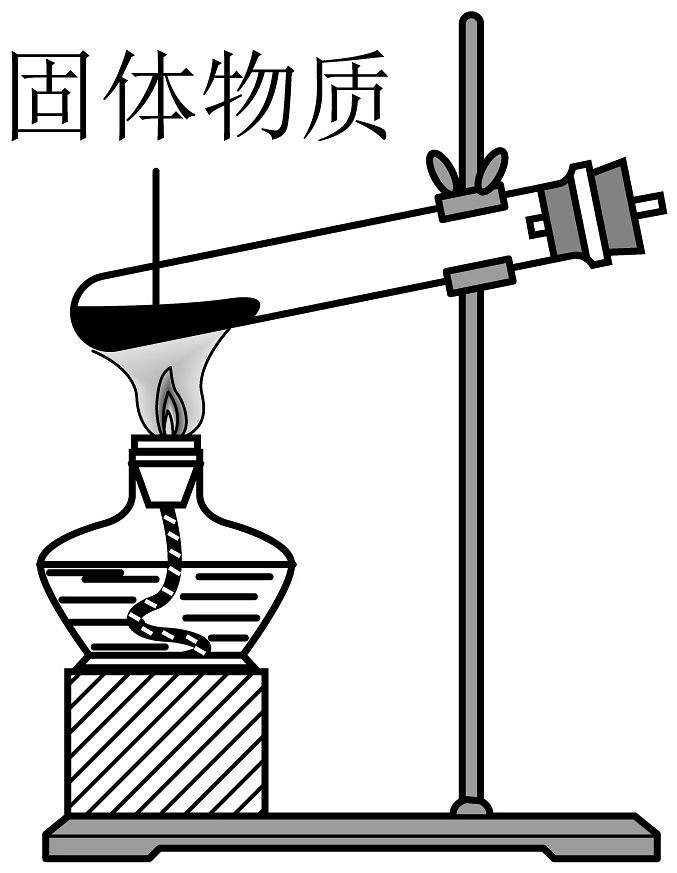 D、
D、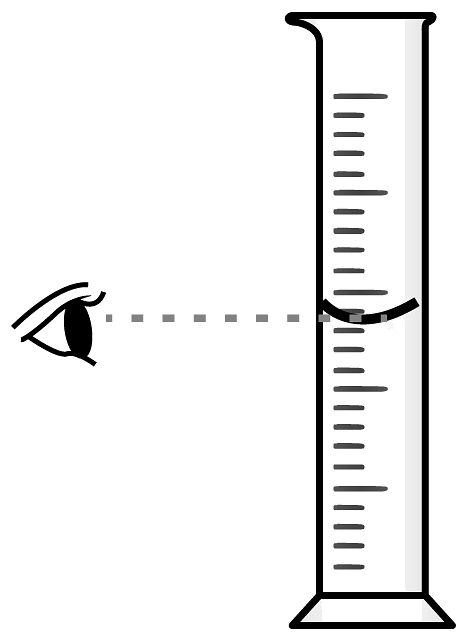
-
3、化学与生活有着紧密的联系,以下厨房物品的叙述中只发生物理变化的是A、铁刀:我生锈了 B、食醋:我挥发了 C、天然气:我燃烧了 D、苹果:我被氧化了
-
4、在降温和加压下,氧气变为液态氧,其原因是A、分子大小发生变化 B、分子间距离减小 C、分子的质量发生了变化 D、分子改变了
-
5、铝的用途广泛。如图是元素周期表中铝元素的相关信息,下列说法错误的是
 A、铝原子质子数为13 B、铝元素属于金属元素 C、铝原子在化学反应中易失3个电子形成 D、铝元素的相对原子质量为26.98g
A、铝原子质子数为13 B、铝元素属于金属元素 C、铝原子在化学反应中易失3个电子形成 D、铝元素的相对原子质量为26.98g -
6、从古至今,钢铁及其铁的化合物一直被人类广泛应用。
 (1)、①《梦溪笔谈》记载南北朝时“灌钢”法:将生铁液注入熟铁中快速炼钢。生铁与钢的区别是不同。
(1)、①《梦溪笔谈》记载南北朝时“灌钢”法:将生铁液注入熟铁中快速炼钢。生铁与钢的区别是不同。②《梦溪笔谈》记载“熬胆矾铁釜久亦化为铜”(胆矾为晶体),用化学方程式表示其原理。
③“釜”指生铁制作的铁锅,利用铁的(选填序号之一)。
A.导热性 B.导电性 C.硬度大
(2)、化学兴趣小组的同学为确定某铁合金样品是生铁还是钢,他们取23g铁合金样品盛放到锥形瓶中,将100g稀硫酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据(假设铁合金样品中只含有铁、碳两种元素)。实验数据整理如表所示:次数
第1次
第2次
第3次
第4次
第5次
加入稀硫酸的质量
20
20
20
20
20
瓶中物质总质量
42.8
m
82.4
102.2
122.2
请回答下列问题:
①实验室若要用的浓硫酸配制100g质量分数为硫酸,所需要水的质量为g。
②表格中的m的值为。
③通过计算判断该铁合金样品是生铁还是钢。(请写出计算过程,结果精确到)(生铁含碳量为 , 钢含碳量为)
-
7、酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。(1)、从微观实质角度探究酸和碱的反应。
在宏观—微观—符号之间建立联系,是化学科特有的思维方式,能帮助我们认识物质变化的本质。中和反应的微观实质是氢离子和氢氧根离子结合生成了水分子,。像这种用实际参加反应的离子符号来表示化学反应的式子叫离子方程式,离子反应遵守质量守恒定律。

①如图甲,和反应前后没有发生变化的微粒是(填微粒符号);请从微粒的角度解释该反应的实质。
②如图乙,是溶液和稀盐酸反应的微观示意图,该反应的离子方程式是。
(2)、从溶液电导率变化角度探究酸和碱的反应
小组同学根据图2进行相应实验操作,利用电导率传感器分别测定A试管和B试管反应过程中溶液的电导率变化,电导率的大小能反映离子浓度的大小。
①A试管中反应的化学方程式为;试管B中(填“有”或“无”)明显现象。
②表示A试管中溶液电导率变化的是(填“图3”或“图4”)。
③图4中电导率的变化(填“能”或“不能”)说明酸和碱发生了反应。
(3)、化学小组的同学欲探究固体混合物A的成分,已知A中可能含有、、()五种物质中的两种或多种。分别取一定量固体混合物A,按如图所示进行探究实验,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全反应)
请根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
①无色气体E(填化学式)。
②写出步骤I中发生反应的一个化学方程式。
③在无色滤液F中,一定大量存在的酸根阴离子是(填离子符号)。
④根据上述实验现象推断,在固体混合物A中一定不存在的物质是(写化学式),还无法确定的物质是(写化学式)。若要通过实验判断该成分是否存在,可取适量白色沉淀G,进行探究。请写出实验操作的步骤、现象及结论。
-
8、如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列化学实验。
 (1)、阳光小组同学以锌粒和稀硫酸为原料制备并收集一瓶干燥的氢气。
(1)、阳光小组同学以锌粒和稀硫酸为原料制备并收集一瓶干燥的氢气。①所选仪器的连接顺序为(从左到右填写装置字母序号)。
②该反应的化学方程式为。
③实验结束后,该组同学欲利用化学方法检验反应后的剩余废液中是否含有稀硫酸,可选用下列试剂中的(填选项序号)。
A.溶液 B.溶液 C.酚酞试液 D.石蕊试液
(2)、鹏飞小组的同学对甲烷燃烧的产物产生了兴趣,设计了如下实验探究。【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素的物质完全燃烧生成 , 不完全燃烧生成CO;白色无水粉末遇水变蓝色。
【猜想与假设】猜想一:;猜想二:;猜想三:。
【实验探究】将甲烷在一定量的纯净氧气中燃烧的产物依次通过装置(部分夹持、固定装置省略)进行验证:

①若实验过程中观察到A中白色粉末变为蓝色,C、F中澄清石灰水变浑浊,E中黑色粉末变成红色,由此推断猜想成立。
②该组装置中,装置C的作用是。
③从安全角度考虑,气球的作用是。
④实验结束,对相关装置进行称量(忽略空气成分对实验的干扰)反应前后各装置的质量变化如表所示:
AB装置总质量
CD装置总质量
E装置中固体质量
反应前
800
600
4
反应后
807.2
604.4
3.2
根据表格中数据计算,燃烧甲烷的质量为。气球中剩余未反应的CO的质量为。(计算结果精确至0.1g)
-
9、能源是人类文明发展进步的基石和先决条件。(1)、①可燃冰的主要成分是甲烷,甲烷在空气中燃烧的化学方程式为。可燃冰被科学家誉为“未来能源”“21世纪能源”,从环保的角度原因是。
②锂有“21世纪能源金属”的美誉。锂在元素周期表中的信息及其原子结构示意图如图所示,由此可推测锂元素在化合物中通常显价。氢氧化锂可作吸收剂除去二氧化碳,并生成碳酸锂和水,此反应的化学方程式为。
 (2)、海洋是人类的巨大资源宝库,从海水中可以得到重要化工原料NaCl和。和KCl的溶解度曲线如图所示,试回答下列问题:
(2)、海洋是人类的巨大资源宝库,从海水中可以得到重要化工原料NaCl和。和KCl的溶解度曲线如图所示,试回答下列问题:
①以NaCl为原料制取纯碱 , 从元素守恒的观点来看,还需要补充两种元素(填写元素符号)。
②在时,将30gKCl固体加入50g水中,用玻璃棒充分搅拌后所得溶液为(填“饱和溶液”“不饱和溶液”之一),溶液中溶质与溶液的质量比为(填写最简整数比)。
③在时,分别取40gNaCl和KCl固体,分别加水至固体完全溶解,配制成饱和溶液,然后升温至 , 此时所得NaCl溶液的溶质质量分数KCl溶液的溶质质量分数(填“小于”“等于”“大于”“无法判断”之一)。
-
10、我国氢能研制一直走在世界前列。由化石能源制得的氢气被称为“灰氢”,如甲烷水蒸气催化重整是制高纯“灰氢”的方法之一(如图1),流程中用CaO吸收时,体积分数和CaO消耗率随时间变化关系如图2,电解水制得的氢气被称为“绿氢”,其中一种方法如图3。下列说法正确的是
 A、图1,甲烷水蒸气催化重整的化学方程式为 B、图2,从起,体积分数降低 C、图3,理论上每生成 , 就能得到 D、图3,连接 , 可以制得
A、图1,甲烷水蒸气催化重整的化学方程式为 B、图2,从起,体积分数降低 C、图3,理论上每生成 , 就能得到 D、图3,连接 , 可以制得 -
11、某粗盐样品中除含有不溶性固体杂质外,还可能含有少量氯化镁、氯化钙、硫酸钠。某化学兴趣小组开展如下探究活动。
探究一:除去粗盐中不溶性杂质
探究二:从滤液1中提取氯化钠固体(该探究中,微溶物不沉淀)


关于以上探究活动,有下列说法:
①试剂甲是碳酸钠溶液,试剂乙是氯化钡溶液;
②滤液1中的溶质一定有氯化钠、氯化钙;
③若向探究二所得的白色滤渣中加入过量的稀盐酸,滤渣部分溶解;
④向滤液4中加入适量的试剂丙时有中和反应发生。
上述说法中正确的个数是
A、1个 B、2个 C、3个 D、4个 -
12、铁生锈的原理能用于制作“暖宝宝”。某“暖宝宝”的成分为铁粉、蛭石(保温作用)和吸水性树脂、食盐、活性炭。探究小组利用如图装置进行探究,实验结果如图。下列说法错误的是
 A、“暖宝宝”发热原理是Fe粉与、反应 B、由浓度变化推测,Fe粉可用作食品脱氧剂 C、封装“暖宝宝”的外包装袋应选透水、透气的材料 D、“暖宝宝”能快速放热,铁钉生锈需较长时间,说明反应物表面积能影响反应速率
A、“暖宝宝”发热原理是Fe粉与、反应 B、由浓度变化推测,Fe粉可用作食品脱氧剂 C、封装“暖宝宝”的外包装袋应选透水、透气的材料 D、“暖宝宝”能快速放热,铁钉生锈需较长时间,说明反应物表面积能影响反应速率 -
13、某同学在验证次氯酸(HClO)光照分解产物数字实验中,HClO所发生反应的化学方程式为 , 氯水的pH和容器中的体积分数随时间变化的情况如图所示,下列说法错误的是
 A、反应过程中,氯水的pH不断减小 B、光照前,容器内已有 C、反应前后氯元素的化合价不变 D、该实验说明HClO化学性质不稳定
A、反应过程中,氯水的pH不断减小 B、光照前,容器内已有 C、反应前后氯元素的化合价不变 D、该实验说明HClO化学性质不稳定 -
14、已知某无色溶液X是NaOH溶液和稀硫酸两者之一,甲和乙分别是溶液、无色酚酞试溶液中的各一种。取两等份无色溶液X,分别向其中加入适量的甲、乙两种试剂,产生的现象如下表所示。则依据实验现象做出的下列推断中,不合理的是
加入试剂
甲
乙
实验现象
无明显现象
产生沉淀
A、溶液X一定是NaOH B、甲为无色酚酞试液 C、乙中产生的沉淀是盐的一种 D、乙一定是溶液 -
15、今年12月2日,我国“嫦娥三号”月球探测器在西昌成功发射,其重要部件太阳能帆板使用的高纯硅制备原理是:该反应中x的值及四氯硅烷()中硅元素的化合价分别为A、价 B、价 C、价 D、价
-
16、中国居民平衡膳食餐盘及建议每天摄入量如图所示。下列说法错误的是
 A、摄入谷薯可以为人体提供能量 B、鱼肉蛋豆能提供蛋白质 C、为了减肥,应该只吃蔬菜 D、人体缺乏维生素C,易患坏血病
A、摄入谷薯可以为人体提供能量 B、鱼肉蛋豆能提供蛋白质 C、为了减肥,应该只吃蔬菜 D、人体缺乏维生素C,易患坏血病 -
17、学生实验考查时,以下同学的实验操作正确的是




A.滴管取用溶液
B.检查气密性
C.氢气验纯
D.量取9.5mL液体
A、A B、B C、C D、D -
18、
将过量的溶液滴入到一定量溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究,请完成下列各题:
(一)猜想与假设:
(1)猜想一:固体为 , 理由:(用化学反应方程式表示)。
猜想二:固体为。
猜想三:固体为和的混合物。
(二)资料查阅:
①和晶体均不带结晶水;
②、受热均易分解。
(三)设计与实验:
I.固体的获取:
(2)①将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
②判断固体已洗净的方法及现象。
Ⅱ.用如图所示装置,定性探究固体的成分。

(3)若用装置A、B组合进行实验,B中无现象,则猜想正确;
(4)小组同学将装置按A、(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:现象为。
结论:固体为和的混合物。
Ⅲ.固体成分定量测定:
已知的分解温度为 , 的分解温度为。设固体的组成为。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,请根据图示回答下列问题:

(5)写出CD段发生反应的化学方程式:CD段:
(6)通过计算可得:
(7)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:。
-
19、工业上以菱铁矿石(FeCO3 , 含少量SiO2)为原料,通过酸浸、沉铁、焙烧等步骤可制取Fe粉。(1)、酸浸:将菱铁矿石粉碎后加入稀硫酸溶液中,充分反应后过滤。
①反应时有大量气体产生,该气体的主要成分是(填化学式)。
②充分反应后过滤,所得滤渣的主要成分是。
(2)、沉铁:向“酸浸”过程所得的滤液中加入(NH4)2CO3溶液,升温至60℃,在本溶液中开始分解。搅拌,充分反应后过滤。①反应过程中有白色沉淀(FeCO3)生成。写出该反应的化学方程式:。
②“沉铁”过程中若反应温度过高,会导致Fe粉的产率下降,原因是。
(3)、焙烧:将“沉铁”过程所得的FeCO3固体洗净烘干后,与炭粉混合后焙烧,充分反应后得Fe粉。①培烧过程中主要发生3个反应:
Ⅰ、
Ⅱ、
Ⅲ、。
②焙烧过程中,向FeCO3与炭粉的混合物中添加适量的CaCO3 , Fe粉产率随焙烧时间的变化如图。添加适量CaCO3可提高铁粉产率,原因是。
 (4)、所得的Fe粉中常含有少量的单质碳。为了测定Fe粉中碳的质量分数,取10gFe粉在纯氧中完全燃烧,得到0.11gCO2。求此铁粉中碳的质量分数。(写出解题过程)
(4)、所得的Fe粉中常含有少量的单质碳。为了测定Fe粉中碳的质量分数,取10gFe粉在纯氧中完全燃烧,得到0.11gCO2。求此铁粉中碳的质量分数。(写出解题过程) -
20、阅读下面文章。
太阳能是清洁的可再生能源,昼夜、季节及天气等因素对持续、稳定地利用太阳能有较大影响。
储能是解决上述问题的重要途径。目前,储热体系受到广泛关注,其工作原理如图1所示。在脱水反应器中,将太阳能以化学能的形式存储起来:需要能量时,水合反应器中发生反应释放热量。
除储热体系外,科研人员对其它体系也进行了研究。图2列举了几种储热体系的储热密度(单位质量储热材料的储热量),它们的反应原理可表示为:A→B+C,吸热;B+C→A,放热。这些储热体系均借助物质相互转化来实现能量的存储和释放。

回答下列问题。
(1)、依据图1回答:①图中参与循环的元素共种。
②脱水反应器中发生反应,该反应属于(填基本反应类型)。
③液态水在进入水合反应器前需加热变成水蒸气,此过程中,(从微观角度分析);水合反应器中能转化为热能。
(2)、依据图2数据可知,储热体系受到广泛关注的原因为。(3)、如下表各选项与文中储热体系反应原理相符的是(填字母)。标号
吸热反应
放热反应
A
B
C
(4)、为构建清洁低碳的新能源体系,下列措施合理的有___________(填字母)。A、大力发展燃煤发电 B、积极推广太阳能发电 C、为新能源研发新型储能技术