相关试卷
- 四川省甘孜州、阿坝州2025年初中化学中考真题
- 四川省内江市隆昌市知行中学2025-2026学年九年级上学期第一次核心素养测试化学试题
- 广东省梅州宪梓中学2025-2026学年九年级上学期第一次月考试化学试卷
- 广东省广州中学2025-2026学年九年级上学期10月阶段性测试化学试卷
- 广东省珠海市文园中学2025-2026学年九年级上学期第一次月考化学试卷
- 四川省甘孜州、阿坝州2024年中考化学真题
- 山东省日照市2025年化学中考试卷
- 广东省广州市番禺区华南碧桂园学校2025-2026学年九年级上学期化学11月期中考试试卷
- 四川省绵阳市游仙区2025-2026学年九年级上学期化学11月期中考试试卷
- 广东省深圳市部分学校2025-2026学年九年级上学期化学期中考试试卷
-
1、计划将于2026年发射嫦娥七号,其主要任务是在月球南极着陆,开展飞跃探测,并寻找水冰资源。完成下面小题。(1)、嫦娥七号发射过程中涉及化学变化的是A、火箭点火发射 B、一级火箭分离 C、整流罩脱落 D、轨道舱帆板展开(2)、月球南极蕴藏着丰富的氦-3,是一种理想的核聚变发电燃料。氦-3原子核由2个质子和1个中子构成,下列关于氦-3原子的说法正确的是A、核外电子数为3 B、原子结构示意图为
 C、核电荷数为2
D、相对原子质量为2
(3)、月球上富含水冰资源,下列有关说法正确的是A、水变成冰后,水分子停止运动 B、天然水经活性炭吸附后净化为纯水 C、电解水时正极一端产生氢气 D、水冰可以转化为饮用水、氧气等,能减少对地球资源的依赖
C、核电荷数为2
D、相对原子质量为2
(3)、月球上富含水冰资源,下列有关说法正确的是A、水变成冰后,水分子停止运动 B、天然水经活性炭吸附后净化为纯水 C、电解水时正极一端产生氢气 D、水冰可以转化为饮用水、氧气等,能减少对地球资源的依赖 -
2、
成华区某化学兴趣小组分别从不同角度“可视化”探究酸碱中和反应。
(1)用浓盐酸和蒸馏水配制实验所需盐酸,不需要使用的是________(填序号)。
①胶头滴管 ②量筒 ③烧杯 ④托盘天平 ⑤玻璃棒
【探究一】利用指示剂证明
(2)向滴有酚酞的溶液中滴加稀盐酸,观察到的现象________。某同学认为该现象不能证明酸碱发生了中和反应,她又补充实验:________,证明酸碱发生了中和反应。
【探究二】从能量变化的角度证明

(3)用图1装置进行实验,用温度传感器测出溶液温度变化如图2中曲线a所示;把溶液B换成蒸馏水重复上述实验,得到图2中曲线b。第二次实验的目的________。
【探究三】从有新物质生成的角度证明
(4)向溶液中滴加稀盐酸,取反应后少量溶液于一支试管,先加入足量稀硝酸,再加入溶液,产生白色沉淀,________(填“能”或“不能”)证明酸和碱发生反应。
【探究四】从变化的角度证明
(5)用如图1所示装置探究溶液和稀盐酸的反应,并用传感器测得烧杯中溶液的随滴加液体体积的变化如图3所示。下列说法正确的是________。
A. 溶液B是溶液 B. b点时,加入的A、B溶液体积相等 C. 、、三点溶液中,的质量一定相等 D. 点点反应的化学方程式: 【探究五】从电导率变化的角度证明
(6)电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内离子数)成正比。如图1,向盐酸中滴加离子浓度相同的溶液,测得溶液电导率变化如图4。

①段电导率下降的原因________;
②段电导率上升的原因________。
【反思总结】
(7)从微观角度认识中和反应的实质,按图5中反应物比例关系,在图6中画出反应后的微观示意图。

-
3、二十大报告指出:发展海洋经济,保护海洋生态环境,加快建设海洋强国。(1)、某工厂对海水综合利用的部分工艺流程图(部分过程和产物省略),回答问题。

①海水晒盐:过滤粗盐中难溶性杂质需用到的玻璃仪器有:烧杯、。
②海水制镁:在用卤水制镁的过程中,电解氯化镁除得到金属镁外,还可得到的另一种单质为(填化学式)。
③海水制“碱”:侯氏制碱()法的原理:反应。则x的化学式为。
(2)、海底“未来能源”——可燃冰,是一种甲烷水合物。与煤作燃料对比,可燃冰作燃料的优点:。(3)、海洋中蕴含丰富的水资源,膜分离技术是淡化海水的一种方法。如图,对淡化膜右侧海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的其他离子不能通过淡化膜,从而得到淡水。对加压后右侧海水(未析出晶体)成分变化分析不正确的是________(填字母)。 A、溶质质量不变 B、溶质质量分数变大 C、溶剂质量不变 D、溶液质量不变(4)、某同学在“海洋资源的综合利用”的实践活动中制得、、物质,查阅资料,它们的溶解度曲线如图。
A、溶质质量不变 B、溶质质量分数变大 C、溶剂质量不变 D、溶液质量不变(4)、某同学在“海洋资源的综合利用”的实践活动中制得、、物质,查阅资料,它们的溶解度曲线如图。
①40℃时,把加入水中,得到的溶液是(填“饱和”或“不饱和”)溶液。
②将70℃时,质量相等的三种物质的饱和溶液均降温到40℃,析出晶体最多的是(填“”“”“”或“不确定”)。
-
4、利用如图装置制备 , 并对其性质进行探究。
 (1)、仪器X的名称是。(2)、气密性检查:关闭a,打开b,缓慢抽拉空的注射器,当D中时,表明气密性良好。(3)、制备并探究的性质:
(1)、仪器X的名称是。(2)、气密性检查:关闭a,打开b,缓慢抽拉空的注射器,当D中时,表明气密性良好。(3)、制备并探究的性质:①打开a,关闭b,推动装有稀盐酸的注射器活塞,一段时间后,发现A中低蜡烛先熄灭,高蜡烛后熄灭,说明。
②然后打开b,关闭a,点燃C装置中酒精喷灯,在实验过程中,仪器X的作用。
③为证明C装置中未完全反应,试剂Y可能是(写一种),对应的化学反应方程式是。
-
5、请回答下列问题。(1)、盐酸、硫酸、是初中常见三大强酸。请画出硫原子的原子结构示意图。打开浓盐酸的试剂瓶瓶盖后观察到的现象。(2)、用(填仪器名称)测得某浓度硫酸的。(3)、为确定实验室某瓶盐酸中溶质的质量分数是否与标签标示相符,某同学利用此盐酸与大理石反应(杂质不参与反应,忽略的挥发)进行实验,数据记录如下表所示。
反应前物质的质量
充分反应后剩余物的总质量
盐酸
大理石(足量)
53.0
6.0
56.8

通过列方程式计算,确定该盐酸中溶质的质量分数是否与标签相符。
-
6、
I.追寻古蜀文化,游学三星堆遗址。

(1)三星堆青铜面具的主要成分是(填:“纯铜”或者“铜锡合金”)。
(2)铜的质子数:。
(3)青铜面具表面绿色锈斑的主要成分碱式碳酸铜【】,易溶于稀盐酸,请写出与盐酸反应的化学方程式:。
II.《天工开物》记载我国古代炼铁工艺,现代高炉炼铁如图所示。

(4)图中涉及到的基本反应类型有 , 炼铁的主要原理是与氧化铁反应,与电子数相同的分子。(填分子式)
(5)高炉炼铁的原料有赤铁矿石、、石灰石和空气,石灰石的作用。
-
7、下列实验能达到相应目的的是A、
 验证浓硫酸的腐蚀性
B、
验证浓硫酸的腐蚀性
B、 浓盐酸具有挥发性
C、
浓盐酸具有挥发性
C、 比较合金与其组分金属的硬度
D、
比较合金与其组分金属的硬度
D、 验证质量守恒
验证质量守恒
-
8、甲、乙、丙、丁是初中化学常见的物质,在一定条件下它们之间的转化关系如图所示。下列推断中正确的是
 A、甲和丙一定不能反应 B、甲、乙、丙、丁不可能含有同一种元素 C、若丙、丁分别为盐和水,则该反应一定是中和反应 D、若甲为 , 丁为 , 则乙可能为单质、氧化物、碱
A、甲和丙一定不能反应 B、甲、乙、丙、丁不可能含有同一种元素 C、若丙、丁分别为盐和水,则该反应一定是中和反应 D、若甲为 , 丁为 , 则乙可能为单质、氧化物、碱 -
9、天宫空间站中采用催化剂净化和 , 微观反应过程如图。下列说法正确的是
 A、催化剂只能加快反应速率 B、反应前后元素种类改变 C、生成的水可以被空间站回收利用 D、参加反应的两种分子个数比为
A、催化剂只能加快反应速率 B、反应前后元素种类改变 C、生成的水可以被空间站回收利用 D、参加反应的两种分子个数比为 -
10、把50g质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸,需要水的质量A、 B、 C、 D、
-
11、下列化学用语及描述正确的是A、分子中氧原子的化合价:-2价 B、锌元素符号: C、的化学名称:盐酸 D、氦气分子:
-
12、分类是化学学习中常用的思维方法,下列有关物质分类正确的是A、金属矿物:磁铁矿、 铝土矿 、软锰矿 B、碱:烧碱、 石灰石 、氢氧化铜 C、混合物:合金 、冰水混合物 、稀硝酸 D、酸碱指示剂:石蕊 、酚酞 、肥皂水
-
13、氧气的制取和性质实验如图。下列说法中正确的是
 A、发生装置仅由药品状态决定 B、该装置能收集到干燥的氧气 C、红热木炭应迅速伸入集气瓶瓶底 D、制取氧气的原料一定含有氧元素
A、发生装置仅由药品状态决定 B、该装置能收集到干燥的氧气 C、红热木炭应迅速伸入集气瓶瓶底 D、制取氧气的原料一定含有氧元素 -
14、下列说法正确的是A、均一、稳定的液体一定是溶液 B、溶液是均一稳定的混合物 C、长期放置后不会分层的液体一定是溶液 D、溶液一定是无色的
-
15、下列有关实验操作正确的是A、在人群聚集的地方做易燃易爆危险实验 B、直接喝实验室的盐酸试剂补充胃酸 C、倾倒液体时,瓶口紧挨试管口缓慢倾倒 D、向燃着的酒精灯中直接添加酒精
-
16、在水溶液中,金属活动性最弱的是A、 B、 C、 D、
-
17、科普阅读
北京冬奥会期间,近千辆氢燃料电池大巴车参与服务。氢燃料电池系统包括电堆、氢气供应系统、氧气供应系统等。氢气和氧气通过在电堆中发生化学反应,实现能量转化。氢燃料电池效率高,发电效率达到80%以上。随着氢燃料电池汽车的广泛使用,氢能产业链也得到长足发展。
氢的储运是氢能产业链中的瓶颈问题。目前,储氢技术有了新的发展,其中金属氢化物储氢是把氢以氢化物的形式储存在金属或合金中。如图为一些储氢材料的质量储氢密度(储氢后氢元素在储氢材料中的质量分数)。
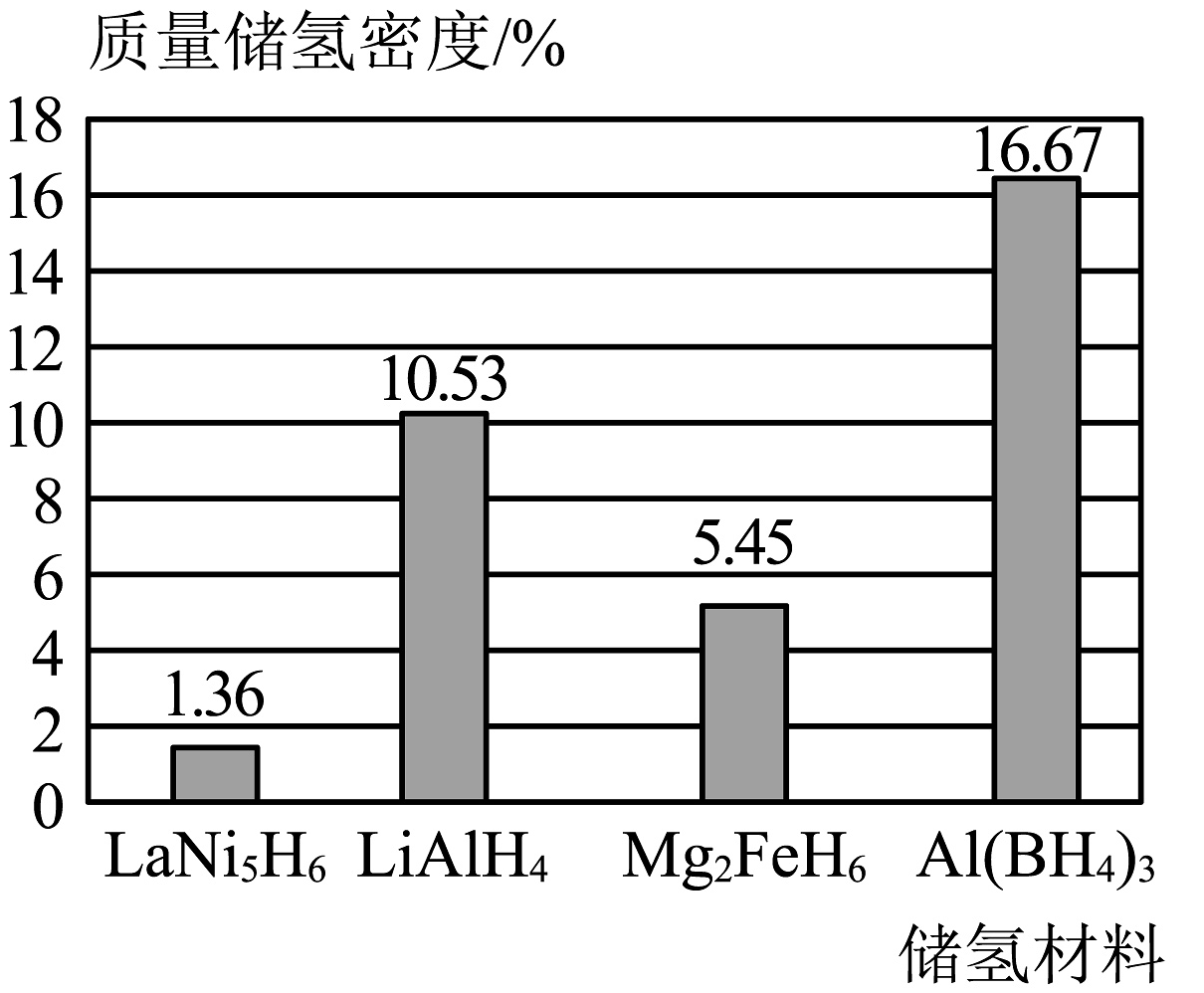 (1)、氢燃料电池的能量转化形式是。(2)、结合图示,储氢材料中最理想的是。(3)、氢燃料电池具有广阔应用前景的依据是(写一条即可)。
(1)、氢燃料电池的能量转化形式是。(2)、结合图示,储氢材料中最理想的是。(3)、氢燃料电池具有广阔应用前景的依据是(写一条即可)。 -
18、2025年“两会”国务院总理李强的政府工作报告提出:“单位国内生产总值能耗降低3%左右,生态环境质量持续改善”。下列做法能持续改善生态环境质量的是A、大量施用农药,减少作物病虫害 B、直接排放工厂废气,降低生产成本 C、推广使用脱硫煤,减少酸雨的产生 D、焚烧垃圾,保持环境干净整洁
-
19、我国航天重大工程取得了一系列辉煌成就,展示了人类探索未知的勇气和智慧。

请回答下列问题:
(1)、古代“火箭”推进剂为黑火药(由木炭、硫、硝酸钾按一定比例混合),黑火药属于(填“纯净物”或“混合物”)。反应的主要原理为:S+2KNO3+3CK2S+N2↑+3CO2↑,该过程可能产生CO的原因是(用化学方程式表示)。(2)、甲烷是清洁燃料之一,朱雀二号火箭中甲烷燃烧的化学方程式为:CH4+2O2CO2+2H2O。计算:①甲烷中氢元素的质量分数为。
②要使8t甲烷完全燃烧,理论上需要液氧的质量是多少(根据化学方程式写出计算过程)。
(3)、偏二甲肼与四氧化二氮反应的化学方程式为C2H8N2+2N2O42CO2↑+3N2↑+4H2O,反应能推进火箭升空的原因主要是。 -
20、以废旧铅酸蓄电池的铜帽(主要含有Cu、Zn,忽略其他杂质)为原料,回收Cu并制备ZnO,主要工序如下。
 (1)、电池一端采用铜帽制作,主要是因为铜有良好的性。(2)、“反应器1”:铜与稀硫酸、过氧化氢溶液反应,生成硫酸铜和水的化学方程式为。(3)、“反应器2”:加入足量锌粉的主要目的是(用化学方程式表示),该反应属于(填基本反应类型)。该过程可能会产生的气体为(写化学式)。(4)、黄铜片(铜锌合金)与纯铜片除了物理方法鉴别外,还可用(填试剂名称)溶液鉴别。(5)、废旧金属的回收意义是。
(1)、电池一端采用铜帽制作,主要是因为铜有良好的性。(2)、“反应器1”:铜与稀硫酸、过氧化氢溶液反应,生成硫酸铜和水的化学方程式为。(3)、“反应器2”:加入足量锌粉的主要目的是(用化学方程式表示),该反应属于(填基本反应类型)。该过程可能会产生的气体为(写化学式)。(4)、黄铜片(铜锌合金)与纯铜片除了物理方法鉴别外,还可用(填试剂名称)溶液鉴别。(5)、废旧金属的回收意义是。