相关试卷
-
1、某小组同学进行如下实验探究沉淀转化:
①向20mL0.1mol·L-1Na2CO3溶液中滴加20mL0.1mol·L-1BaCl2溶液,得浊液Ⅰ;
②向浊液Ⅰ中继续滴加20mL0.1mol·L-1Na2SO4溶液,充分振荡,得浊液Ⅱ;
③将浊液Ⅱ过滤,向滤渣中加入过量盐酸产生气体,过滤、洗涤、干燥,测得剩余固体a的质量大于0.233g。
下列说法不正确的是( )
A、Na2CO3溶液显碱性的原因: B、固体a的成分为BaSO4 C、c(Ba2+)大小关系:浊液Ⅰ<浊液Ⅱ D、由该实验可以推断 -
2、基于水煤气转化反应 , 通过电化学装置制备纯氢的原理示意如下。下列说法不正确的是( )
 A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气
A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气 -
3、一定温度下,在2L的恒容密闭容器中,“甲烷重整”反应()原理如下。

已知“甲烷重整”反应在不同温度下的化学平衡常数:
温度/℃
850
1000
1200
1400
K
0.5
2
275
1772
下列说法不正确的是( )
A、物质a可能是Fe3O4 B、若增大的值,则CH4的平衡转化率降低 C、 D、1000℃,若容器中、 , 则反应处于平衡状态 -
4、根据下列实验操作和现象所得结论正确的是( )
选项
实验操作
现象
结论
A
将 Cl₂通入品红溶液
溶液红色褪去
Cl₂具有漂白性
B
向某溶液中滴加几滴氯水,再滴加KSCN溶液
溶液变红
原溶液中有Fe2+
C
向Ca(ClO)2溶液中通入SO2气体
有沉淀生成
酸性:H2SO3>HClO
D
向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液
沉淀均溶解
Al(OH)3是两性氢氧化物,Al 表现一定的非金属性
A、A B、B C、C D、D -
5、下列实验能达到实验目的的是( )
A
B
C
D
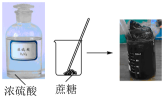

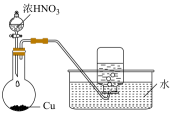
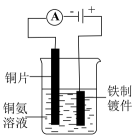
验证浓硫酸具有脱水性
配制100 mL一定物质的量浓度的溶液
制备并收集NO2
铁件镀铜
A、A B、B C、C D、D -
6、下列事实与水解反应无关的是( )A、常温下相同浓度溶液的pH大小:Na2S(aq)>(NH4)2S(aq) B、纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 C、除去工业废水中的Hg2+:向废水中加入FeS固体 D、配制FeCl3溶液:将FeCl3固体溶于浓盐酸,再稀释至所需浓度
-
7、下列反应的方程式不正确的是( )A、C和浓H2SO4反应: B、NH3的催化氧化反应: C、向氢硫酸中通入SO2: D、向FeBr2溶液中通入足量Cl2:
-
8、金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( )
 A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变
A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变 -
9、下列应用中未涉及氧化还原反应的是( )A、将过氧化钠置于呼吸面具中供氧 B、将明矾置于浑浊的水中净水 C、将漂白粉置于水中漂白衣物 D、将覆铜板置于氯化铁溶液中制作电路板
-
10、核污染水中含有38Sr、55Cs等多种放射性同位素粒子,会对人体和环境产生危害。下列说法不正确的是( )A、含有的中子比质子多27个 B、Sr位于元素周期表第五周期、第ⅡA族 C、可用沉淀法或离子交换法去除核污染水中的 D、借助元素周期表比较可知Sr的金属性比Cs强
-
11、下列化学用语或图示表达不正确的是( )A、基态S原子的最外层电子轨道表示式:
 B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型:
B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型: D、Cl2分子中σ键的形成:
D、Cl2分子中σ键的形成:
-
12、我国科学家首次合成大面积全碳纳米材料——石墨炔,其结构与石墨类似,可用于制备储锂电极材料。下列关于石墨炔的说法不正确的是( )
 A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能
A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能 -
13、实验室用浓盐酸、二氧化锰共热制氯气,并用氯气制取氯酸钾、次氯酸钠,并验证氯水的性质。

 (1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水
(1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;写出制取次氯酸钠的反应方程式 ,
比较制取次氯酸钠和氯酸钾的反应条件,试总结两条差异:
① ②。
(4)、④的试管中加有紫色石蕊试液,实验过程中可观察到的现象是 , 导致该现象的相应微粒为。(5)、反应完毕冷却后,②的试管中有大量晶体析出,图二中符合该晶体溶解度随温度变化规律的曲线是(选填字母);从②的试管中分离该晶体的操作是(填写实验操作名称)。(6)、含氯消毒剂的消毒效果用有效氯表示,有效氯指的是与浓盐酸反应产生Cl2的质量与原消毒液质量的比值。计算10% NaClO溶液的有效氯(保留三位小数)。(7)、传统工业电解饱和食盐水所得的烧碱中往往混有食盐,若要检验其中混有氯离子,简述实验方法、现象和结论。 -
14、某种胃药的止酸剂为碳酸钙(说明书规格为每克含碳酸钙620mg),某同学查阅测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①分别配制250mL 0.100mol·L-1稀盐酸和0.100mol·L-1 NaOH溶液;
②取一粒药片(0.100g)研碎后加入20.0mL蒸馏水;
③加入25.00mL 0.100mol·L-1稀盐酸,搅拌,充分反应;
④用0.100mol·L-1 NaOH溶液中和剩余的盐酸,用去NaOH溶液体积为V mL。
请回答下列问题:
(1)、配制NaOH溶液需要的主要玻璃仪器除了烧杯、胶头滴管外还有。(2)、实验过程中发生的化学反应方程式为、。(3)、为了增加实验的精确性,某同学四次测定所消耗的NaOH(aq)体积数据如下:测定次序
第一次
第二次
第三次
第四次
V[NaOH(aq)]/mL
11.00
12.90
13.10
13.00
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数,并比对说明书上规格判断该碳酸量是否合格
(要求写出计算过程)。
(4)、若在配制NaOH溶液的过程中出现下列情况,则会导致所测碳酸钙的质量分数偏高的是( )(不定项)A、称量NaOH固体时间过长 B、在烧杯中溶解NaOH后,立即转移至容量瓶内 C、溶液转移后未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶刻度线 -
15、由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准状况),用NA表示阿伏加德罗常数,则:(1)、该气体中所含的原子总数为个。(2)、该气体在标准状况下的密度为。(3)、该气体的一个分子的质量为。(4)、标准状况下,1体积水最多溶解507体积的HCl,则标准状况下盐酸的最大质量分数为(保留三位小数)。(5)、100g 12mol/L(密度为1.19g/mL)的盐酸用100g水稀释后,其物质的量浓度(填“大于”、“等于”或“小于”)6mol/L。
-
16、t℃时,A的溶解度是S g/100g水,其饱和溶液密度为d g·cm-3 , 物质的量浓度为c mol·L-1 , 溶液的质量分数为w,摩尔质量为M g·mol-1 , 实验测得向一定量含A的溶液中加入m g无水A或蒸发掉n g水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )A、 B、 C、 D、
-
17、一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1mol空气,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),V甲:V乙=4:1。则混合气体中CO和CO2的物质的量之比为( )
 A、1:1 B、2:1 C、3:1 D、1:3
A、1:1 B、2:1 C、3:1 D、1:3 -
18、下列三种相同数量的药片中和胃酸能力的大小顺序为( )
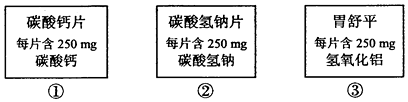 A、①=②=③ B、①>②>③ C、②>①>③ D、③>①>②
A、①=②=③ B、①>②>③ C、②>①>③ D、③>①>② -
19、NA表示阿伏加德罗常数,下列说法正确的是( )A、5.6g Fe与足量盐酸反应的电子转移数为0.3NA B、2mol氦气含有氦原子数为4NA C、48g O3气体含有的氧原子数为3NA D、常温常压下,28g CO与22.4L O2所含的分子数相等
-
20、二氧化氯在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯化物。制备ClO2的方法是:
____NaClO3+____HCl=____ClO2↑+____Cl2↑+____NaCl+____H2O
(1)、试配平上述化学方程式,并用标出电子转移的方向和数目。(2)、该反应中HCl体现的性质是( )(不定项)A、氧化性 B、还原性 C、酸性 D、挥发性(3)、在标准状况下,每生成10.08L气体,转移的电子数为。(4)、ClO2和Cl2均能将电镀废水中的CN-氧化为无毒无害的两种气体,自身被还原为Cl-。处理含CN-相同时的电镀废水,所需Cl2的物质的量是ClO2的倍。