相关试卷
-
1、现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如图1:下列有关说法错误的是( )
 A、反应Ⅰ原理为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl B、向饱和NaCl溶液中先通入足量的NH3 , 再通入足量的CO2 C、反应Ⅱ利用了NaHCO3的不稳定性,受热易分解 D、上述流程中包含了复分解反应、分解反应、氧化还原反应
A、反应Ⅰ原理为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl B、向饱和NaCl溶液中先通入足量的NH3 , 再通入足量的CO2 C、反应Ⅱ利用了NaHCO3的不稳定性,受热易分解 D、上述流程中包含了复分解反应、分解反应、氧化还原反应 -
2、在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是( )
①氯水的颜色呈浅绿色,说明氯水中含有Cl2
②向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
③向氯中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
④向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
A、只有①② B、只有③ C、①②③ D、②③④ -
3、下列判断正确的是( )
①足量金属Na与16gO2反应时一定转移2mol电子
②可用Ca(OH)2鉴别碳酸钠和碳酸氢钠
③钠与硫酸铜溶液反应,可置换出铜
④Na2O2与足量H2O反应时,每生成1molO2转移电子的数目为2NA
⑤Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
⑥向饱和烧碱溶液中加入2gNa2O2 , 充分反应完后,恢复至室温,溶液中烧碱的质量分数不变
A、①②③ B、②③⑤ C、④⑥ D、④ -
4、用下列装置进行相应实验,能达到实验目的的是( )A、“随开随用、随关随停”制CO2
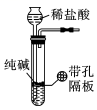 B、证明Cl2能与烧碱反应
B、证明Cl2能与烧碱反应 C、干燥HCl气体
C、干燥HCl气体 D、鉴别纯碱和小苏打
D、鉴别纯碱和小苏打
-
5、溴及其化合物可被用来作为阻燃剂、净水剂、染料等,海水中含有大量的Br- , 从海水中提取溴的过程中涉及反应+5Br-+6H+=3Br2+3H2O,下列关于这一反应的说法错误的是( )A、该反应属于氧化还原反应 B、生成物Br2既是氧化产物又是还原产物 C、氧化性:<Br2 D、氧化剂和还原剂的化学计量系数之比为1:5
-
6、(CN)2、(OCN)2、(SCN)2等气体通称为拟卤素,它们的性质与Cl2相似,氧化性强弱顺序是F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2。下列方程式书写错误的是( )A、2NaSCN+MnO2+2H2SO4Na2SO4+(SCN)2↑+MnSO4+2H2O B、(CN)2+2KI=2KCN+I2 C、(CN)2+2NaOH=NaCN+NaCNO+H2O D、Cl2+2NaOCN=(OCN)2+2NaCl
-
7、中国科学技术大学的钱逸泰教授课题组以CCl4和金属钠为原料,在700℃时反应制出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法正确的是( )A、该反应中CCl4体现还原性 B、另一种化合物是NaCl C、该反应能在水溶液中进行 D、纳米级金刚石粉末属于胶体
-
8、类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
选项
已知
类推
A
将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+
将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B
向H2SO4溶液中加入NaOH溶液至中性:H++OH-=H2O
向H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-=H2O
C
Na2O2与CO2反应:2Na2O2+2CO2=2Na2CO3+O2
Na2O2与SO2反应:2Na2O2+2SO2=2Na2SO3+O2
D
向NaOH溶液中通入过量CO2:CO2+OH-=
向Ca(OH)2溶液中通入过量CO2:CO2+OH-=
A、A B、B C、C D、D -
9、下列反应的离子方程式书写正确的是( )A、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ B、向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ C、向FeBr3溶液中通入少量Cl2:Fe2++Cl2=Fe3++2Cl- D、澄清石灰水与过量NaHCO3溶液反应:2+Ca2++2OH-=CaCO3↓+2H2O+
-
10、在下列指定溶液中,离子能大量共存的是( )A、某透明溶液中:Na+、Cu2+、Cl-、 B、含有大量Fe3+的溶液中:K+、Ca2+、I-、 C、使无色酚酞试液呈红色的溶液中:、H+、K+、Cl- D、pH<3的溶液中:Na+、Fe2+、、
-
11、设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、2molFe2(SO4)3晶体中含有4NA个 B、质量分数为40%的NaOH溶液含有NA个Na+ C、常温下,23gNO2含有NA个O D、1molFe2+与足量的酸性KMnO4溶液反应,转移2NA个电子
-
12、下列有关物质的性质与用途说法不正确的是( )A、碳酸钠的水溶液显碱性,可用作食用碱 B、碳酸氢钠受热易分解,可以用作焙制糕点的膨松剂 C、过氧化钠具有强还原性,可用于潜水艇的供氧剂 D、ClO2具有强氧化性,可用于自来水杀菌消毒
-
13、下列说法正确的一组是( )
①Na2O、MgO、Mn2O7均属于碱性氧化物
②已知Al2O3在熔融状态下能导电,则Al2O3在熔融状态下能电离
③海水、空气、胆矾、盐酸均为混合物
④苏打、熟石灰、硫酸、小苏打均为电解质
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
⑦C60、C70、金刚石、石墨均为碳的同素异形体
A、①③⑤⑥ B、②⑤⑦ C、①②⑤⑥ D、②④⑤ -
14、实验小组探究金属银与碘水的反应。
已知25℃时:i.碘水中、
ii.次碘酸不稳定,室温下部分分解为碘酸。
iii.;AgI在浓KI溶液中可以(无色)形式存在。
将碘水I2溶于蒸馏水)加入盛有银粉的试管中,实验记录如下:
实验Ⅰ
现象

现象a:棕黄色溶液(pH≈5.9)迅速变为无色,Ag粉表面略变暗,未见其他明显现象,溶液pH≈6.2。
现象b:滴加淀粉溶液,未见明显变化;继续滴加稀H2SO4 , 溶液仍未见明显变化。
(1)、碘水中I2与H2O反应的化学方程式为。(2)、针对实验Ⅰ现象a“棕黄色溶液迅速变为无色”的原因,实验小组提出如下假设:假设1:银粉与氢碘酸发生反应(填化学方程式)生成碘化银,使碘单质减少;。
假设2:银粉与碘单质直接化合生成碘化银,使碘单质减少;
假设3:银粉与氢碘酸及O2共同作用生成碘化银,使碘单质减少。
实验小组结合资料分析并设计实验验证假设:
①结合数据和实验现象判断假设l(填“是”或“不是”)主要原因。
②通过实验证实银粉表面生成了AgI:取表面变暗的银粉,加入一定量浓KI溶液,振荡,静置,取上层清液,加蒸馏水稀释,出现黄色浑浊。用化学平衡移动原理解释出现黄色浑浊的原因:。
③资料表明假设2成立。
④实验小组针对假设3,在实验Ⅰ的基础上设计了实验Ⅱ和实验Ⅲ:
实验Ⅱ:取一定量碘水,加入CCl4 , 充分振荡后分液,取上层清液,加入淀粉溶液,未见明显变化;加入稀硫酸后溶液变蓝。
实验Ⅲ:向实验Ⅰ最后所得溶液中加入(填试剂),溶液立即变蓝。
综合实验Ⅰ、实验Ⅱ、实验Ⅲ,可以证实假设3.分析实验Ⅱ的作用是。
(3)、反思:实验小组认为,本实验Ag与碘水反应的过程中,AgI的生成促进了体系中氧化还原反应的进行。进行电化学实验证实。补全下图所示电化学装置中的试剂、。
-
15、铅、铜是芯片焊接和封装工艺过程中常用的金属材料,采用“火法工艺”和“湿法工艺”均可将铅冰铜冶炼成铅和铜。
已知:i.铅冰铜成分:Cu2S、PbS及少量FeS、ZnS;富冰铜主要成分:Cu2S、FeS。
ii.Cu2S、PbS难溶于酸,FeS、ZnS可溶于酸。
iii.0.1mol·L-1Fe2+沉淀为Fe(OH)2 , 起始的pH为6.3,完全沉淀的pH为8.3;
0.1mol·L-1Fe3+沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。
(1)、Ⅰ.火法工艺:
“第一次熔炼”过程中,控制空气用量可使铁以FeS的形式留在富冰铜中。
①“熔炼”时铁可以将PbS中的铅置换出来,化学方程式是。
②富冰铜中的Cu2S转化生成1mol铜时,理论上至少需要反应molO2。
③控制空气用量进行二次熔炼而不能使用足量空气一次性熔炼的原因是。
(2)、Ⅱ.湿法工艺:
“酸浸”过程是用过量稀硫酸浸取铅冰铜。①氧气可将Cu2S氧化成硫和Cu2+ , 酸浸液中的阳离子还有。
②废电解液不能循环使用次数过多,原因是。
(3)、用废电解液制备ZnSO4和铁黄。①经氧气处理后的废电解液中。实际浓度大于 , 则用ZnO调节溶液pH1.5(填“>”、“<”或“=”)时开始有FeOOH沉淀析出。
②废电解液中Fe2+转化为铁黄的离子方程式是。
(4)、“湿法工艺”与“火法工艺”处理铅冰铜相比,湿法工艺的优点是。 -
16、研究人员对Na2SO3和Fe粉去除废水中的硝态氮进行研究。
已知:i.某工厂排放的含氮废水中总氮=10mg·L-1 , 含有硝态氮、氨氮。
ii.本实验中Na2SO3在时,脱除硝态氮(转化为N2)效果较强。
iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)、Na2SO3和Fe粉在去除废水中硝态氮的过程中表现性(填“氧化”或“还原”)。(2)、研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。
①根据图1,写出“实验组一”中发生反应的离子方程式。
②进行“实验组二”实验时发现,降低溶液pH更有利于的去除,可能的原因是。
(3)、脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。
①根据图2,前15min内Na2SO3 , 脱除NO;主要反应的离子方程式为。
②根据图2和图3,20~60min内体系中生成主要反应的离子方程式为。
③检验处理后的废水中存在取一定量废水蒸发浓缩,(补充操作和现象)。
-
17、合成氨的发展体现了化学科学与技术的不断进步。(1)、1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
i.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ii.氰氨化钙与水蒸气反应生成氨气。
写出反应ii
 化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。
化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。①N2的化学性质稳定,即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。从分子结构角度解释原因:。
②压强对合成氨有较大影响。下图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时,x(NH3)与温度的计算结果。

i.判断压强:p1p2(填“>”或“<”),简述理由:。
ii.在p1、x(NH3)=0.20时,氮气的转化率为。
iii.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2),反应达平衡时x(NH3)与温度的计算结果与组成1相比有一定变化,在上图中用虚线画出相应曲线。
(3)、我国科学家研制出双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
分析解释:与传统的催化合成氨(铁触媒、)相比,双催化剂双温催化合成氨具备优势的原因是。
-
18、 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料,实现废碳再生、循环内零碳排放。已知某些共价键的键能:
化学键
H-H
C-H
O-H
C-O
C=O
键能/(kJ·mol-1)
436
413
463
351
745
(1)、CO2的电子式为。(2)、CH3OH分子结构如图。
①CH3OH分子中O的杂化轨道类型。
②键长a、b、c从长到短的顺序为。
③乙醇
 沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
①该条件下制备甲醇的化学方程式为:。
②下列说法正确的是 (填序号)。
A.电负性由大到小的顺序:O>C>H
B.步骤a涉及s-s σ键的断裂和s-sp3 σ键的形成
C.步骤d、e的反应热(ΔH)相等
D.升高温度可以提高反应速率和CH3OH的平衡产率
(4)、干冰(CO2)的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为。(已知:;表示阿伏加德罗常数)
-
19、一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( )
 A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离
A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离 -
20、分别向相同浓度的Na2CO3、NaHCO3溶液中逐滴加入盐酸,滴定过程中溶液的pH变化如下图,下列说法不正确的是( )
 A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为:
A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为: