相关试卷
-
1、下列反应的方程式不正确的是( )A、C和浓H2SO4反应: B、NH3的催化氧化反应: C、向氢硫酸中通入SO2: D、向FeBr2溶液中通入足量Cl2:
-
2、金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( )
 A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变
A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变 -
3、下列应用中未涉及氧化还原反应的是( )A、将过氧化钠置于呼吸面具中供氧 B、将明矾置于浑浊的水中净水 C、将漂白粉置于水中漂白衣物 D、将覆铜板置于氯化铁溶液中制作电路板
-
4、核污染水中含有38Sr、55Cs等多种放射性同位素粒子,会对人体和环境产生危害。下列说法不正确的是( )A、含有的中子比质子多27个 B、Sr位于元素周期表第五周期、第ⅡA族 C、可用沉淀法或离子交换法去除核污染水中的 D、借助元素周期表比较可知Sr的金属性比Cs强
-
5、下列化学用语或图示表达不正确的是( )A、基态S原子的最外层电子轨道表示式:
 B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型:
B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型: D、Cl2分子中σ键的形成:
D、Cl2分子中σ键的形成:
-
6、我国科学家首次合成大面积全碳纳米材料——石墨炔,其结构与石墨类似,可用于制备储锂电极材料。下列关于石墨炔的说法不正确的是( )
 A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能
A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能 -
7、实验室用浓盐酸、二氧化锰共热制氯气,并用氯气制取氯酸钾、次氯酸钠,并验证氯水的性质。

 (1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水
(1)、写出实验室用装置①制备氯气的反应方程式。(2)、有同学认为①②装置之间应加入一盛有饱和食盐水的洗气瓶,则此洗气瓶的作用是。(3)、图一中②的试管中盛有15mL 30%的KOH溶液;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;写出制取次氯酸钠的反应方程式 ,
比较制取次氯酸钠和氯酸钾的反应条件,试总结两条差异:
① ②。
(4)、④的试管中加有紫色石蕊试液,实验过程中可观察到的现象是 , 导致该现象的相应微粒为。(5)、反应完毕冷却后,②的试管中有大量晶体析出,图二中符合该晶体溶解度随温度变化规律的曲线是(选填字母);从②的试管中分离该晶体的操作是(填写实验操作名称)。(6)、含氯消毒剂的消毒效果用有效氯表示,有效氯指的是与浓盐酸反应产生Cl2的质量与原消毒液质量的比值。计算10% NaClO溶液的有效氯(保留三位小数)。(7)、传统工业电解饱和食盐水所得的烧碱中往往混有食盐,若要检验其中混有氯离子,简述实验方法、现象和结论。 -
8、某种胃药的止酸剂为碳酸钙(说明书规格为每克含碳酸钙620mg),某同学查阅测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①分别配制250mL 0.100mol·L-1稀盐酸和0.100mol·L-1 NaOH溶液;
②取一粒药片(0.100g)研碎后加入20.0mL蒸馏水;
③加入25.00mL 0.100mol·L-1稀盐酸,搅拌,充分反应;
④用0.100mol·L-1 NaOH溶液中和剩余的盐酸,用去NaOH溶液体积为V mL。
请回答下列问题:
(1)、配制NaOH溶液需要的主要玻璃仪器除了烧杯、胶头滴管外还有。(2)、实验过程中发生的化学反应方程式为、。(3)、为了增加实验的精确性,某同学四次测定所消耗的NaOH(aq)体积数据如下:测定次序
第一次
第二次
第三次
第四次
V[NaOH(aq)]/mL
11.00
12.90
13.10
13.00
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数,并比对说明书上规格判断该碳酸量是否合格
(要求写出计算过程)。
(4)、若在配制NaOH溶液的过程中出现下列情况,则会导致所测碳酸钙的质量分数偏高的是( )(不定项)A、称量NaOH固体时间过长 B、在烧杯中溶解NaOH后,立即转移至容量瓶内 C、溶液转移后未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶刻度线 -
9、由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准状况),用NA表示阿伏加德罗常数,则:(1)、该气体中所含的原子总数为个。(2)、该气体在标准状况下的密度为。(3)、该气体的一个分子的质量为。(4)、标准状况下,1体积水最多溶解507体积的HCl,则标准状况下盐酸的最大质量分数为(保留三位小数)。(5)、100g 12mol/L(密度为1.19g/mL)的盐酸用100g水稀释后,其物质的量浓度(填“大于”、“等于”或“小于”)6mol/L。
-
10、t℃时,A的溶解度是S g/100g水,其饱和溶液密度为d g·cm-3 , 物质的量浓度为c mol·L-1 , 溶液的质量分数为w,摩尔质量为M g·mol-1 , 实验测得向一定量含A的溶液中加入m g无水A或蒸发掉n g水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )A、 B、 C、 D、
-
11、一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1mol空气,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),V甲:V乙=4:1。则混合气体中CO和CO2的物质的量之比为( )
 A、1:1 B、2:1 C、3:1 D、1:3
A、1:1 B、2:1 C、3:1 D、1:3 -
12、下列三种相同数量的药片中和胃酸能力的大小顺序为( )
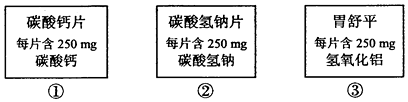 A、①=②=③ B、①>②>③ C、②>①>③ D、③>①>②
A、①=②=③ B、①>②>③ C、②>①>③ D、③>①>② -
13、NA表示阿伏加德罗常数,下列说法正确的是( )A、5.6g Fe与足量盐酸反应的电子转移数为0.3NA B、2mol氦气含有氦原子数为4NA C、48g O3气体含有的氧原子数为3NA D、常温常压下,28g CO与22.4L O2所含的分子数相等
-
14、二氧化氯在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯化物。制备ClO2的方法是:
____NaClO3+____HCl=____ClO2↑+____Cl2↑+____NaCl+____H2O
(1)、试配平上述化学方程式,并用标出电子转移的方向和数目。(2)、该反应中HCl体现的性质是( )(不定项)A、氧化性 B、还原性 C、酸性 D、挥发性(3)、在标准状况下,每生成10.08L气体,转移的电子数为。(4)、ClO2和Cl2均能将电镀废水中的CN-氧化为无毒无害的两种气体,自身被还原为Cl-。处理含CN-相同时的电镀废水,所需Cl2的物质的量是ClO2的倍。 -
15、将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S。如图所示,下列说法正确的是( )
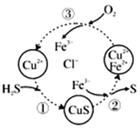 A、在图示的转化中,化合价不变的元素只有铜 B、由图示的转化可得出的氧化性的强弱顺序是:Fe3+>O2>S C、回收S的总反应为2H2S+O2=2S+2H2O D、①②③三步均为氧化还原反应
A、在图示的转化中,化合价不变的元素只有铜 B、由图示的转化可得出的氧化性的强弱顺序是:Fe3+>O2>S C、回收S的总反应为2H2S+O2=2S+2H2O D、①②③三步均为氧化还原反应 -
16、某国外化学教材中有一张关于氧化还原反应的插图,由图可知:
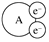 , 在该反应中( )
, 在该反应中( )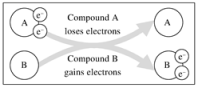 A、被氧化,做氧化剂 B、化合价升高,发生氧化反应 C、被还原,做氧化剂 D、化合价升高,发生还原反应
A、被氧化,做氧化剂 B、化合价升高,发生氧化反应 C、被还原,做氧化剂 D、化合价升高,发生还原反应 -
17、氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
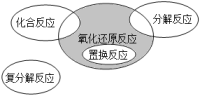 A、Cl2+H2OHCl+HClO B、2NaHCO3Na2CO3+H2O+CO2↑ C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 D、Cl2+2KBr=Br2+2KCl
A、Cl2+H2OHCl+HClO B、2NaHCO3Na2CO3+H2O+CO2↑ C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 D、Cl2+2KBr=Br2+2KCl -
18、某实验小组为探究Cl-、I-、SO32-的还原性强弱,甲同学设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量新制氯水溶液,溶液立刻变蓝;
实验②:向实验①的溶液中加入亚硫酸钠溶液,发现溶液蓝色褪去。
(1)、根据上述实验现象,可以判断Cl-、I-、SO32-还原性由强到弱的顺序为。乙同学参考教科书知识,提出另一种实验方法,在碘化钾溶液中加入新制氯水后,将碘化钾溶液加入新制氯水后,将溶液转移入分液漏斗,并加入萃取剂,主要操作步骤如图:
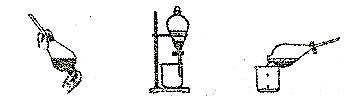
1. 加入萃取剂后振荡 2. 静置分层 3. 分离
(2)、根据图中现象,该同学所采用的萃取剂可能是( )A、酒精 B、苯 C、CCl4 D、汽油(3)、甲、乙、丙三步实验操作中,不正确的是(填“1”、“2”或“3”),理由是。(4)、在乙图的分液漏斗中,下层液体呈色。 -
19、氢氧化铁胶体的制备步骤如下:
Ⅰ.用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
Ⅱ.向烧杯中逐滴加入饱和FeCl3溶液;
Ⅲ.继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。
(1)、确定制备的胶体是否成功,最简单的方法是。(2)、若向FeCl3溶液中逐滴滴加稀NaOH溶液,并控制溶液的酸碱性,也可制得Fe(OH)3胶体,若要提纯Fe(OH)3胶体可采取的方法是。(3)、Fe(OH)3胶体与Al(OH)3胶体相似,也具有净水作用,原因是。(4)、FeCl3与H2O制得胶体的胶团结构为{[Fe(OH)3]m·nFeO+·(n-x)Cl-}x+·xCl- , 下列说法正确的是( )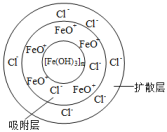 A、Fe(OH)3胶体带正电 B、16.25g FeCl3生成的胶体粒子数为6.02×1022 C、Fe(OH)3胶体粒子的直径可能是5×10-7m D、在U形管中注入Fe(OH)3胶体,插入石墨电极通电,阴极周围颜色加深(5)、下列现象或新技术应用中,涉及胶体性质的有( )
A、Fe(OH)3胶体带正电 B、16.25g FeCl3生成的胶体粒子数为6.02×1022 C、Fe(OH)3胶体粒子的直径可能是5×10-7m D、在U形管中注入Fe(OH)3胶体,插入石墨电极通电,阴极周围颜色加深(5)、下列现象或新技术应用中,涉及胶体性质的有( )①使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少出血
②肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
③使用静电除尘器除去空气中的飘尘粒子
④豆浆中加入石膏后迅速凝固
A、1项 B、2项 C、3项 D、4项 -
20、欲除去CuSO4·5H2O中的沙子(主要成分为SiO2),下列实验装置无需使用的是( )(双选)
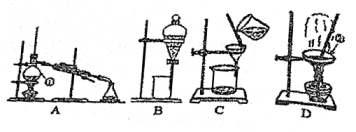 A、A B、B C、C D、D
A、A B、B C、C D、D