相关试卷
-
1、设为阿伏加德罗常数的值。下列叙述正确的是( )A、固体中含有的NH4+ 数目为 B、密闭容器中通入1molN2与足量H2充分反应,生成的NH3分子数目为 C、体积为的0.溶液中,数目为0.1 D、将含的溶液滴入沸水中,制得的胶体粒子数目为
-
2、下列电离方程式正确的是( )A、Al2(SO4)3 2Al3++3SO42- B、HIH++I- C、HFH++F- D、Ca(OH)2Ca2++2OH-
-
3、下列说法不正确的是( )A、铵态氮肥与草木灰不宜混合施用 B、实验室配制溶液时,将溶在一定浓度的硫酸中,最后加入少许铁粉 C、实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 D、加热蒸干CuCl2溶液可以得到CuCl2固体
-
4、腺嘌呤(A)是一种有机弱碱,与盐酸反应生成盐酸盐(AHCl)。下列叙述错误的是( )A、AHCl 属于弱电解质 B、向水中加入AHCl,可促进水的电离 C、向 0.01 mol·L-1AHCl 水溶液中加水稀释,pH 升高 D、AHCl的水溶液中:c ( OH- )+c ( Cl- )=c ( H+ )+c ( AH+ )
-
5、我国古代哲学认为物质是阴阳组成的对立统一体,下列化学知识正确且最能体现阴阳对立统一的是( )A、化学反应伴随能量变化 B、NaHCO3溶液中既有的转换关系又有的转换关系 C、温度升高,纯水中的与均增大 D、绝大多数的化学反应是有限度的,限度越低的反应,化学反应速率越大
-
6、近年来我国科技发展迅速,创新指数排名飙升,下列关于我国新科技的叙述不正确的是( )A、中国空间站使用的砷化镓薄膜光电池,光电池是将化学能转化为电能 B、高铁机车用于导电的受电弓板是碳系新材料,利用石墨导电性、有润滑感性能 C、运载火箭使用了煤油液氧推进剂,火箭推进所需能量来自化学能 D、在汽油燃油车上安装三元催化转换器,可加快尾气中有害气体去除速率
-
7、化学与生活、生产、社会息息相关。下列说法错误的是( )A、冬天应将面团置于温热处发酵 B、蔗糖溶于水是熵减小的过程 C、工业生产中,适当增大廉价的反应物的浓度有利于降低生产成本 D、“冰,水为之,而寒于水”说明等质量的水和冰相比,冰的能量更低
-
8、回答下列问题:(1)、在常温条件下,某密闭容器中含有由3.4gH2和O2组成的混合气体,共含有0.4mol原子。
①该混合气体的平均摩尔质量为。
②混合气体中H2的分子数约为个,H2和O2质量比为。
(2)、12.4gNa2X中含Na+0.4mol,X的相对原子质量是。(3)、在催化剂的作用下,NH3和NO2发生反应生成N2和H2O,每生成7molN2转移电子的物质的量为。 -
9、某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气(如图5),并探究氯水的性质。
 (1)、若要制备纯净干燥的Cl2 , 按气流方向连接各仪器接口,顺序为a→→→→→→→d。(2)、写出装置A中反应的化学方程式: , 该反应中盐酸起的作用是。(3)、若将A、B、C相连,制得Cl2后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。
(1)、若要制备纯净干燥的Cl2 , 按气流方向连接各仪器接口,顺序为a→→→→→→→d。(2)、写出装置A中反应的化学方程式: , 该反应中盐酸起的作用是。(3)、若将A、B、C相连,制得Cl2后加入适量水,即可制得氯水。将所得氯水分装在两个试管中,进行甲、乙两个实验。实验甲:甲同学用强光照射其中一个试管中的氯水,同时使用数据采集器采集数据如图6:
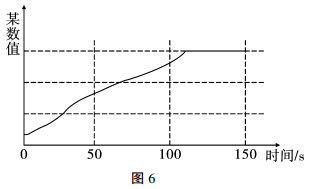
甲同学采集的数据是 (填序号)。
a.氯水的pH随时间的变化
b.溶液中氯离子浓度随时间的变化
c.液面上方氧气体积分数随时间的变化
实验乙:乙同学在另一试管的氯水中加入碳酸氢钠粉末,有无色气泡产生,乙指出氯气与水反应的产物具有酸性,甲同学认为不合理,原因是。
(4)、由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物对人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。我国广泛采用将经干燥空气稀释的氯气通入填有固体氯酸钠(NaClO3)的柱内制得ClO2和另一种漂白物质,表示这一反应的化学方程式是。ClO2为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是Cl2的倍(结果保留小数点后两位)。(5)、ClO2在处理含有Mn2+废水时,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl- , 该反应过程中氧化剂与还原剂的物质的量之比为。 -
10、过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图4:
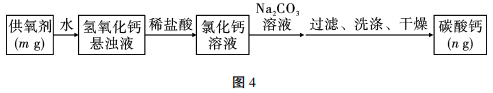 (1)、在流程中过氧化钙(CaO2)与水反应的化学方程式为。(2)、滴加Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将 (填“偏大”“偏小”或“无影响”)。
(1)、在流程中过氧化钙(CaO2)与水反应的化学方程式为。(2)、滴加Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将 (填“偏大”“偏小”或“无影响”)。 -
11、现有下列物质:
①Na2CO3·10H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤熔融NaHSO4 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧盐酸 ⑨CH3COOH ⑩Al2(SO4)3固体
(1)、上述物质中既能导电又属于电解质的是(填序号)。写出⑩在水溶液中的电离方程式:。(2)、仅用上述物质之间的反应写出能证明④是酸性氧化物的离子方程式:。(3)、上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的其中一个化学方程式:。(4)、写出实验室制取⑦的化学方程式:。(5)、CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是。(填“氧化剂”“还原剂”或“既不是氧化剂也不是还原剂”)(6)、②物质灼烧时,焰色试验为色。 -
12、已知H2SO3+I2+H2O=H2SO4+2HI,Cl2+2HI==2HCl+I2。将0.1molCl2通入含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法不正确的是( )A、物质的还原性:H2SO3>HI>HCl B、通入0.1molCl2发生反应的离子方程式为5Cl2+4H2SO3+2I-+4H2O=4+I2+10Cl-+16H+ C、若再通入0.05molCl2 , 则恰好能将HI和H2SO3完全氧化 D、混合溶液中H2SO3和HI的物质的量都是0.08mol
-
13、现有2.0g含Na2O杂质的Na2O2样品,用图3的实验装置测定Na2O2样品的纯度(纯度即Na2O2样品中Na2O2的质量分数,可供选用的反应物只有CaCO3固体、盐酸、硫酸和蒸馏水),下列说法错误的是( )
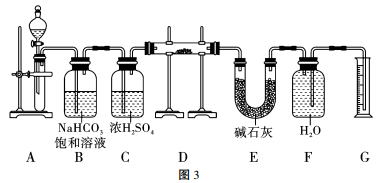 A、装置A中液体试剂为盐酸 B、装置C的作用是干燥CO2 C、若去掉装置E会导致所测Na2O2试样的纯度偏高 D、若反应结束后由气体体积计算得气体质量为0.16g,则Na2O2试样的纯度为78%
A、装置A中液体试剂为盐酸 B、装置C的作用是干燥CO2 C、若去掉装置E会导致所测Na2O2试样的纯度偏高 D、若反应结束后由气体体积计算得气体质量为0.16g,则Na2O2试样的纯度为78% -
14、某溶液X中可能含有下列离子中的若干种Cl-、、、Na+、Mg2+、Cu2+。为了确定该溶液的组成,取一定体积的上述溶液,进行了图2实验,下列说法正确的是( )
 A、白色沉淀1是硫酸钡 B、溶液2中滴入硝酸酸化的硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl- C、溶液X中可能存在Mg2+、Na+ , 一定不存在Cu2+ D、溶液X中一定存在Na+、、
A、白色沉淀1是硫酸钡 B、溶液2中滴入硝酸酸化的硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl- C、溶液X中可能存在Mg2+、Na+ , 一定不存在Cu2+ D、溶液X中一定存在Na+、、 -
15、现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如图1:下列有关说法错误的是( )
 A、反应Ⅰ原理为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl B、向饱和NaCl溶液中先通入足量的NH3 , 再通入足量的CO2 C、反应Ⅱ利用了NaHCO3的不稳定性,受热易分解 D、上述流程中包含了复分解反应、分解反应、氧化还原反应
A、反应Ⅰ原理为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl B、向饱和NaCl溶液中先通入足量的NH3 , 再通入足量的CO2 C、反应Ⅱ利用了NaHCO3的不稳定性,受热易分解 D、上述流程中包含了复分解反应、分解反应、氧化还原反应 -
16、在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是( )
①氯水的颜色呈浅绿色,说明氯水中含有Cl2
②向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
③向氯中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
④向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
A、只有①② B、只有③ C、①②③ D、②③④ -
17、下列判断正确的是( )
①足量金属Na与16gO2反应时一定转移2mol电子
②可用Ca(OH)2鉴别碳酸钠和碳酸氢钠
③钠与硫酸铜溶液反应,可置换出铜
④Na2O2与足量H2O反应时,每生成1molO2转移电子的数目为2NA
⑤Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
⑥向饱和烧碱溶液中加入2gNa2O2 , 充分反应完后,恢复至室温,溶液中烧碱的质量分数不变
A、①②③ B、②③⑤ C、④⑥ D、④ -
18、用下列装置进行相应实验,能达到实验目的的是( )A、“随开随用、随关随停”制CO2
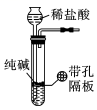 B、证明Cl2能与烧碱反应
B、证明Cl2能与烧碱反应 C、干燥HCl气体
C、干燥HCl气体 D、鉴别纯碱和小苏打
D、鉴别纯碱和小苏打
-
19、溴及其化合物可被用来作为阻燃剂、净水剂、染料等,海水中含有大量的Br- , 从海水中提取溴的过程中涉及反应+5Br-+6H+=3Br2+3H2O,下列关于这一反应的说法错误的是( )A、该反应属于氧化还原反应 B、生成物Br2既是氧化产物又是还原产物 C、氧化性:<Br2 D、氧化剂和还原剂的化学计量系数之比为1:5
-
20、(CN)2、(OCN)2、(SCN)2等气体通称为拟卤素,它们的性质与Cl2相似,氧化性强弱顺序是F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2。下列方程式书写错误的是( )A、2NaSCN+MnO2+2H2SO4Na2SO4+(SCN)2↑+MnSO4+2H2O B、(CN)2+2KI=2KCN+I2 C、(CN)2+2NaOH=NaCN+NaCNO+H2O D、Cl2+2NaOCN=(OCN)2+2NaCl