相关试卷
-
1、用铁铆钉固定铜板,通常会发生腐蚀,如图所示。下列说法不正确的是( )
 A、铁铆钉做负极发生锈蚀 B、铁失去的电子通过水膜传递给O2 C、铜板的存在会加速铁铆钉腐蚀 D、铁元素变化过程:Fe→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O
A、铁铆钉做负极发生锈蚀 B、铁失去的电子通过水膜传递给O2 C、铜板的存在会加速铁铆钉腐蚀 D、铁元素变化过程:Fe→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O -
2、在一定条件下,将2molSO2与1molO2加入到1L的密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g),充分反应后,测得平衡时SO3的浓度为1mol⋅L﹣1。此条件下平衡常数K为( )A、0.5 B、1 C、2 D、4
-
3、化学反应可视为旧键断裂和新键形成的过程。下表给出常见化学键键能数据:
化学键种类
H﹣H
H﹣N
N≡N
键能(kJ/mol)
436
X
946
根据热化学方程式N2(g)+3H2(g)⇌2NH3(g) ΔH=﹣92kJ⋅mol﹣1 , 计算X值为( )
A、254 B、360 C、391 D、431 -
4、如图为某装置的示意图,下列说法中不正确的是( )
 A、Cu做正极反应物 B、电子从Zn上经导线运动到Cu上 C、盐桥中的阳离子向右侧烧杯中移动 D、该装置实现了氧化反应和还原反应分开进行
A、Cu做正极反应物 B、电子从Zn上经导线运动到Cu上 C、盐桥中的阳离子向右侧烧杯中移动 D、该装置实现了氧化反应和还原反应分开进行 -
5、下列说法中正确的是( )A、S(g)+O2(g)═SO2(g) ΔH1;S(s)+O2(g)═SO2(g) ΔH2;则ΔH1>ΔH2 B、C(s,石墨)═C(s,金刚石) ΔH=+1.9kJ⋅mol﹣1;则处于相同条件的石墨更加稳定 C、吸热反应不一定可自发进行,放热反应一定可自发进行 D、断裂反应物所有化学键的总能量小于形成生成物所有化学键的总能量的为吸热反应
-
6、汽车尾气净化反应之一:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)ΔH=﹣373.4kJ⋅mol﹣1 , 在恒容密闭容器中达到平衡状态,下列措施可以使平衡向正反应方向移动的是( )A、除去二氧化碳 B、减小压强 C、升高温度 D、加入催化剂
-
7、党的二十大报告指出,深入推进环境污染防治;持续深入打好蓝天、碧水、净土保卫战,基本消除重污染天气。下列不利于可持续发展的是( )
A.氢燃料电池车
B.太阳能电池板
C.风能发电
D.燃煤供暖



 A、A B、B C、C D、D
A、A B、B C、C D、D -
8、(1)、 Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=。(2)、一定温度下,CdCO3的Ksp=4.0 × 10-12 , CdS的Ksp=7.9 × 10-27 , 欲将某含镉废水中的Cd2+沉淀下来,最好选用(填“Na2CO3”或“Na2S”)(3)、若往某含镉废水中加入Na2S,当S2-浓度达到7.9 × 10-8 mol·L-1时,水体中Cd2+ 浓度为mol·L-1(已知:Ksp(CdS)=7.9 × 10-27 , Cd的相对原子质量为112);此时是否符合水源标准?(填“是”或“否”)。(4)、Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
加入H2O2溶液的作用是。金属离子
Fe3+
Zn2+
Fe2+
开始沉淀的pH
1.1
5.2
5.8
沉淀完全的pH
3.2
6.4
8.8
(5)、流程图中,调节pH时,加入的试剂X可以是(填序号)A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到。
-
9、(1)、I、在 298 K,100 kPa 时,已知:C(s,石墨)的燃烧热为393.5 kJ·mol-1 , H2(g)的燃烧热为285.8 kJ·mol-1 , C2H2(g)的燃烧热为 1299.5 kJ·mol-1。
则 2C(s,石墨) +H2(g) ⇋ C2H2(g) ΔH =kJ·mol-1。
(2)、在2 L的恒温容器中加入240 g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) ⇋ C2H2 (g) 。若5 min达到平衡时石墨的质量为90 g,
则v (H2) = mol·L -1·min-1。
(3)、Ⅱ、在密闭容器中加入1 mol X和3 mol Y发生反应:X(g)+3Y(g) ⇋4Z(g) ΔH <0,回答下列问题:
若该反应在恒温恒容条件下进行:①初始时充入惰性气体,化学反应速率会(填“增大”“减小”或“不变”)。
②平衡时产生1.2 mol 物质 Z,则 X 的转化率α(X) = 。
(4)、若该反应在绝热恒容条件下进行:①相同时间内生成 Z 的量比恒温恒容时多,原因是。
②当气体压强不再变化时,该反应(填“是”或“否”)达到平衡状态。
(5)、Ⅲ、CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①俗称纯碱,因水解而使其水溶液呈碱性,写出第一步水解的离子方程式②已知:25℃时,Ka1(H2CO3)=4.5×10-7 , Ka2(H2CO3)=4.7×10-11 , 当Na2CO3溶液的pH为11时,溶液中的c (HCO3-):c(CO32- ) =
-
10、 甲醇是重要的化学工业基础原料和清洁液体燃料。现在工业上合成甲醇几乎全部采用或CO2加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及不同温度下的化学平衡常数如下表所示:
化学反应
平衡常数
温度/℃
500
800
①
2.5
0.15
②
1.0
2.50
③
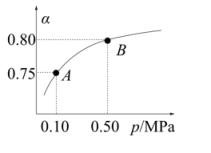
(1)、反应②是(填“吸热”或“放热”)(2)、某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如右图所示,则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。根据反应①和②可推导K1、K2与K3之间的关系,则K3 =(用K1、K2表示)
 (3)、在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如右图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(3)、在3L容积可变的密闭容器中仅发生反应②,已知c(CO)与反应时间t的变化曲线I如右图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线I变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。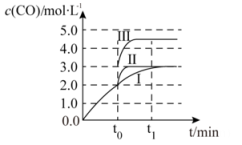 (4)、一定条件下将(g)和(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有____A、体系密度保持不变 B、和的体积比保持不变 C、混合气体的平均相对分子量不变时,反应一定达到平衡状态 D、当破坏中2个碳氧双键,同时破坏中的2个氧氢键,反应一定达到平衡状态(5)、一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c (CH3COO- ),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
(4)、一定条件下将(g)和(g)以体积比3∶1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有____A、体系密度保持不变 B、和的体积比保持不变 C、混合气体的平均相对分子量不变时,反应一定达到平衡状态 D、当破坏中2个碳氧双键,同时破坏中的2个氧氢键,反应一定达到平衡状态(5)、一定条件下,甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c (CH3COO- ),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。 -
11、醋酸和氨水是常用的化学试剂,某研究小组对两种试剂进行了如下实验。(1)、实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。(2)、为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:实验序号
1
2
3
4
消耗NaOH溶液的体积(mL)
19.05
19.00
18.10
18.95
则该醋酸溶液的准确浓度为(保留小数点后四位)。
(3)、实验二 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案。(4)、氨水中存在电离平衡,用电离常数Kb和电离度α(电离部分占总量的比值)来定量表示其电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是该小组在25℃ 时测定一系列浓度氨水的pH所对应的c(OH-):【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
烧杯号
V氨水 (mL)
V水(mL)
c (NH3·H2O) (mol·L-1)
c(OH-)
Kb
α
1
50.00
0.00
1.34×10-3
2
25.00
25.00
9.48×10-4
3
5.00
x
4.24×10-4
根据以上信息回答以下问题:

①表格中x = 。
②25℃时,氨水的电离常数Kb ≈ , 通过计算所得所得的数据和简洁文字说明电离度与弱电解质的初始浓度的关系是。
③用0.10mol/L的盐酸分别滴定20.00mL 0.10mol·L-1 NaOH
溶液和20.00mL 0.10mol·L-1氨水所得的滴定曲线如图:请指出盐酸滴定氨水的曲线为(填A或B),请写出曲线上a点所对应的溶液中各离子浓度由大到小的排列顺序。
-
12、某兴趣小组用数字实验系统测定一定浓度碳酸钠的溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
 A、c点水解程度最大 B、水的电离平衡不会对溶液的pH产生影响 C、a→b段水解平衡向右移动 D、该水解是吸热过程
A、c点水解程度最大 B、水的电离平衡不会对溶液的pH产生影响 C、a→b段水解平衡向右移动 D、该水解是吸热过程 -
13、下列离子方程式书写正确的是( )A、在水溶液中水解: B、硫化钠水解: C、硫酸铜溶液显酸性: D、用Na2CO3溶液处理水垢中的CaSO4:CO32-(aq)+CaSO4(s)CaCO3(s)+SO42-(aq)
-
14、已知反应 , 在催化过程中,不同途径可能生成不同的过渡态(TS为过渡态)和中间产物。发生该反应时,途径Ⅰ和途径Ⅱ的能量变化如图所示,下列说法错误的是( )
 A、途径Ⅰ的最大能垒(活化能)为 B、该反应为放热反应 C、途径Ⅱ比途径Ⅰ的催化效果好 D、催化剂不能改变该反应的反应热
A、途径Ⅰ的最大能垒(活化能)为 B、该反应为放热反应 C、途径Ⅱ比途径Ⅰ的催化效果好 D、催化剂不能改变该反应的反应热 -
15、已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是( )
 A、向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动 B、向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡均向右移动 C、该难溶性物质的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) D、升高温度,溶浸速率增大,平衡向右移动
A、向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动 B、向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡均向右移动 C、该难溶性物质的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) D、升高温度,溶浸速率增大,平衡向右移动 -
16、下列实验方案不能达到相应目的的是( )
选项
目的
实验方案
A
比较 AgCl、AgI 的溶解度大小
向 2 mL 0.1 mol·L-1AgNO3溶液中滴加 2 滴 0.1mol·L-1NaCl 溶液,继续再滴加2滴0.1 mol·L-1 NaI溶液
B
研究酸碱性对化学平衡的影响
向两份5mL0.1 mol·L-1K2Cr2O7溶液中分别加入 5滴3 mol·L-1硫酸和5滴6 mol·L-1的NaOH 溶液
C
对比硫酸溶液、唾液对淀粉水解催化效果
同温时,分别向两份加有2滴碘水的淀粉稀溶液中加入1mL唾液和1mL稀硫酸
D
比较碳酸、醋酸的酸性强弱
向盛有2mL 1 mol·L-1醋酸的试管中加入1 mol·L-1的 Na2CO3溶液
A、A B、B C、C D、D -
17、 下列实验装置正确并能达到实验目的的是( )
 A、装置甲用于测定生成氢气的速率 B、装置乙制取碳酸氢钠 C、装置丙制备无水氯化镁 D、装置丁测定未知醋酸的浓度
A、装置甲用于测定生成氢气的速率 B、装置乙制取碳酸氢钠 C、装置丙制备无水氯化镁 D、装置丁测定未知醋酸的浓度 -
18、下列对生产、生活中事实的解释正确的是( )
选项
事实
解释
A
NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
两者混合会生成CO2和氢氧化铝,可阻止氧气与可燃物接触和降低可燃物表面温度
B
用热的碳酸钠溶液去除油污
加热抑制了碳酸钠的水解
C
合成氨工业使用铁触媒作催化剂
催化剂既能加快反应速率,又能提高氢气的平衡转化率
D
NH4Cl溶液可作焊接金属时的除锈剂
NH4Cl溶液水解呈碱性,可溶解金属氧化物
A、A B、B C、C D、D -
19、下列有关反应的说法正确的是( )A、该反应在任何温度下都能自发进行 B、其他条件一定,平衡时升高温度,v(正)减小,v(逆)增大 C、其他条件不变,将容器体积扩大一倍,PCl5体积分数减小 D、消耗2.24 L , 反应转移0.2 mol电子
-
20、人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )A、橡胶轮胎中加入防老化剂 B、燃煤中加入CaO C、化工生产时将金属矿石粉碎再进行预处理 D、制取时使用催化剂