相关试卷
-
1、现有混有少量氯化钠的硝酸钾粉末,设计实验方案提纯硝酸钾,下列步骤正确的是( )
①常温下溶于水 ②过滤 ③趁热过滤 ④蒸发结晶 ⑤蒸发浓缩 ⑥降温结晶
A、①④③ B、①④② C、④⑥② D、①⑤⑥② -
2、亚运会的烟花表演用璀璨的焰火点亮了杭州的夜空,这与高中化学中“焰色试验”知识相关,下列说法中正确的是( )A、焰色试验是化学变化 B、利用焰色试验可区分NaCl与Na2CO3固体 C、焰色试验的实验均应透过蓝色钴玻璃观察 D、用稀盐酸清洗做焰色试验的铂丝
-
3、以下是一些常用的危险品标志,装运酒精的包装箱应贴的图标是( )
 A、A B、B C、C D、D
A、A B、B C、C D、D -
4、航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料。(1)、写出高氯酸铵组成元素中,原子核外有三层电子的原子的结构示意图。(2)、高氯酸铵对应酸高氯酸HClO4的酸酐是。(3)、150℃时高氯酸铵发生分解反应:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为。
-
5、地球氧化性的氛围中,金属容易发生腐蚀。在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中铜绿的成分是碱式碳酸铜Cu2(OH)2CO3。铜绿能和酸反应生成铜盐、CO2和水。(1)、从物质分类标准看,铜绿属于哪类物质( )A、酸 B、碱 C、盐 D、氧化物(2)、铜器表面的这层铜绿可用化学方法除去,写出盐酸除去铜绿的化学方程式。(3)、古代人们高温灼烧孔雀石(主要成分为碱式碳酸铜)和木炭的混合物得到紫红色的金属铜,则该过程中可能发生的反应类型有( )(不定项)A、化合反应 B、分解反应 C、复分解反应 D、置换反应
-
6、月球中的铁元素主要以和存在,但是在嫦娥五号取回的微陨石撞击处的月壤样品中存在大量的 , 推测在月球上该样品产生的原因可能是(铁元素以单质或氧化物表示)( )A、3FeO=Fe+Fe2O3 B、Fe3O4=FeO+Fe2O3 C、Fe+FeO+O2=Fe2O3 D、Fe2O3+FeO=Fe3O4
-
7、宇航员在神舟号中展示了失重环境下的物理现象,则下列实验中最难完成的是( )A、将牛奶与水混合 B、蒸发食盐水制取食盐晶体 C、用漏斗滤纸过滤除去水中泥沙 D、用注射器向水球中注入气泡
-
8、航天探测发现:金星是一个被浓密大气层包围的固体球,大气层的成分之一是C2O3 , 其性质与CO相似。下列关于C2O3的说法错误的是( )A、C2O3由两种元素组成 B、C2O3由原子直接构成 C、C2O3中碳元素的化合价是+3 D、C2O3充分燃烧的产物为CO2
-
9、下列涉及火箭发射及其系列材料中,主要成分均为非金属单质的是( )A、可作为火箭发动机推进剂的液氧和液氢 B、制作神舟十三号飞船侧壁的铝材 C、返回舱减速伞材料是含碳、氢等元素的锦纶纤维 D、制造航空发动机单晶叶片的核心元素铼
-
10、氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液
②将①得到H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为
③终点时用去的KMnO4溶液
(1)、试配平用KMnO4滴定H2C2O4的离子方程式:
=(2)、到达滴定终点的溶液颜色是。(3)、误差分析:(填“偏高”、“偏低”或“无影响”)①若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果。
②若滴定初始时平视读数,滴定终点俯视读数,则测量结果。
(4)、计算:血液中含钙离子的浓度为mol/L。 -
11、某学生用的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酸碱指示剂;
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)、以上操作步骤中有一步有错误,请指出编号 , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)。(2)、(双选)下列操作会引起实验结果偏大的是( )A、在锥形瓶装液前,留有少量蒸馏水 B、滴定前,装标准碱液的滴定管尖嘴有气泡,滴定后无气泡 C、锥形瓶先用蒸馏水洗涤后,再用待测液润洗 D、用滴定管量取待测液时将一滴待测液滴在锥形瓶外(3)、最合适的酸碱指示剂为 , 它的变色范围是。判断达到滴定终点的现象是。(4)、以下是实验数据记录表。滴定次数
盐酸体积(mL)
NaOH溶液的读数(mL)
滴定前
滴定后
1
20.00
0.00
18.25
2
20.00
0.10
18.45
3
20.00
0.30
19.75
通过计算可得,该盐酸浓度为:mol/L。
-
12、试根据沉淀溶解平衡知识回答问题:
常温下,CaS的 , 饱和溶液中存在平衡:。
(1)、该温度下,将氯化钙溶液硫化钠溶液等体积混合,(填“能”或“不能”)产生沉淀。滴加少量盐酸,(填“增大”或“减小”),请从平衡移动原理的角度解释:。(2)、若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式。(3)、已知 , 在的溶液中,当刚开始沉淀时,溶液的pH为(保留1为小数,下同);若要使其沉淀完全,pH的范围是。 -
13、下表是几种弱电解质的电离平衡常数(25℃)
平衡常数的计算:电解质
电离方程式
平衡常数K
(1)、用溶液滴定20.00mL某未知浓度的一元酸HX溶液,如右图所示。其中①点所示溶液中 , ③点所示溶液中存在 , 则HX的电离平衡常数。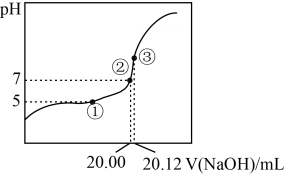 (2)、水解反应是典型的可逆反应。请写出Na2CO3水解反应的离子方程式:。(3)、水解反应的化学平衡常数称为水解常数(用表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:。根据上表数据计算,25℃该常数的数值为(保留2位小数)。
(2)、水解反应是典型的可逆反应。请写出Na2CO3水解反应的离子方程式:。(3)、水解反应的化学平衡常数称为水解常数(用表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:。根据上表数据计算,25℃该常数的数值为(保留2位小数)。 -
14、下表是几种弱电解质的电离平衡常数(25℃)
电解质
电离方程式
平衡常数K
回答下列问题:
(1)、由上表分析,若①CH3COOH②③HA④均可看作酸,则它们酸性由强到弱的顺序为(填序号)。(2)、试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:;试写出HA与Na3PO4反应的离子方程式:。(3)、25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:(填“>”、“=”或“<”)。(4)、(双选)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( )A、若混合液pH>7,则V≥10 B、若混合液pH<7,则 C、V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 D、V=5时,(5)、已知BaSO4的溶解度随温度升高而增大。如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题: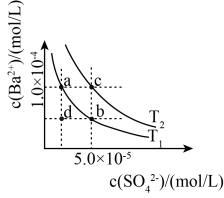
①T1T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
-
15、(双选)下列有关说法中错误的是( )A、某温度时的混合溶液中 , 说明该溶液呈中性(为该温度时水的离子积常数) B、常温下,由水电离出的的溶液的pH可能为2或12 C、已知 , , 向含有、且浓度均为0.010mol/L溶液中逐滴加入0.010mol/L的AgNO3溶液时,先产生沉淀 D、常温下CH3COOH的电离平衡常数 , 某pH=4.8的CH3COOH和CH3COONa混合溶液中,
-
16、已知。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
 A、a点没有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,达到新平衡后增大 D、CuS和MnS共存的悬浊液中,
A、a点没有ZnS沉淀生成 B、可用MnS除去MnCl2溶液中混有的少量ZnCl2 C、向CuS悬浊液中加入少量水,平衡向溶解的方向移动,达到新平衡后增大 D、CuS和MnS共存的悬浊液中, -
17、关于沉淀溶解平衡和溶度积常数,下列说法错误的是( )A、只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 B、向1mL2mol/LNaOH溶液中先滴加2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液,先生成白色沉淀,后生成红褐色沉淀,说明 C、25℃时在水中的溶解度大于其在溶液中的溶解度 D、已知某温度下 , , 则的平衡常数约为
-
18、已知:25℃时, , 。下列说法正确的是( )A、25℃时,饱和溶液与饱和溶液相比,前者的大 B、25℃时,在的悬浊液加入少量的NH4Cl固体,增大 C、25℃时,固体在20mL0.01mol/L氨水中的比在20mL0.01mol/LNH4Cl溶液中的小 D、25℃时,在的悬浊液加入NaF溶液后,不可能转化成为MgF2
-
19、下列叙述正确的是( )A、醋酸溶液的导电能力可能比稀硫酸强 B、硫磺是单质,不导电,因此硫磺是非电解质 C、SO3溶于水,其水溶液能导电,故SO3是电解质 D、强电解质都是离子化合物,因此NaCl是离子化合物
-
20、和的大量排放会对环境产生影响,科学家在积极探索用化学方法吸收并综合利用CO和(1)、I.重整吸收。主要反应如下:
①
②
在容积固定的某密闭容器中,反应物投料比按发生上述反应,CO2、CH4的平衡转化率随温度变化的曲线如右图所示。
根据消耗可以判断:图中曲线(选填“A”或“B”)表示CO2的平衡转化率随温度的变化趋势。
提高CH4的平衡转化率的措施为(列举一条)。
(2)、图中X点的v(CH4 , 正)v(CH4 , 逆)(选填“>”、“<”或“=”)。若起始 , 反应至5min时,CH4的转化率达到Y点,且为0.2mol/L,则0~5min内H2O(g)的平均反应速率v=mol/(L·min)。
(3)、Ⅱ.ZnO悬浊液吸收 , 再催化氧化得到硫酸盐。向ZnO悬浊液中缓缓通入SO2 , SO2吸收率及溶液pH变化如图所示。已知:微溶于水,易溶于水。
在0~10min,溶液pH几乎保持不变,该阶段主要产物为(填化学式)。在30~40min,SO2吸收率迅速降低,该阶段主要反应的离子方程式为。 (4)、调节吸收SO2所得溶液的pH为4.5~6.5,缓缓通入O2 , 则溶液pH将(选填“增大”、“减小”或“不变”)。
(4)、调节吸收SO2所得溶液的pH为4.5~6.5,缓缓通入O2 , 则溶液pH将(选填“增大”、“减小”或“不变”)。