相关试卷
-
1、下列生产或实验事实引出的结论不正确的是( )
选项
事实
结论
A
室温下,分别向2支试管中加入相同体积、相同浓度的溶液,再分别加入相同体积不同浓度的稀硫酸,比较析出沉淀所需时间
当其他条件不变时,反应物浓度增大,化学反应速率加快
B
向含有少量I2的淀粉溶液中加入NaOH溶液并加热,蓝色褪去
NaOH是淀粉水解的催化剂
C
往黄色固体难溶物中加水,振荡,静置。取上层清液,然后加入NaI固体,产生黄色沉淀
难溶物存在沉淀溶解平衡
D
A、B两支试管中分别加入等体积5%的溶液,在B中加入2~3滴溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
A、A B、B C、C D、D -
2、豆科作物的根瘤菌有固氮能力,其工作原理为:
下列叙述错误的是( )
A、第一步反应属于氮的自然固定 B、将盛有棕色根瘤菌的玻璃瓶充满空气后密封,置于冰水中冷却,棕色会变浅至无色 C、豆科作物在潮湿环境下生长速率较快,与第四步反应的速率有关 D、第一步反应是吸热反应,所以这步的反应速率最慢 -
3、下列图示与对应叙述不相符的是( )
 A、图1各物质均为气体,热化学方程式为: B、图2为在绝热恒容密闭容器中发生反应 , a、b、c三点中,c点逆反应速率最大,且曲线上点都未达到平衡状态 C、图3为合成氨反应中,其它条件不变时,起始时用量对反应的影响图,则图中温度 , a、b、c三点中,的转化率最高的是b点 D、图4中,对于恒温下的反应 , F点存在
A、图1各物质均为气体,热化学方程式为: B、图2为在绝热恒容密闭容器中发生反应 , a、b、c三点中,c点逆反应速率最大,且曲线上点都未达到平衡状态 C、图3为合成氨反应中,其它条件不变时,起始时用量对反应的影响图,则图中温度 , a、b、c三点中,的转化率最高的是b点 D、图4中,对于恒温下的反应 , F点存在 -
4、下列有关实验装置、操作的描述中正确的是( )
A
B
C
D




制取无水
测定NaClO溶液的pH值
记录滴定终点读数为12.20mL
检查碱式滴定管是否漏液
A、A B、B C、C D、D -
5、下列有关中和滴定实验的叙述正确的是( )A、中和滴定实验中所用标准溶液越浓越好,指示剂的用量一般为2~3mL B、滴定管、锥形瓶均应先水洗后润洗 C、进行滴定时眼睛应注意锥形瓶内溶液的颜色变化而不应注意滴定管内的液面变化 D、用标准盐酸滴定待测NaOH溶液时,若滴定前仰视读数,滴定后俯视,则测定值偏大
-
6、25℃时,CuS和ZnS悬浊液中对应离子浓度的对数值与的关系如图所示。下列说法不正确的是( )
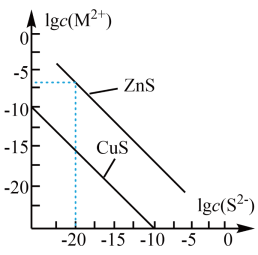 A、25℃时,ZnS的溶解度更大 B、25℃时,约为 C、在ZnS悬浊液中加入 , 可以发生反应 D、已知温度升高,CuS的溶解度增大,则图中对应线段向下平移
A、25℃时,ZnS的溶解度更大 B、25℃时,约为 C、在ZnS悬浊液中加入 , 可以发生反应 D、已知温度升高,CuS的溶解度增大,则图中对应线段向下平移 -
7、某化学反应在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度()随反应时间(min)的变化情况如下表:
实验序号
时间
浓度
温度0
10
20
30
40
50
60
1
800℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800℃
1.0
0.60
0.50
0.50
0.50
0.50
0.50
3
800℃
c
0.92
0.75
0.63
0.60
0.60
0.60
4
820℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
下列说法不正确的是( )
A、 B、实验2可能使用了催化剂 C、正反应是吸热反应 D、50~60分钟内,实验4的平均反应速率比实验3的大 -
8、下列事实中,不能用勒夏特列原理解释的是( )A、常压环境更有利于工业上催化氧化制 B、用浓氨水和氢氧化钠固体快速制取氨气 C、新制氯水中加入适量碳酸钠固体制高浓度次氯酸溶液 D、氯化钠固体和浓硫酸共热制少量氯化氢气体
-
9、某兴趣小组用数字实验系统测定一定浓度溶液的pH与温度的关系,得到如图所示曲线。下列说法正确的是( )
 A、a点阴离子总数最多 B、b点溶液去油污效果最好 C、c点水的离子积最大 D、温度升高,水的电离程度先增大后减小
A、a点阴离子总数最多 B、b点溶液去油污效果最好 C、c点水的离子积最大 D、温度升高,水的电离程度先增大后减小 -
10、下列离子方程式的书写正确的是( )A、的水解: B、的电离: C、实验室制胶体: D、含氟牙膏防治龋齿的原理:
-
11、下列生产、生活中的应用与盐类水解无关的是( )A、为保存溶液,要在溶液中加入少量盐酸 B、溶液与溶液均可作焊接金属中的除锈剂 C、加入到大量水中制 D、NaOH、Al粉的混合物作管道疏通剂
-
12、化学燃料是现阶段火箭的主要动力来源,从能量密度(单位质量的燃料提供的能量)角度考虑,最适合做火箭推进剂的是( )A、液氧-液态甲烷(甲烷燃烧热为893) B、液氧-液氢(氢气燃烧热为286) C、液氧-煤油(煤油热值为) D、液氧-液氨(氨气燃烧热为316)
-
13、二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:(1)、I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g)CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g)CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
有利于反应①自发进行的条件是(填“高温”或“低温”);根据表中数据计算反应②的焓变△H2(298K)=kJ·mol-1。物质
H2(g)
O2(g)
CO(g)
CO2(g)
H2O(g)
CH4(g)
标准摩尔生成焓(kJ·mol-1)
0
0
-110.5
-393.5
-241.8
-74.81
(2)、在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g)的浓度为mol·L-1 , 反应II的平衡常数为(列出计算式)。(3)、甲烷三重整制氢的逆反应CO(g)+3H2CH4(g)+H2O(g)。合成总反应在起始物=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。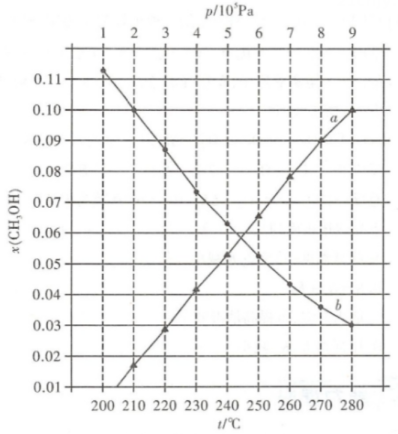
①当CO的平衡转化率为时,反应条件可能是。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是。
-
14、合成氨工业和硫酸工业在国民经济中占有重要地位。(1)、在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是。(2)、将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g)2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是____(填标号,下同)。A、容器内的压强不再变化 B、相同时间内,断开H-H键的数目和生成N-H键的数目相等 C、容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2 D、N2的体积分数不再发生变化(3)、接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g)2SO3(g) △H=akJ·mol-1其催化机理分为三步:
第1步:SO2(g)+V2O5(s)SO3(g)+V2O4(s) △H=bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g)2VOSO4(s) △H=ckJ·mol-1
第3步:_______。
第3步热化学方程式(△H的值用a、b、c的代数式表示)。(4)、T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为;从反应开始至达到平衡,用SO3表示反应速率为。(5)、为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是____。 A、温度越高,反应速率越大 B、可根据不同α下的最大速率,选择最佳生产温度 C、α=0.88的曲线代表平衡转化率 D、α越大,反应速率最大值对应温度越低(6)、为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是(填标号)。
A、温度越高,反应速率越大 B、可根据不同α下的最大速率,选择最佳生产温度 C、α=0.88的曲线代表平衡转化率 D、α越大,反应速率最大值对应温度越低(6)、为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是(填标号)。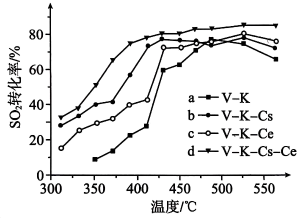 (7)、设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。
(7)、设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。 -
15、化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过测量反应前后体系温度变化计算测得。(1)、盐酸浓度的测定:移取20.00mL待测液,向其中滴加两滴酚酞溶液,用0.5000mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液22.00mL。
①上述滴定操作用到的仪器有(填标号,下同)。

②该盐酸浓度为mol·L-1。
③该实验到达滴定终点时的现象是。
④下列关于滴定的操作及分析,正确的是。
A.碱式滴定管量取NaOH溶液时,未进行润洗,测量结果将偏高
B.滴定时应一直观察滴定管中溶液体积的变化
C.终点读数时如果俯视测量结果将偏高
D.平行滴定时,须重新装液并调节液面至“0”刻度
(2)、热量 测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1 , 则该过程放出的热量为J(为了计算方便,可近似认为实验所用的稀溶液的密度为1.0g·mL-1 , 比热容为4.18J·g-1·℃-1 , 忽略水以外各物质吸收的热量,下同)。 (3)、借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=FeSO(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响)。实验结果见下表。
测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1 , 则该过程放出的热量为J(为了计算方便,可近似认为实验所用的稀溶液的密度为1.0g·mL-1 , 比热容为4.18J·g-1·℃-1 , 忽略水以外各物质吸收的热量,下同)。 (3)、借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=FeSO(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响)。实验结果见下表。序号
反应试剂
体系温度/℃
反应前
反应后
i
0.2mol·L-1CuSO4溶液100mL
1.20g铁粉
a
b
ii
0.56g铁粉
a
c
①温度:bc(填“>”“<”或“=”)。
②△H=kJ·mol-1(选择表中一组数据计算)。
-
16、回答以下问题。(1)、Sb2O3可用作白色颜料和阻燃剂等。在实验室中可利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分三步进行,中间产物有SbOCl等),写出SbCl3水解生成SbOCl的水解反应方程式;SbCl3水解的总反应可表示为:2SbCl3+3H2OSb2O3+6HCl为了得到较多的Sb2O3 , 操作时要将SbCl3缓慢加入大量水中的原因是。(2)、次磷酸(H3PO2)是一种弱酸,将等体积、等物质的量浓度的H3PO2溶液和NaOH溶液混合,所得溶液中阴离子只有、OH-两种。写出H3PO2溶液与NaOH溶液恰好完全反应的溶液中各离子浓度由大到小的顺序为。(3)、已知Cr(OH)3与NaOH溶液反应生成Na[Cr(OH)4],与稀硫酸反应生成Cr2(SO4)3 , 写出Cr(OH)3在水中的电离方程式、。(4)、一定温度下,用水吸收SO2气体时,溶液中水的电离平衡移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中c():c(H2SO3)=(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2 , Ka2=2.5×10-7)。(5)、某温度下,pH=3的盐酸中c(OH-)=1×10-9mol·L-1;该温度下pH=2的H2SO4溶液与pH=11的NaOH溶液混合后溶液的pH=9,则H2SO4与NaOH溶液的体积比为。
-
17、知:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示。

下列说法不正确的是( )
A、该反应的ΔH>0 B、X点CH4的转化率为20% C、X点与Y点容器内压强比 51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
-
18、如图,I是恒压密闭容器,II是恒容密闭容器。其它条件相同时,在I、II中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡:2X(?)+Y(?)aZ(g)(X、Y状态未知)。此时I中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
 A、若X、Y均为气态,则平衡时的压强:II>I B、若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 C、若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II D、平衡时I容器的体积小于VL
A、若X、Y均为气态,则平衡时的压强:II>I B、若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 C、若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II D、平衡时I容器的体积小于VL -
19、常温下,将0.01molH2S气体通入到100mL0.1mol·L-1NaOH溶液中,反应后溶液的pH=10。将反应后的混合液放置一段时间后,溶液的pH>10。忽略反应后溶液体积的变化,设NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温下,HS-的电离常数小于其水解常数 B、放置前的混合溶液中由水电离产生的H+的数目为10-11NA C、放置后溶液中可能发生反应:2HS-+O2=2S↓+2OH- D、反应后pH=10的溶液中:c(S2-)+c(HS-)+c(H2S)=0.1mol·L-1
-
20、探究物质在水中的行为有重要意义。25℃时,下列说法错误的是( )
①将pH=10的NaOH溶液与pH=12的NaOH溶液等体积混合后的pH接近于11.7(已知lg2=0.3);
②pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4;
③向pH=m的盐酸中加入pH=n的氢氧化钠溶液,恰好完全反应时,测得盐酸与氢氧化钠溶液的体积比为10:1,则m+n=13;
④若NaHA的溶液呈酸性,可以推测H2A为强酸;
⑤pH=7.0的NaClO和HCO(Ka=4.0×10-8)的混合溶液中,c(HClO)>c(ClO-)=(Na+);
⑥pH=9的CH3COONa溶液与pH=9的NaOH溶液,水的电离程度相同;
⑦等物质的量浓度的四种溶液a.NH3·H2O、b.NH4HSO4、c.(NH4)2CO3、d.NH4Cl,其中c(NH)的关系为b>c>d>a
A、③④⑥⑦ B、①④⑤⑥ C、①③⑤⑦ D、②③⑤⑥