相关试卷
-
1、生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:(1)、冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用(填“放热”或“吸热”)的化学变化或物理变化。(2)、“即热饭盒”给人们生活带来方便,它可利用下面____(填字母)反应释放的热量加热食物。A、生石灰和水 B、浓硫酸和水 C、纯碱和水 D、食盐和白醋(3)、研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1 , 甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。
(4)、以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。
-
2、已知25℃时,关于0.1mol/L醋酸溶液 , 下列说法正确的是( )A、升高温度,醋酸的电离程度增大,增大 B、向该溶液中通入HCl气体,平衡逆向移动,减小 C、该温度下1mol/L的醋酸溶液 D、加水稀释后,溶液中增大
-
3、关于合成氨反应 , 下列说法不正确的是( )A、使用高效催化剂能减小反应活化能 B、为了提高原料利用率,和循环使用 C、工业合成氨温度为700K是因为升高温度有利于提高的平衡转化率 D、恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态
-
4、对反应A+3B⇌2C来说,下列反应速率中最快的是( )A、υ(B)=0.9 mol/(L•min) B、υ(B)=0.6 mol/(L•min) C、υ(C)=0.5 mol/(L•min) D、υ(A)=0.5 mol/(L•min)
-
5、利用如图所示装置可以将温室气体CO2转化为燃料气体CO,下列说法正确的是( )
 A、该过程中包括太阳能、化学能、电能间的转化 B、电极a上发生还原反应 C、该装置工作时,H+从b极区向a极区移动 D、该装置中每生成1molCO,同时生成1molO2
A、该过程中包括太阳能、化学能、电能间的转化 B、电极a上发生还原反应 C、该装置工作时,H+从b极区向a极区移动 D、该装置中每生成1molCO,同时生成1molO2 -
6、将浓度为0.05mol/L的HClO的溶液加水不断稀释,下列各量始终保持增大的是( )A、 B、c(HClO) C、 D、
-
7、对于反应N2O4(g)2NO2(g)ΔH>0,要使该反应的平衡常数值增大,可以采取的措施有( )A、增大N2O4的浓度 B、增大NO2的浓度 C、升高体系的温度 D、减小压强
-
8、反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、
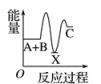 B、
B、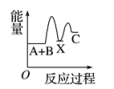 C、
C、 D、
D、
-
9、用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.2mol/LNa2SO4溶液中含有Na⁺和总物质的量为0.6mol B、标准状况下,22.4L乙醇所含分子数为NA C、65gZn与足量H2SO4完全反应生成的H2所含原子数目为2NA D、11.2L氢气在足量的O2中完全燃烧,生成的水分子数为0.5NA
-
10、对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是( )A、反应的ΔS>0 B、反应的平衡常数可表示为K= C、增大体系的压强能提高SO2的反应速率和转化率 D、使用催化剂能改变反应路径,提高反应的活化能
-
11、已知反应: 。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线a变为曲线b,可采取的措施是( )
 A、增大反应容器的体积 B、减小B的浓度 C、升高温度 D、缩小反应容器的体积
A、增大反应容器的体积 B、减小B的浓度 C、升高温度 D、缩小反应容器的体积 -
12、下列热化学方程式书写正确的是( )A、2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 B、H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 C、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ D、C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
-
13、我国在探索太空、开发深海、建设高铁、5G技术等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )A、航天服壳体使用的铝合金材料熔点比纯铝高 B、打印机墨粉中常加有Fe3O4 , 这是利用了其颜色和磁性特点,可用CuO替代Fe3O4 C、华为5G手机芯片的主要成分是二氧化硅 D、中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料
-
14、实验室需要溶液和硫酸溶液。根据这两种溶液的配制情况回答下列问题:(1)、如下图所示的仪器中,配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器有(填仪器名称)。
A.
 B.
B. C.
C. D.
D. (2)、配制溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
(2)、配制溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次)。A.将容量瓶盖紧,颠倒摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
D.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
(3)、配制溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度(填“偏高”、“偏低”或“无影响”)。(4)、配制硫酸溶液480mL时,所需量取质量分数为98%、密度为的浓硫酸的体积为mL(保留1位小数)。(5)、配制硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度。(填“偏大”、“偏小”或“无影响”)(6)、配制溶液时,所需称取的质量g。 -
15、氯气、“84”消毒液、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:
 (1)、盛装浓盐酸的仪器的名称为 , 装置甲中发生反应的化学方程式为。(2)、装置丁用来收集纯净且干燥的氯气,进气口为(填a或b);装置乙盛装的试剂是。(填名称)(3)、将氯气通入装置己中制备“84”漂白液,则装置己中发生反应的化学方程式为 , 有同学认为装置己还有一个作用,该作用为。(4)、装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为。
(1)、盛装浓盐酸的仪器的名称为 , 装置甲中发生反应的化学方程式为。(2)、装置丁用来收集纯净且干燥的氯气,进气口为(填a或b);装置乙盛装的试剂是。(填名称)(3)、将氯气通入装置己中制备“84”漂白液,则装置己中发生反应的化学方程式为 , 有同学认为装置己还有一个作用,该作用为。(4)、装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为。 -
16、请回答下列相关问题。(1)、现有以下物质:①熔融的;②Cu;③;④70%的乙醇;⑤;⑥稀硫酸。以上物质中属于混合物的是(填序号,下同),属于电解质的是 , 属于氧化物的是 , 能导电的是。(2)、请写出下列物质在水溶液中的电离方程式。
①; ②。
(3)、钙及其化合物之间的转化关系如下图所示:
上述反应中,属于化合反应的是(填序号,下同),属于复分解反应的是。
-
17、根据所学知识,回答下列问题:(1)、Ⅰ.硫酸是一种重要的工业原料。
稀硫酸具有酸性,稀硫酸溶液中,mol。(2)、稀硫酸与铝恰好完全反应,所得溶液中含有 , 则该溶液中物质的量浓度为。(3)、Ⅱ.回答下列问题:
在同温同压下,和两种气体,密度比为 , 若两者质量相等,其体积比为。(4)、中,核外电子总数比质子总数多 , 则R的摩尔质量为。(5)、实验室利用反应制取氧气,现有参加反应,计算得到标准状况下的氧气的体积是L。(6)、某元素G的一种含氧酸化学式为 , 属于二元酸,则与过量氢氧化钠溶液反应生成的产物为((填“酸式盐”或“正盐”)。(7)、某密闭容器,中间有一可自由滑动的隔板(厚度忽略不计)将容器分成两部分,装置如图所示(左、右两侧温度相同)。左边充入氦气,右边充入和的混合气体,原子总数为共 , 则左右两室体积比为。
-
18、化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是( )
产品名称:盐酸
化学式:
产品等级:分析纯
质量分数:36.5%
密度:
A、该试剂瓶中的盐酸属于纯净物 B、配制的稀盐酸需该盐酸 C、该盐酸物质的量浓度为 D、配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中 -
19、营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表所示:
离子种类
R离子
浓度()
____
0.03
0.03
0.01
该营养液中R离子及其物质的量浓度可能是( )
A、 B、 C、 D、 -
20、氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影部分的是( )
 A、 B、 C、 D、
A、 B、 C、 D、