相关试卷
-
1、 下列有关物质燃烧的说法不正确的是( )A、燃烧一定会放出热量 B、燃烧一定是氧化还原反应 C、氢气可以在氯气中燃烧 D、钠燃烧的产物是Na2O
-
2、 下列有关实验基本操作正确的是( )A、加热固体
 B、移走蒸发皿
B、移走蒸发皿 C、收集CO2
C、收集CO2 D、稀释浓硫酸
D、稀释浓硫酸
-
3、 检验某未知液中的离子,下列有关实验操作、实验现象和结论均正确的是( )
选项
实验操作
实验现象
结论
A
用铂丝蘸取某溶液在煤气灯外焰上灼烧
焰色为黄色
原溶液中存在Na+
B
用试管取少量某溶液,滴加硝酸银溶液
产生白色沉淀
原溶液中存在Cl-
C
用试管取少量某溶液,滴加足量稀盐酸,将产生的无色无味气体通入澄清石灰水中
石灰水变浑浊
原溶液中存在CO32-
D
用试管取少量某溶液,滴加氯化钡溶液
产生白色沉淀
原溶液中存在SO42-
A、A B、B C、C D、D -
4、 氢化钠(NaH)可在野外作生氢剂,其中氢显-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是( )A、该反应属于置换反应 B、该反应是复分解反应 C、NaH中氢元素被氧化 D、在标准状况下,生成11.2LH2 , 则转移电子的物质的量为1mol
-
5、 水是一种常见的物质,有很多物质能与水发生反应,在不同反应中,水的作用不相同。下列反应中,水作还原剂的是( )A、2F2+2H2O = 4HF+O2 B、3NO2+H2O = 2HNO3+NO C、2Na2O2+2H2O = 4NaOH+O2↑ D、CaO+H2O = Ca(OH)2
-
6、化学反应有四种基本反应类型,分为化合反应、分解反应、置换反应和复分解反应,其中一定不是氧化还原反应的是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应
-
7、 氧化还原反应的实质是电子的转移,特征是有元素化合价的升降。下列变化中,不涉及氧化还原反应的是( )A、金属的冶炼 B、钢铁的锈蚀 C、食物的腐败 D、钟乳石的形成
-
8、下列各组中的离子,能在溶液中大量共存的是( )A、K+、H+、SO42-、Ba2+ B、Mg2+、Cu2+、Cl-、SO42- C、Ca2+、Na+、Cl-、CO32- D、Na+、H+、HCO3-、NO3-
-
9、下列离子方程式中,正确的是( )A、铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑ B、碳酸钙与稀硝酸反应:CO32-+2H+ = CO2↑+H2O C、氢氧化钡与稀硫酸反应:OH-+H+ = H2O D、石灰水中通入过量的CO2:OH- + CO2 = HCO3-
-
10、常用干燥剂分为固态和液态,下列有关干燥剂的说法不正确的是( )A、许多食品包装袋中有一个小纸袋,盛有生石灰,作用是作干燥剂 B、浓硫酸具有强氧化性,不能干燥强还原性气体 C、碱石灰可以干燥氯气 D、干燥气体时,固态干燥剂用干燥管盛放
-
11、下列有关物质分类的说法不正确的是( )A、SO2属于酸性氧化物 B、纯碱属于碱 C、次氯酸属于弱酸 D、Cu2(OH)2CO3属于盐
-
12、当光束通过下列物质时,会出现丁达尔效应的是( )A、水 B、云、雾 C、FeCl3溶液 D、蔗糖溶液
-
13、下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )A、小苏打的有效成分是Na2CO3 , 可做发酵粉 B、食盐的有效成分是NaCl,可做调味剂 C、复方氢氧化铝片的有效成分是Al(OH)3 , 可做抗酸剂 D、漂白粉的有效成分是Ca(ClO)2 , 可做消毒剂
-
14、萘氧啶具有抗肿瘤作用,它的一种合成路线如图所示。

已知:①
②

请根据所学知识回答下列问题:
(1)、C中含氧官能团有(填名称),M的名称是。(2)、萘氧啶的分子式为 , E的结构简式为。(3)、B→C的化学方程式为。E→F的反应类型是。(4)、在B的芳香族同分异构体中,既能发生水解反应又能发生银镜反应的结构有种(不包括立体异构体),其中,在核磁共振氢谱上峰面积比为1:1:2:6的结构简式可能为(任写一种)。(5)、以甲苯和 为原料合成
为原料合成 , 设计合成路线(无机试剂
, 设计合成路线(无机试剂任选)。
-
15、尿素是一种重要的氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现碳的固定。(1)、合成尿素分图示的两步进行:

2NH3(g)+CO2(g)= (s)+H2O(l),则ΔH=kJ/mol(2)、某课题组使用氢氧化铟纳米晶电催化剂直接由和高选择性地合成。
①上述和转化中,被还原的物质是(填化学式)。
②上述转化中,控速步骤是(填标号)。
A.
B.
C.
D.
(3)、在恒温恒容密闭容器中投入1mol 和2mol 合成尿素,原理是。下列情况表明该反应达到平衡状态的是____(填标号)。A、气体密度不随时间变化 B、体积分数不随时间变化 C、气体总压强不随时间变化 D、、的转化率之比不随时间变化(4)、在恒容密闭容器中发生反应: , 测得的平衡转化率与起始投料比[ , 分别为1:1、2:1、3:1]、温度关系如图所示。
①在相同投料比下,升高温度,的平衡转化率降低的主要原因是。
②曲线a代表的投料比为。
③若下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,分压的平均变化率为 , M点对应条件下的平衡常数为(列出计算式即可)。-
-
16、某小组设计实验探究的性质,装置如图所示。

观察到的实验现象如下:
装置标号
A
B
C
D
E
现象
溶液不褪色
溶液变无色
?
产生白色沉淀
产生黄色浑浊
已知:NO能被酸性氧化成 , 与碱石灰不反应。
回答下列问题:
(1)、实验室制宜选择下列试剂中的____(填标号)。A、粉末和浓硝酸D.粉末和10%盐酸 B、粉末和70%浓硫酸 C、粉末和30%稀硝酸(2)、依据实验现象判断在(填化学式)存在下表现漂白性,预测C中现象是。(3)、D中产生的白色沉淀是(填化学式),D中发生反应的离子方程式为。(4)、E中现象表明具有的性质是(填标号)。a.漂白性 b.酸性 c.氧化性 d.还原性
(5)、为了证明的漂白性是暂时性的,请设计一个补充实验:。(6)、为处理上述实验尾气,下列装置中可供选择的是(填标号)。
-
17、硫化镉(CdS)是一种新型半导体材料,一种以镉铜渣(主要成分是Cd、Cu,还含少量Fe等)为原料合成CdS的路线(部分条件和产物省略)如下:
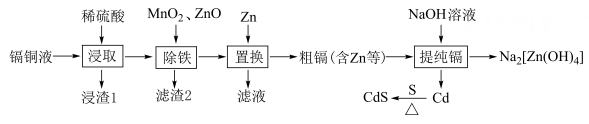
回答下列问题:
(1)、提高“浸取”速率时宜采取的措施主要有____(填标号)。A、粉碎镉铜渣 B、增大压强 C、适当降温 D、适当增大硫酸浓度(2)、“浸渣1”的主要成分是(填化学式)。(3)、“除铁”中加入的作用是。(4)、对“滤液”进行蒸发浓缩、、过滤、洗涤、干燥,得到。(5)、“提纯镉”时加入NaOH溶液除锌反应的离子方程式为。(6)、制备硫化镉时,在氩气氛围中进行,这样操作的目的是。(7)、CdS晶胞的结构如图所示。其晶胞参数为anm,以晶胞参数建立坐标系,1号原子的坐标为 , 3号原子的坐标为 , 设为阿伏加德罗常数的值。
①硫离子的配位数为。
②2号原子的坐标为。
③该晶体的密度为。
-
18、在电池、玻璃、有机合成等工业生产中应用广泛。利用粗(含有MnO和杂质)制取纯的流程如图。

下列说法错误的是( )
A、酸浸过程中有复分解反应发生 B、操作X用到的玻璃仪器为玻璃棒、漏斗、烧杯 C、氧化过程中每生成1mol , 转移的电子数为 D、与热的NaOH溶液反应的离子方程式为 -
19、下列有关说法正确的是( )A、将铜粉加入溶液,铜粉溶解,说明一定条件下铜比铁活泼 B、向某溶液中滴加KSCN溶液,溶液显红色,则该溶液中不含 C、将某气体通入酸性高锰酸钾溶液,溶液褪色,则该气体中一定含有乙烯 D、溶液中存在关系
-
20、铟(In)是制造半导体、电光源等的重要材料。工业上从冶金废料中提取的粗铟中含有锌杂质。以溶液为电解质溶液,用电解法精炼铟的装置如图1所示。
已知:①铟和铝位于同主族,性质与铝相似。
②在金属活动性顺序表中,铟排在锌之后;锌、铟的相对原子质量分别为65、115。
③超钠电池放电时电池反应为。(电解质溶液中溶剂为有机溶剂)

下列叙述正确的是( )
A、M极为阴极 B、超钠电池放电时,a极的电极反应式为 C、精炼铟一段时间后,M极净减的质量等于纯铟极净增的质量 D、精炼过程中,用图2可表示电解质溶液中与时间的变化关系